Визуализация и количественная оценка сигнализации TGFβ/BMP/SMAD в различных условиях напряжения сдвига жидкости с использованием бесконтактного лигирования
Summary
Здесь мы устанавливаем протокол для одновременной визуализации и анализа нескольких комплексов SMAD с использованием анализа бесконтактной перевязки (PLA) в эндотелиальных клетках, подверженных патологическим и физиологическим условиям сдвига жидкости.
Abstract
Трансформирующий фактор роста β (TGFβ)/Костной морфогенетический белок (BMP) передачи сигналов жестко регулируется и сбалансирован во время развития и гомеостаза сосудистой системы Поэтому дерегуляция в этом сигнальном пути приводит к тяжелым сосудистым патологиям, таким как гипертония легочной артерии, наследственная геморрагическая телеангиэктазия и атеросклероз. Эндотелиальные клетки (ЭК), как самый внутренний слой кровеносных сосудов, постоянно подвергаются воздействию напряжения сдвига жидкости (SS). Было показано, что аномальные паттерны жидких SS усиливают передачу сигналов TGFβ / BMP, которые вместе с другими стимулами индуцируют атерогенез. В связи с этим было обнаружено, что атеропрон, низкий ламинарный SS усиливает передачу сигналов TGFβ / BMP, в то время как атеропротекторный, с высоким ламинарной SS уменьшает эту сигнализацию. Для эффективного анализа активации этих путей мы разработали рабочий процесс для исследования образования комплексов транскрипционного фактора в условиях низкого ламинарного SS и высокого ламинарного SS с использованием коммерчески доступной пневматической насосной системы и анализа бесконтактного лигирования (PLA).
Активная TGFβ/BMP-сигнализация требует формирования тримерных SMAD-комплексов, состоящих из двух регуляторных SMAD (R-SMAD); SMAD2/3 и SMAD1/5/8 для сигнализации TGFβ и BMP соответственно) с общим медиатором SMAD (co-SMAD; СМАД4). Используя PLA, нацеленную на различные субъединицы тримерного SMAD-комплекса, т.е. либо R-SMAD/co-SMAD, либо R-SMAD/R-SMAD, образование активных комплексов факторов транскрипции SMAD может быть измерено количественно и пространственно с помощью флуоресцентной микроскопии.
Использование проточных слайдов с 6 небольшими параллельными каналами, которые могут быть соединены последовательно, позволяет исследовать формирование комплекса транскрипционного фактора и включать необходимые элементы управления.
Рабочий процесс, описанный здесь, может быть легко адаптирован для исследований, направленных на близость SMAD к другим факторам транскрипции или к комплексам факторов транскрипции, отличным от SMAD, в различных условиях жидкого SS. Рабочий процесс, представленный здесь, показывает быстрый и эффективный способ изучения жидкостной SS-индуцированной сигнализации TGFβ /BMP в EC, как количественно, так и пространственно.
Introduction
Белки трансформирующего фактора роста бета (TGFβ) суперсемейства являются плейотропными цитокинами с различными членами, включая TGFβs, костные морфогенетические белки (BMP) и активины1,2. Связывание лигандов индуцирует образование рецепторных олигомеров, приводящих к фосфорилированию и, тем самым, активации цитозольного регулятора SMAD (R-SMAD). В зависимости от подсемейства лигандов активируются различные R-SMAD1,2. В то время как TGFβs и активины в основном индуцируют фосфорилирование SMAD2/3, BMP индуцируют фосфорилирование SMAD1/5/8. Тем не менее, накапливаются доказательства того, что BMP и TGFβs/Activins также активируют R-SMAD соответствующих других подсемейств в процессе, называемом «боковой сигнализацией»3,4,5,6,7,8, и что существуют смешанные комплексы SMAD, состоящие как из SMAD1/5, так и из SMAD2/3, членов3,9 . Два активированных R-SMAD впоследствии образуют тримерные комплексы с общим медиатором SMAD4. Эти комплексы транскрипционных факторов затем способны транслоцироваться в ядро и регулировать транскрипцию генов-мишеней. SMAD могут взаимодействовать с различными транскрипционными коактиваторами и ко-репрессорами, что приводит к диверсификации возможностей регулирования генов-мишеней10. Дерегулирование передачи сигналов SMAD имеет серьезные последствия при различных заболеваниях. В соответствии с этим, несбалансированная передача сигналов TGFβ / BMP может привести к тяжелым сосудистым патологиям, таким как гипертония легочной артерии, наследственная геморрагическая телеангиэктазия или атеросклероз3,11,12,13,14.
Эндотелиальные клетки (ЭК) образуют самый внутренний слой кровеносных сосудов и, следовательно, подвергаются напряжению сдвига (SS), силе трения, оказываемой вязким потоком крови. Интересно, что ЭК, находящиеся в частях сосудистой системы, которые подвергаются воздействию высоких уровней однородных, ламинаров СС, содержатся в гомеостатическом и спокойном состоянии. Напротив, ЭК, которые испытывают низкий, неоднородный SS, например, при бифуркациях или меньшем искривлении дуги аорты, являются пролиферативными и активируют воспалительные пути15. В свою очередь, участки дисфункциональных ЭК склонны к развитию атеросклероза. Интересно, что EC в этих атеропроновых областях демонстрируют аберрантно высокие уровни активированных SMAD2/3 и SMAD1/516,17,18. В этом контексте было обнаружено, что усиленная передача сигналов TGFβ/BMP является ранним событием в развитии атеросклеротических поражений19, и было обнаружено, что интерференция передачи сигналов BMP заметно снижает воспаление сосудов, образование атеромы и связанное с этим кальцификацию20.
Анализ бесконтактного лигирования (PLA) является биохимическим методом для изучения белково-белковых взаимодействий in situ21,22. Он опирается на специфичность антител различных видов, которые могут связывать интересующие белки-мишени, что позволяет высокоспецифично обнаруживать эндогенные белковые взаимодействия на уровне одной клетки. Здесь первичные антитела должны связываться со своим целевым эпитопом на расстоянии менее 40 нм, чтобы обеспечить обнаружение23. Таким образом, PLA очень полезен по сравнению с традиционными подходами коиммунопреципитации, где для обнаружения эндогенных белковых взаимодействий требуется несколько миллионов клеток. В PLA видоспецифические вторичные антитела, ковалентно связанные с фрагментами ДНК (называемые зондами Plus и Minus), связывают первичные антитела, и если интересующие белки взаимодействуют, зонды Plus и Minus находятся в непосредственной близости. ДНК перевязывается на следующем этапе, и становится возможным амплификация круговой ДНК. Во время амплификации флуоресцентно меченые комплементарные олигонуклеотиды связываются с синтезированной ДНК, что позволяет визуализировать эти белковые взаимодействия с помощью обычной флуоресцентной микроскопии.
Описанный здесь протокол позволяет ученым количественно сравнивать количество активных транскрипционных комплексов SMAD в условиях атеропротектора и атеропрона SS in vitro с использованием PLA. SS генерируется с помощью программируемой пневматической насосной системы, которая способна генерировать ламинарный однонаправленный поток определенных уровней и позволяет поэтапно увеличивать скорость потока. Этот метод позволяет обнаруживать взаимодействия между SMAD1/5 или SMAD2/3 с SMAD4, а также смешанными R-SMAD комплексами. Он может быть легко расширен для анализа взаимодействий SMAD с транскрипционными сорегуляторами или для транскрипционных факторных комплексов, отличных от SMAD. На рисунке 1 показаны основные этапы протокола, представленные ниже.
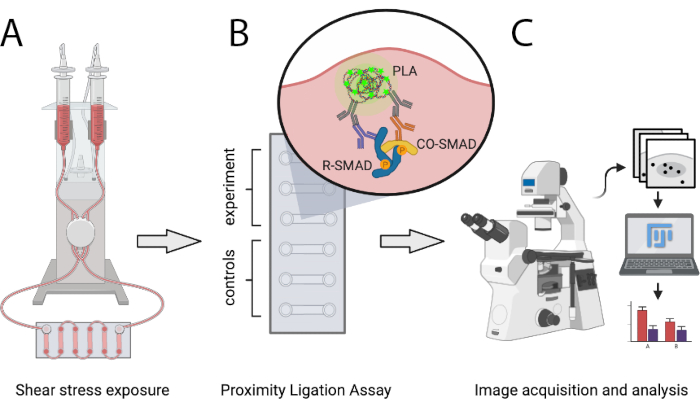
Рисунок 1: Схематическое представление описанного протокола. (A) Ячейки, засеянные в 6-канальные слайды, подвергаются сдвиговому напряжению с помощью пневматической насосной системы. (B) Фиксированные ячейки используются для эксперимента PLA или для контрольных условий. (C) Изображения экспериментов PLA получаются с помощью флуоресцентного микроскопа и анализируются с помощью программного обеспечения для анализа ImageJ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Протокол на основе PLA, описанный здесь, предлагает эффективный способ определения непосредственной близости двух белков (например, их прямого взаимодействия) в ЭК, подверженных сдвиговому напряжению с количественным и пространственным разрешением. Используя проточные слайды с нескол…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим д-ра Марию Райхенбах и д-ра Кристиана Хипена за их поддержку в системе настройки потока, а также Элеонору Фокс и Юньюнь Сяо за критическое прочтение рукописи. P-L.M. финансировалась международной исследовательской школой Макса Планка IMPRS-Biology and Computation (IMPRS-BAC). ПК получила финансирование от DFG-SFB1444. Рисунок 1 был создан с помощью BioRender.
Materials
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
References
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557 (2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756 (2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T., Dijke, P. T., Heldin, C. -. H. . Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. , 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989 (2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980 (2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58 (2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012)
- Application Note 13: HUVECs under perfusion. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019)
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051 (2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965 (2020).

