Real-time cell metabolic flux analyzer gebruiken om osteoblast bio-energetica te monitoren
Summary
Real-time cel metabole flux assay meet het zuurstofverbruik en de extracellulaire verzuringssnelheid, die overeenkomt met mitochondriale en glycolytische adenosinetrifosfaatproductie, met behulp van pH- en zuurstofsensoren. Het manuscript legt een methode uit om de energiestatus van osteoblasten en de karakterisering en interpretatie van de cellulaire bio-energetische status te begrijpen.
Abstract
Botvorming door osteoblasten is een essentieel proces voor een goede botacquisitie en botomzetting om de homeostase van het skelet te behouden en uiteindelijk fracturen te voorkomen. In het belang van zowel het optimaliseren van de piekbotmassa als het bestrijden van verschillende musculoskeletale aandoeningen (d.w.z. postmenopauzale osteoporose, anorexia nervosa, type 1 en 2 diabetes mellitus), zijn ongelooflijke inspanningen geleverd op het gebied van botbiologie om osteoblasten volledig te karakteriseren tijdens hun differentiatieproces. Gezien de primaire rol van volwassen osteoblasten om matrixeiwitten en mineralisatieblaasjes af te scheiden, is opgemerkt dat deze processen een ongelooflijke hoeveelheid cellulaire energie of adenosinetrifosfaat (ATP) vergen. De algehele cellulaire energiestatus wordt vaak cellulaire bio-energetica genoemd en omvat een reeks metabole reacties die de beschikbaarheid van substraat detecteren om ATP af te leiden om aan cellulaire behoeften te voldoen. Daarom beschrijft de huidige methode het proces van het isoleren van primaire, muriene beenmergstromale cellen (BMSCs) en het monitoren van hun bio-energetische status met behulp van de Real-time cel metabole flux analyzer in verschillende stadia van osteoblastdifferentiatie. Belangrijk is dat deze gegevens hebben aangetoond dat het metabole profiel dramatisch verandert tijdens de differentiatie van osteoblasten. Het gebruik van dit fysiologisch relevante celtype is dus vereist om volledig te begrijpen hoe de bio-energetische status van een cel de algehele functie kan reguleren.
Introduction
De vorming van bot door de osteoblast gaat gepaard met gecoördineerde vernietiging of resorptie van botten door osteoclasten. De balans tussen osteoblastische botvorming en osteoclastenresorptie is een gekoppeld proces dat botomzetting of remodellering beschrijft, wat essentieel is voor skelethomeostase. Osteoblastdisfunctie leidt tot verminderde botvorming en resulteert in verschillende ziekten, waaronder osteoporose 1,2,3. Ex vivo/in vitro differentiatie van beenmergstromale stamcellen (BMSCs) naar osteoblastvoorlopers en volwassen osteoblasten resulteert in de vorming en afzetting van de gemineraliseerde botmatrix in het kweekvat in de loop van de tijd 4,5,6. Deze botvorming door de osteoblast vereist een aanzienlijke hoeveelheid cellulaire energie. In het bijzonder is aangetoond dat collageensynthese en secretie sterk afhankelijk zijn van cellulaire ATP: ADP-verhoudingen, en vermoedelijk vereisen gemineraliseerde blaasjeshandel en secretie extra ATP 7,8,9,10,11. Veel onderzoekers hebben aangetoond dat het proces van osteoblastogenese en osteoblastfunctie een voldoende toevoer van energie vereist om te voldoen aan de metabole vraag naar botvorming 12,13,14,15,16. Daarom is het doel van deze methode om de bio-energetische status van primaire, muriene stromale cellen te karakteriseren gedurende osteoblastdifferentiatie met behulp van de real-time cel metabole flux analyzer. Deze technieken helpen bij het ontwikkelen van een beter begrip van skelethomeostase, wat uiteindelijk kan leiden tot de ontwikkeling van nieuwe therapeutische opties die skeletaandoeningen kunnen verbeteren.
De real-time cel metabole flux analyzer kan worden gebruikt om de zuurstofverbruikssnelheid (OCR) en extracellulaire verzuringssnelheid (ECAR) van levende osteoblasten te meten, wat overeenkomt met respectievelijk mitochondriale en glycolytische ATP-productie. Fundamenteel voor deze methodologie is het feit dat één H + –ion per lactaat vrijkomt tijdens glycolyse bij de omzetting van glucose in lactaat, wat de media-pH verandert die wordt weerspiegeld in de ECAR-waarden. Omgekeerd, tijdens de TCA (tricarbonzuur) cyclus, oxidatieve fosforylering via de mitochondriën produceert CO2 door zuurstof te gebruiken of te consumeren, en daarom is het monitoren van OCR een weerspiegeling van dit metabolische proces. De analyzer meet zowel OCR als ECAR in de extracellulaire micro-omgeving tegelijkertijd en in realtime, wat een enorm potentieel mogelijk maakt bij het bestuderen van cellulaire bio-energetica 6,17. Bovendien is het uitvoeren van deze testen relatief eenvoudig en gemakkelijk aan te passen, afhankelijk van het experimentele doel. Vergelijkbare technieken zijn gebruikt om de metabool regulatie van het immuunsysteem18,19, kankerinitiatie en progressie20 verder te begrijpen, samen met meerdere andere celtypen die bijdragen aan metabool syndroom21,22.
De voordelen van real-time metabole flux analyzer ten opzichte van alternatieve technieken omvatten (1) de mogelijkheid om cellulaire bio-energetica van levende cellen in real-time te meten, (2) het vermogen om assay uit te voeren met een relatief klein aantal cellen (vereist slechts 5.000 cellen), (3) injectiepoorten om parallel meerdere behandelingen te manipuleren in een high-throughput 96-well systeem, (4) gebruik van radioactieve labelvrije geautomatiseerde celbeeldcamera voor normalisatie18, 23,24. De volgende methoden zijn bedoeld om een algemene maar gedetailleerde beschrijving te geven van het monitoren van cellulaire bio-energetica in muriene BMSCs gedurende de differentiatie van osteoblasten met behulp van de analyzer. Het omvat routinematig uitgevoerde assays; echter, zoals met veel technieken en methoden, wordt het sterk aangemoedigd dat individuele laboratoria specifieke details voor hun experimenten bepalen.
Selectie van assays en verschillende soorten assays beschikbaar: Een breed scala aan assay kits en reagentia zijn beschikbaar om de bio-energetica van cellen te bestuderen en tegelijkertijd de betrouwbaarheid en consistentie van de experimentele resultaten te waarborgen. Bovendien biedt de desktopsoftware ook testsjablonen die eenvoudig kunnen worden aangepast. De test kan worden gedefinieerd op basis van de behoeften van de gebruiker om verschillende metabole parameters te meten. Deze assays kunnen op verschillende manieren worden aangepast op basis van het experimentele doel en/of de wetenschappelijke vraag. Met vier injectiepoorten kunnen bijvoorbeeld meerdere verbindingen in de testmedia worden geïnjecteerd om de cellulaire respons te analyseren die specifiek is voor elke metabole route.
Celenergie fenotype test: Deze test meet het metabole fenotype en het metabolisch potentieel van de levende cellen. Deze test wordt ook aanbevolen als de eerste stap om een gegeneraliseerd idee te krijgen van pathway-specifiek metabolisme. Een mengsel van oligomycine A-een remmer van ATP-synthase en carbonylcyanide 4-(trifluormethoxy) fenylhydrazon (FCCP)-een mitochondriaal ontkoppelingsmiddel wordt geïnjecteerd om het celenergiepotentieel te begrijpen. De injectie van oligomycine A remt de synthese van ATP, wat resulteert in een toename van de snelheid van glycolyse (ECAR) om de cellen in staat te stellen aan hun energiebehoeften te voldoen; aan de andere kant resulteert de injectie van FCCP in een hogere OCR als gevolg van depolarisatie van het mitochondriale membraan. In wezen toont deze test basale metabole ademhaling en na de dubbele injecties, duwen of spanningen de metabole respons. Op basis van deze parameters plot de software vervolgens OCR en ECAR van de cellen door de cellen te classificeren als aerobe, rustige, glycolytische of energetische toestand in de loop van de tijd25,26.
ATP real-time productiesnelheidstest: Dit meet de cellulaire ATP-productie tegelijkertijd uit glycolyse en mitochondriale ademhaling. Deze test meet kwantitatief de metabole verschuivingen van de twee energieroutes en levert gegevens over de mitochondriale en glycolytische ATP-productiesnelheden in de loop van de tijd. De test verkrijgt basale OCR- en ECAR-gegevens, gevolgd door het berekenen van mitochondriale ATP-productiesnelheid door injectie van oligomycine A en glycolytische ATP-productiesnelheid door injectie van rotenon + antimycine A-mengsel (totale remming van mitochondriale functie), resulterend in mitochondriale verzuring17,27.
Cel mitochondriën stresstest (of cel mito stress test): Dit meet de mitochondriale functie door atp-gebonden ademhaling, kwantificeert cellulaire bio-energetica, identificeert mitochondriale disfunctie en meet de reactie van cellen op stress. Verschillende parameters, waaronder basale en reserve ademhalingscapaciteit, ATP-gebonden ademhaling, maximale ademhaling en niet-mitochondriaal zuurstofverbruik, kunnen in één test worden verkregen. Deze test omvat sequentiële injecties van oligomycine A, FCCP (mitochondriaal ontkoppelingsmiddel), een mengsel van rotenon / antimycine A-remmers om het effect hiervan op de mitochondriale functie efficiënt te analyseren28.
Flexibiliteit mito fuel flex test: Dit meet de mitochondriale ademhalingssnelheid door de oxidatie van de drie primaire mitochondriale brandstoffen door de aan- en afwezigheid van hun remmers. De sequentiële remming van glucose, glutamine en vetzuren helpt bij het meten van de afhankelijkheid, capaciteit en flexibiliteit van cellen en de afhankelijkheid van de cellen in verschillende cellulaire routes om aan de energievraag te voldoen. Wanneer de mitochondriën niet kunnen voldoen aan de eisen van de geblokkeerde route van belang door andere brandstoffen te oxideren, komen de cellen in een afhankelijkheidstoestand. De capaciteit van de cellen wordt berekend door remming van de andere twee alternatieve routes gevolgd door de remming van de route van belang. De flexibiliteit van cellen helpt bij het begrijpen van het vermogen van mitochondriën om te compenseren en te voldoen aan de brandstofbehoeften van de geremde route. Het wordt berekend door de afhankelijkheid van cellen af te trekken van de capaciteit van cellen. Drie verschillende remmers worden onafhankelijk van elkaar of als een mengsel van twee gebruikt om de testparameters effectief te berekenen. 2-cyano-3-(1-fenyl-1H-indol-3-yl)-2-propeenzuur (UK5099) remt de oxidatie van glucose door de pyruvaatdrager in glycolyse te blokkeren. Bis-2-(5-fenylacetamido-1,3,4-thiadiazol-2-yl) (BPTES) ethylsulfide remt de glutamine-oxidatieroute en etomoxir remt de oxidatie van langeketenvetzuren29.
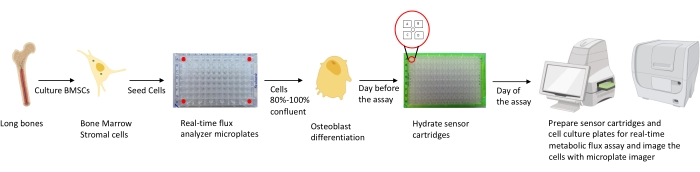
Figuur 1: Schematische weergave van de methodologie voor het kweken en voorbereiden van osteoblasten voor analyse. Murine BMSC’s worden geïsoleerd uit lange botten, gekweekt en gezaaid in 96-well platen met 25.000 cellen / putdichtheid. Het kweken van deze cellen in osteoblastspecifieke media wordt gestart wanneer ze 80% -100% confluentie bereiken om hun differentiatie te starten. De assays worden uitgevoerd in verschillende stadia van differentiatie. De patroonplaten worden een dag voorafgaand aan de test gehydrateerd. Op de dag van de test worden verschillende remmers geïnjecteerd in de poorten van de sensorcartridges op basis van de testvereisten en wordt een kalibratiebuffer toegevoegd aan de 96-well kalibratieplaat. Na kalibratie wordt de real-time cel metabole flux assay uitgevoerd, gevolgd door het in beeld brengen van de celkweekmicroplaat met behulp van de microplate imager om real-time cel metabole flux analyzer gegevens met celgetal te normaliseren. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De real-time cel metabole flux analyzer kan worden gebruikt om cellulaire energetica onder verschillende omstandigheden te verkennen. Het protocol illustreert de efficiënte isolatie van BMSC’s, het kweken van cellen in geschikte celkweekplaten en hun differentiatie tot volwassen osteoblasten, die kunnen worden gebruikt voor verschillende testen met behulp van de extracellulaire fluxanalysator. Verder worden de kritieke stappen van real-time celstofwisselingsfluxtest, inclusief hydratatie van sensorpatronen, laden van de…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door het National Institute of Health (NIH) National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) Grant AR072123 en National Institute on Aging (NIA) Grant AG069795 (aan ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

