Bruke sanntidscelle metabolsk fluksanalysator for å overvåke osteoblastbioenergetikk
Summary
Sanntidscellemetabolisk fluksanalyse måler oksygenforbruket og ekstracellulær forsuringshastighet, som tilsvarer mitokondrie- og glykolytisk adenosin tripfosfatproduksjon, ved hjelp av pH- og oksygensensorer. Manuskriptet forklarer en metode for å forstå energistatusen til osteoblaster og karakterisering og tolkning av cellulær bioenergetisk status.
Abstract
Bendannelse av osteoblaster er en viktig prosess for riktig benanskaffelse og beinomsetning for å opprettholde skjelett homeostase, og til slutt forhindre brudd. I interesse for både å optimalisere topp benmasse og bekjempe ulike muskel- og skjelettsykdommer (dvs. post-menopausal osteoporose, anoreksi nervosa, type 1 og 2 diabetes mellitus), har det blitt gjort utrolige anstrengelser innen beinbiologi for å fullstendig karakterisere osteoblaster gjennom hele differensieringsprosessen. Gitt den primære rollen som modne osteoblaster å skille ut matriseproteiner og mineraliserings vesikler, har det blitt bemerket at disse prosessene tar en utrolig mengde cellulær energi, eller adenosin triphosfat (ATP). Den generelle cellulære energistatusen blir ofte referert til som cellulær bioenergi, og den inkluderer en rekke metabolske reaksjoner som registrerer substrattilgjengelighet for å utlede ATP for å møte cellulære behov. Derfor beskriver den nåværende metoden prosessen med å isolere primære, murine benmargsstromale celler (BMSCer) og overvåke deres bioenergetiske status ved hjelp av sanntidscellemetabolisk fluksanalysator på ulike stadier i osteoblastdifferensiering. Det er viktig at disse dataene har vist at den metabolske profilen endres dramatisk gjennom osteoblastdifferensiering. Dermed er det nødvendig å bruke denne fysiologisk relevante celletypen for å fullt ut sette pris på hvordan en celles bioenergetiske status kan regulere den generelle funksjonen.
Introduction
Dannelsen av bein av osteoblasten er ledsaget av koordinert ødeleggelse eller resorpsjon av bein av osteoklaster. Balansen mellom osteoblastisk bendannelse og osteoklast resorpsjon er en koblet prosess som beskriver beinomsetning eller ombygging, noe som er viktig for skjelett homeostase. Osteoblast dysfunksjon fører til nedsatt bendannelse og resulterer i ulike sykdommer, inkludert osteoporose 1,2,3. Ex vivo/in vitro differensiering av benmargsstromale stamceller (BMSCer) til osteoblastforløpere og modne osteoblaster resulterer i dannelse og avsetning av den mineraliserte beinmatrisen i kulturfartøyet over tid 4,5,6. Denne beindannelsen ved osteoblasten krever en betydelig mengde cellulær energi. Spesielt har kollagensyntese og sekresjon vist seg å stole sterkt på cellulær ATP: ADP-forhold, og antagelig krever mineralisert vesicle trafficking og sekresjon ytterligere ATP 7,8,9,10,11. Mange forskere har vist at prosessen med osteoblastogenese og osteoblastfunksjon krever tilstrekkelig tilførsel av energi for å møte den metabolske etterspørselen etter beindannelse 12,13,14,15,16. Derfor er målet med denne metoden å karakterisere den bioenergetiske statusen til primære, murine stromale celler gjennom osteoblastdifferensiering ved hjelp av sanntidscellemetabolisk fluksanalysator. Disse teknikkene bidrar til å utvikle en bedre forståelse av skjelett homeostase, noe som til slutt kan føre til utvikling av nye terapeutiske alternativer som er i stand til å forbedre skjelettsykdommer.
Sanntidscellemetabolismens fluksanalysator kan brukes til å måle oksygenforbruket (OCR) og ekstracellulær forsuringsrate (ECAR) av levende osteoblaster, som tilsvarer henholdsvis mitokondrie- og glykolytisk ATP-produksjon. Grunnleggende for denne metoden er det faktum at en H + ion per laktat frigjøres under glykolyse i konvertering av glukose til laktat, noe som endrer media pH reflektert i ECAR-verdiene. Motsatt, under TCA (trikarboksylsyre) syklus, oksidert fosforylering via mitokondriene produserer CO2 ved å bruke eller konsumere oksygen, og derfor overvåking OCR reflekterer denne metabolske prosessen. Analysatoren måler både OCR og ECAR i det ekstracellulære mikromiljøet samtidig og i sanntid, noe som gir et enormt potensial når man studerer cellulær bioenergi 6,17. I tillegg er det relativt enkelt å utføre disse analysene, avhengig av det eksperimentelle målet. Lignende teknikker har blitt brukt for å forstå T-celle metabolsk regulering av immunsystemet18,19, kreftinitiering og progresjon20, sammen med flere andre celletyper som bidrar til metabolske syndromer 21,22.
Fordelene med sanntids metabolsk fluksanalysator over alternative teknikker inkluderer (1) evnen til å måle cellulær bioenergigetikk av levende celler i sanntid, (2) evne til å utføre analyser med et relativt lite antall celler (krever så lite som 5000 celler), (3) injeksjonsporter for å parallelt manipulere flere behandlinger i et 96-brønnssystem med høy gjennomstrømning, (4) bruk av radioaktiv etikettfri automatisert celleavbildning for normalisering18, 23,24. Følgende metoder tar sikte på å gi en generalisert, men detaljert beskrivelse av overvåking av cellulær bioenergi i murine BMSCer gjennom osteoblastdifferensiering ved hjelp av analysatoren. Det vil inkludere rutinemessig utførte analyser; Men som med mange teknikker og metoder, er det sterkt oppmuntret at individuelle laboratorier bestemmer spesifikke detaljer for sine eksperimenter.
Utvalg av analyser og ulike typer analyser tilgjengelig: Et bredt utvalg av analysesett og reagenser er tilgjengelige for å studere bioenergien til celler samtidig som påliteligheten og konsistensen av de eksperimentelle resultatene sikres. I tillegg tilbyr skrivebordsprogramvaren også analysemaler som enkelt kan tilpasses. Analysen kan defineres basert på brukerens behov for å måle ulike metabolske parametere. Disse analysene kan endres på ulike måter basert på det eksperimentelle målet og/eller det vitenskapelige spørsmålet. For eksempel, med fire injeksjonsporter, kan flere forbindelser injiseres i analysemediet for å analysere den cellulære responsen som er spesifikk for hver metabolske bane.
Celleenergi fenotype test: Denne analysen måler levende cellers metabolske fenotype og metabolske potensial. Denne analysen anbefales også som det første trinnet for å få en generalisert ide om banespesifikk metabolisme. En blanding av oligomycin A-an-hemmer av ATP-syntase og Carbonylcyanid 4-(trifluorometoksy) fenylhydrazon (FCCP)-et mitokondrie-frakoblingsmiddel injiseres for å forstå celleenergipotensialet. Injeksjonen av oligomycin A hemmer syntesen av ATP, noe som resulterer i en økning i glykolysehastigheten (ECAR) for å gjøre det mulig for cellene å møte sine energibehov; På den annen side resulterer injeksjonen av FCCP i høyere OCR på grunn av depolarisering av mitokondriemembranen. I hovedsak skildrer denne analysen basal metabolsk åndedrett, og etter de doble injeksjonene, pressene eller stressene, den metabolske responsen. Basert på disse parametrene plotter programvaren deretter OCR og ECAR av cellene ved å klassifisere cellene som aerob, passiv, glykolytisk eller energisk tilstand over tid25,26.
ATP-analyse i sanntidsproduksjonsrate: Dette måler den cellulære ATP-produksjonen samtidig fra glykolyse og mitokondrie respirasjon. Denne analysen måler kvantitativt de metabolske skiftene fra de to energiveiene og gir data om mitokondrie- og glykolytiske ATP-produksjonsrater over tid. Analysen innhenter basale OCR- og ECAR-data etterfulgt av beregning av mitokondrie-ATP-produksjonshastighet gjennom injeksjon av oligomycin A og glykolytisk ATP-produksjonshastighet gjennom injeksjon av rotenon + antimycin En blanding (total hemming av mitokondriefunksjon), noe som resulterer i mitokondrieforsuring17,27.
Celle mitokondrier stress test (eller celle mitokon stress test): Dette måler mitokondriefunksjonen gjennom ATP-koblet respirasjon, kvantifiserer cellulær bioenergi, identifiserer mitokondrie dysfunksjon og måler cellenes respons på stress. Ulike parametere, inkludert basal og ekstra respiratorisk kapasitet, ATP-koblet åndedrett, maksimal respirasjon og ikke-mitokondrie oksygenforbruk, kan oppnås i en analyse. Denne analysen innebærer sekvensielle injeksjoner av oligomycin A, FCCP (mitokondrie-frakoblingsmiddel), en blanding av rotenon/antimycin A-hemmere for effektivt å analysere effekten av disse på mitokondriefunksjonen28.
Fleksibilitet mito drivstoff flex test: Dette måler mitokondrie respirasjonshastigheten ved oksidasjon av de tre primære mitokondriebrenselene ved tilstedeværelse og fravær av deres inhibitorer. Den sekvensielle hemmingen av glukose, glutamin og fettsyrer hjelper til med å måle avhengigheten, kapasiteten og fleksibiliteten til celler og avhengigheten av cellene i ulike cellulære veier for å møte energibehovet. Når mitokondriene ikke kan oppfylle kravene til den blokkerte veien av interesse ved å oksidere andre drivstoff, går cellene inn i en avhengighetstilstand. Kapasiteten til cellene beregnes ved hemming av de to andre alternative banene etterfulgt av hemming av interesseveien. Fleksibiliteten til celler bidrar til å forstå mitokondrienes evne til å kompensere og møte drivstoffbehovene til den hemmede banen. Den beregnes ved å trekke avhengigheten av celler fra cellekapasiteten. Tre forskjellige hemmere brukes uavhengig eller som en blanding av to for effektivt å beregne analyseparametrene. 2-cyano-3-(1-fenyl-1H-indol-3-yl)-2-propenoic acid (UK5099) hemmer oksidasjon av glukose ved å blokkere pyruvatbæreren i glykolyse. Bis-2-(5-fenylacetamido-1,3,4-tiadiazol-2-yl) (BPTES) etylsulfid hemmer glutaminoksidasjonsveien, og etomoksir hemmer oksidasjon av langkjedede fettsyrer29.
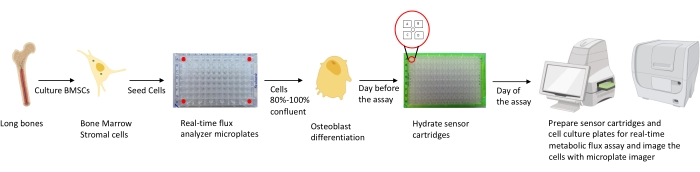
Figur 1: Skjematisk fremstilling av metodikken for dyrking og tilberedning av osteoblaster for analyse. Murine BMSC-er er isolert fra lange bein, dyrket og frøet i 96-brønnsplater ved 25 000 celler / brønntetthet. Kultivering av disse cellene i osteoblastspesifikke medier startes når de når 80% -100% samløp for å starte differensiering. Analysene utføres på forskjellige stadier av differensiering. Patronplatene er hydrert en dag før analysen. På analysedagen injiseres forskjellige inhibitorer i portene til sensorpatronene basert på analysekravene, og en kalibreringsbuffer legges til 96-brønns kalibreringsplaten. Etter kalibrering utføres sanntidscellemetabolismens fluksanalyse, etterfulgt av avbildning av cellekulturmikroplaten ved hjelp av mikroplateavbildningen for å normalisere sanntidscellemetaboliske fluksanalysatordata med celleantall. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Sanntidscellemetabolisk fluksanalysator kan brukes til å utforske cellulære energiske under forskjellige forhold. Protokollen illustrerer effektiv isolering av BMSCer, fortykningsceller i passende cellekulturplater, og deres differensiering til modne osteoblaster, som kan brukes til ulike analyser ved hjelp av den ekstracellulære fluksanalysatoren. Videre forklares også de kritiske trinnene i sanntidscellemetabolisk fluksanalyse, inkludert hydrering av sensorpatroner, lasting av injeksjonsportene, utførelse av analy…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av National Institute of Health (NIH) National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) Grant AR072123 og National Institute on Aging (NIA) Grant AG069795 (til ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

