Визуализация воспалительных каспаз, индуцированных близостью в макрофагах, полученных из моноцитов человека
Summary
Этот протокол описывает рабочий процесс получения макрофагов, полученных из моноцитов (MDM) из образцов крови человека, простой метод эффективного введения воспалительной каспазы бимолекулярной флуоресцентной комплементации (BiFC) в MDM человека без ущерба для жизнеспособности и поведения клеток, а также основанный на визуализации подход к измерению активации воспалительной каспазы в живых клетках.
Abstract
Воспалительные каспазы включают каспазу-1, -4, -5, -11 и -12 и относятся к подгруппе инициаторных каспаз. Каспаза-1 необходима для обеспечения правильной регуляции воспалительной сигнализации и активируется бесконтактно-индуцированной димеризацией после рекрутирования в воспаленные. Каспаза-1 в изобилии присутствует в моноцитарной клеточной линии и индуцирует созревание провоспалительных цитокинов интерлейкина (IL)-1β и IL-18 до активных секретируемых молекул. Другие воспалительные каспазы, каспаза-4 и -5 (и их мышиный гомолог каспаза-11) способствуют высвобождению IL-1β, индуцируя пироптоз. Caspase Bimolecular Fluorescence Complementation (BiFC) – это инструмент, используемый для измерения воспалительной близости, вызванной каспазой, в качестве показания активации каспазы. Продомен каспазы-1, -4 или -5, который содержит область, которая связывается с воспалением, сливается с нефлуоресцентными фрагментами желтого флуоресцентного белка Venus (Venus-N [VN] или Venus-C [VC]), которые связываются с реформой флуоресцентного комплекса Венеры, когда каспазы подвергаются индуцированной близости. Этот протокол описывает, как вводить эти репортеры в первичные человеческие моноцитарные макрофаги (MDM) с использованием нуклеофекции, обрабатывать клетки, чтобы индуцировать воспалительную активацию каспазы, и измерять активацию каспазы с помощью флуоресценции и конфокальной микроскопии. Преимущество такого подхода заключается в том, что его можно использовать для выявления компонентов, требований и локализации комплекса активации воспалительной каспазы в живых клетках. Тем не менее, необходимо учитывать тщательный контроль, чтобы избежать ущерба жизнеспособности и поведению клеток. Этот метод является мощным инструментом для анализа динамических взаимодействий каспазы на уровне воспалительных сигналов, а также для опроса воспалительных сигнальных каскадов в живых МДМ и моноцитах, полученных из образцов крови человека.
Introduction
Каспазы представляют собой семейство цистеиновых аспартатных протеаз, которые могут быть сгруппированы в инициирующие каспазы и каспазы палача. Каспазы палача включают каспазу-3, -6 и -7. Они естественным образом обнаруживаются в клетках в виде димеров и расщепляются инициаторами каспаз для выполнения апоптоза1. К каспазам-инициаторам относятся человеческие каспазы-1, -2, -4, -5, -8, -9, -10 и -12. Они обнаруживаются в виде неактивных зимогенов (прокаспасов), которые активируются бесконтактно-индуцированной димеризацией и стабилизируются автопротеолитическим расщеплением 2,3. Воспалительные каспазы являются подмножеством инициирующих каспаз2 и охватывают каспазу-1, -4, -5 и -12 у людей и каспазу-1, -11 и -12 у мыши 4,5. Вместо апоптотической роли, они играют центральную роль в воспалении. Они опосредуют протеолитическую обработку и секрецию про-интерлейкина (IL)-1β и про-IL-18 6,7, которые являются первыми цитокинами, высвобождаемыми в ответ на патогенные захватчики 8,9. Caspase-1 активируется при наборе на его платформу активации; большой молекулярно-массовый белковый комплекс, называемый инфламмасомой (рисунок 1А)10. Димеризация каспазы-4, -5 и -11 происходит независимо от этих платформ через неканонический воспалительный путь11,12.
Канонические инфламмасомы представляют собой цитозольные многомерные белковые комплексы, которые состоят из белка датчика воспаления, адапторного белка ASC (апоптоз-ассоциированный спекоподобный белок, содержащий CARD) и эффекторного белка каспазы-110. Наиболее хорошо изученными каноническими инфламмасомами являются NOD-подобное семейство рецепторов, содержащее пириновый домен (NLRP), NLRP1 и NLRP3, семейство NLR, содержащее CARD (NLRC), NLRC4 и отсутствующее в меланоме 2 (AIM2). Каждый из них содержит пириновый домен, CARD или оба домена. Домен CARD опосредует взаимодействие между CARD-содержащими каспазами и их восходящими активаторами. Поэтому молекула каркаса ASC, которая состоит из N-концевого пиринового домена (PYD) и мотива C-концевой CARD 13,14, необходима для рекрутирования каспазы-1 в воспалительные модели NLRP110, NLRP315 и AIM216.
Каждая инфламмасома названа в честь своего уникального сенсорного белка, который распознает различные провоспалительные стимулы (рисунок 1B). Активаторы этого пути называются каноническими стимулами. Инфламмасомы служат датчиками микробных компонентов и тканевого стресса и собираются, чтобы вызвать сильную воспалительную реакцию путем активации воспалительных каспаз17. Сборка инфламмасом инициирует активацию каспазы-1 для опосредования созревания и секреции ее основных субстратов pro-IL-1β и pro-IL-18. Этот процесс происходит с помощью двухэтапного механизма. Во-первых, прайминговый стимул повышает экспрессию определенных белков инфламмасомы и про-IL-1β путем активации пути NF-κB. Во-вторых, внутриклеточный (канонический) стимул индуцирует сборку и набор прокаспазы-1 6,7.
Каспаза-4 и каспаза-5 являются человеческими ортологами мышиной каспазы-1111. Они активируются инфламмасомно-независимым образом внутриклеточным липополисахаридом (ЛПС), молекулой, обнаруженной во внешней мембране грамотрицательныхбактерий 18,19,20, и внеклеточным гемом, продуктом гемолиза эритроцитов21. Было высказано предположение, что ЛПС связывается непосредственно с мотивом CARD этих белков и индуцирует их олигомеризацию20. Активация каспазы-4 или каспазы-5 способствует высвобождению IL-1β путем индуцирования воспалительной формы гибели клеток, называемой пироптозом, путем расщепления порообразующего белка гасдермина D (GSDMD)18,19. Кроме того, отток ионов калия, образующийся в результате каспазы-4 и GSDMD-опосредованной пироптотической смерти, индуцирует активацию воспалительной системы NLRP3 и последующую активацию каспазы-122,23. Поэтому каспаза-4, -5 и -11 считаются внутриклеточными датчиками для ЛПС, которые способны индуцировать пироптоз и активацию каспазы-1 в ответ на специфические стимулы11,24.
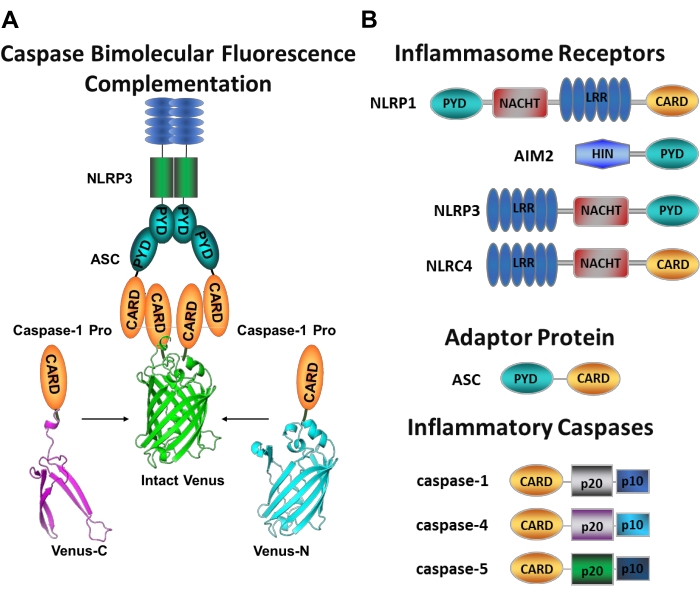
Рисунок 1: Анализ воспалительных каспаз и каспазо-бимолекулярной флуоресцентной комплементации (BiFC). (A) Диаграмма, показывающая систему каспазы-BiFC, где два продомена каспазы-1 (C1-pro), связанные с каждым нефлуоресцентным фрагментом Венеры (Venus-C или Venus-N), набираются на платформу активации NLRP3, заставляя Венеру пересворачиваться и флуоресцентировать. Этот комплекс появляется в виде зеленого пятна под микроскопом и служит считыванием для воспалительной близости, вызванной каспазой, что является первым шагом в активации инициатора каспазы. (B) Схема, показывающая доменную организацию компонентов воспаления и воспалительных каспаз. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Измерение активации конкретных инициирующих каспаз затруднено, и существует не так много методов, доступных для этого с помощью подходов к визуализации. Caspase Bimolecular Fluorescence Complementation (BiFC) может быть использована для визуализации воспалительной активации каспазы непосредственно в живых клетках (Рисунок 1A)25. Этот метод был недавно адаптирован для использования в макрофагах человека, полученных из моноцитов (MDM)21. Caspase BiFC измеряет первый шаг в воспалительной активации каспазы, индуцированной близостью для облегчения димеризации. Использована экспрессия плазмид, кодирующих CARD-содержащий каспазный продомен, слитый с нефлуоресцентными фрагментами фотостабильного желтого флуоресцентного белка Venus (Venus-C [VC]) и Venus-N [VN]). Когда два продомена каспазы набираются на их платформу активации или подвергаются индуцированной близости, две половины Венеры приближаются в непосредственной близости и вынуждены переворачиваться и флуоресцентировать (см. Рисунок 1A, B). Это обеспечивает считывание в режиме реального времени специфической активации воспалительной каспазы.
Человеческий МДМ обильно экспрессирует гены воспаления и рецепторы распознавания образов, которые идентифицируют сигналы опасности и патогенные продукты. Это обеспечивает идеальный тип клеток для опроса воспалительных путей каспазы. Кроме того, они могут быть получены из периферической крови и даже из образцов пациентов для оценки активации воспалительной каспазы в определенном болезненном состоянии. Этот протокол описывает, как вводить репортеры каспазы BiFC в MDM с использованием нуклеофекции, метода трансфекции на основе электропорации, как обрабатывать клетки для индуцирования активации воспалительной каспазы и как визуализировать активные комплексы каспазы с использованием подходов микроскопии. Кроме того, эта методология может быть адаптирована для определения молекулярного состава этих комплексов, субклеточной локализации, кинетики и размера этих высокоупорядоченных структур 25,26,27.
Protocol
Representative Results
Discussion
Этот протокол описывает рабочий процесс получения макрофагов из моноцитов, выделенных из образцов крови человека, и метод эффективного введения воспалительной каспазы Репортеров BiFC в МДМ человека без ущерба для жизнеспособности и поведения клеток.
Этот протокол испол?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим членов лаборатории LBH в прошлом и настоящем, которые внесли свой вклад в разработку этой техники. Эта лаборатория поддерживается NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH). Рисунок 2 был нарисован с помощью программного обеспечения Biorender.
Materials
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research. 1867 (6), 118688 (2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761 (2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97 (1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813 (2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316 (2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502 (2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What’s the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).

