Inaktivierung von Krankheitserregern durch Photolyse von Riboflavin-5′-Phosphat im sichtbaren Licht
Summary
Hier stellen wir ein Protokoll zur Inaktivierung pathogener Bakterien mit reaktiven Sauerstoffspezies vor, die während der Photolyse von Flavinmononukleotid (FMN) unter blauer und violetter Lichtbestrahlung niedriger Intensität entstehen. Die FMN-Photolyse hat sich als einfache und sichere Methode für hygienische Prozesse erwiesen.
Abstract
Riboflavin-5′-phosphat (oder Flavinmononukleotid; FMN) ist empfindlich gegenüber sichtbarem Licht. Verschiedene Verbindungen, einschließlich reaktiver Sauerstoffspezies (ROS), können durch FMN-Photolyse bei Bestrahlung mit sichtbarem Licht erzeugt werden. Die durch FMN-Photolyse erzeugten ROS sind schädlich für Mikroorganismen, einschließlich pathogener Bakterien wie Staphylococcus aureus (S. aureus). Dieser Artikel stellt ein Protokoll zur Deaktivierung von S. aureus als Beispiel durch photochemische Reaktionen vor, an denen FMN unter Bestrahlung mit sichtbarem Licht beteiligt ist. Das bei der FMN-Photolyse erzeugte Superoxid-Radikal-Anion () wird mittels Nitroblautetrazolium (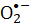 NBT)-Reduktion ausgewertet. Die mikrobielle Lebensfähigkeit von S. aureus, die reaktiven
NBT)-Reduktion ausgewertet. Die mikrobielle Lebensfähigkeit von S. aureus, die reaktiven 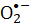 Spezies zugeschrieben wird, wurde verwendet, um die Wirksamkeit des Verfahrens zu bestimmen. Die bakterielle Inaktivierungsrate ist proportional zur FMN-Konzentration. Violettes Licht ist bei der Inaktivierung von S. aureus effizienter als die Bestrahlung mit blauem Licht, während das rote oder grüne Licht die FMN-Photolyse nicht antreibt. Der vorliegende Artikel demonstriert die FMN-Photolyse als einfache und sichere Methode für sanitäre Prozesse.
Spezies zugeschrieben wird, wurde verwendet, um die Wirksamkeit des Verfahrens zu bestimmen. Die bakterielle Inaktivierungsrate ist proportional zur FMN-Konzentration. Violettes Licht ist bei der Inaktivierung von S. aureus effizienter als die Bestrahlung mit blauem Licht, während das rote oder grüne Licht die FMN-Photolyse nicht antreibt. Der vorliegende Artikel demonstriert die FMN-Photolyse als einfache und sichere Methode für sanitäre Prozesse.
Introduction
Riboflavin-5′-phosphat (FMN) entsteht durch Phosphorylierung an der Riboflavin-5′-Position der Ribitylseitenkette und wird von allen Flavoproteinen für zahlreiche zelluläre Prozesse zur Energiegewinnung benötigt. Es spielt auch die Rolle des Vitamins für einige Funktionen im menschlichen Körper1. FMN ist etwa 200-mal wasserlöslicher als Riboflavin2.
Die antibakterielle photodynamische Inaktivierung (aPDI) von Bakterien ist ein wirksames Mittel zur Kontrolle der Resistenz gegen Bakterien3,4, da sie nicht von der Art der bakteriellen Resistenz abhängt. Klinisch wird aPDI zur Behandlung von Weichteilinfektionen eingesetzt, um die Infektion der nosokomialen Haut durch multiresistente Bakterienzu verringern 5,6,7,8,9. aPDI erzeugt auch den Zelltod, indem es reaktive Sauerstoffspezies (ROS) erzeugt. ROS, wie Superoxidradikale (), Singulett-Sauerstoff, Hydroxylradikale ( •OH) und Peroxyl-Radikale, sind freie Radikale oder Moleküle, die reaktiven Sauerstoff 10,11,12 enthalten und normalerweise reaktiv sind 13. Ähnlich wie DNA-Schäden, die durch ROS verursacht werden, sind auch die Membranperoxidation und die Zerstörung von Endothelzellen nachteilige biochemische Reaktionen, die auf ROS in Zellenzurückzuführen sind 12.
•OH) und Peroxyl-Radikale, sind freie Radikale oder Moleküle, die reaktiven Sauerstoff 10,11,12 enthalten und normalerweise reaktiv sind 13. Ähnlich wie DNA-Schäden, die durch ROS verursacht werden, sind auch die Membranperoxidation und die Zerstörung von Endothelzellen nachteilige biochemische Reaktionen, die auf ROS in Zellenzurückzuführen sind 12.
Die Verwendung von aPDI für pathogene Bakterien beinhaltet eine sichtbare oder UV-Lichtquelle zur Inaktivierung von Mikroorganismen in Gegenwart chemischer Verbindungen wie Methylthioniniumchlorid 14, PEI-c e6-Konjugat 15, Porphyrin16, Titandioxid 17, Toluidinblau O 18 und Zinkoxid-Nanopartikel 19. Toluidinblau O und Methylenblau sind Phenothiaziniumfarbstoffe und Methylenblau hat toxische Eigenschaften. Zinkoxid-Nanopartikel und UV-Strahlung sind mit negativen Auswirkungen auf Gesundheit und Umwelt verbunden. Daher verdient die Nutzung eines zuverlässigen, sicheren und einfachen Photosensibilisators durch Photolyse unter sichtbarer Bestrahlung weitere Untersuchungen.
Der Mikronährstoff, Riboflavin oder FMN, ist nicht toxisch und wird in der Tat für die Lebensmittelherstellung oder Fütterungverwendet 20. Sowohl FMN als auch Riboflavin sind sehr empfindlich gegenüber Lichteinstrahlung2. Unter UV 1,2,21,22,23 und Blaulichteinstrahlung 10,24 erreichen diese beiden Verbindungen einen angeregten Zustand. Das aktivierte Riboflavin oder FMN, das durch Photolyse erzeugt wird, wird in seinen Triplett-Zustand befördert und ROS werden gleichzeitigerzeugt 2,25. Kumar et al. berichteten, dass Riboflavin, das durch UV-Licht aktiviert wird, selektiv eine erhöhte Schädigung des Guanin-Anteils der DNA in pathogenen Mikroorganismen verursacht26. Unter Bestrahlung mit UV-Licht wird gezeigt, dass photodynamisch aktiviertes Riboflavin die Bildung von 8-OH-dG, einem Biomarker für oxidativen Stress, in doppelsträngiger DNAfördert 27. Es wird berichtet, dass S. aureus und E. coli während der Riboflavin- oder FMN-Photolyse durch ROS deaktiviert werden10,24,28. Eine frühere Studie der Autoren zeigte, dass die photolytischen Reaktionen mit Riboflavin und FMN Kristallviolett, einen Triarylmethanfarbstoff und ein antibakterielles Mittel, das Kristallviolett erzeugt und den größten Teil der antimikrobiellen Fähigkeit von Kristallviolett28 erzeugt , reduzieren und eliminieren. Wenn Flavin-Adenin-Dinukleotid oder FMN mit blauem Licht bestrahlt wird, erzeugen die resultierenden ROS Apoptose in HeLa-Zellen für ihre Vergiftung in vitro29. Unter Verwendung einer photochemischen Behandlung in Gegenwart von Riboflavin inaktivierten Cui et al. Lymphozyten durch Hemmung ihrer Proliferation und Zytokinproduktion30.
, reduzieren und eliminieren. Wenn Flavin-Adenin-Dinukleotid oder FMN mit blauem Licht bestrahlt wird, erzeugen die resultierenden ROS Apoptose in HeLa-Zellen für ihre Vergiftung in vitro29. Unter Verwendung einer photochemischen Behandlung in Gegenwart von Riboflavin inaktivierten Cui et al. Lymphozyten durch Hemmung ihrer Proliferation und Zytokinproduktion30.
Die Photolyse von Riboflavin wird zur Inaktivierung von Blutpathogenen durch UV 10,24 verwendet, jedoch können Blutbestandteile unter UV-Lichtbestrahlung beeinträchtigt werden30. Es wird auch berichtet, dass Thrombozyten, die UV-Strahlung ausgesetzt sind, die Leistung der Aktivierungsmarker P-Selektin und LIMP-CD63 auf ihren Membranen progressiv verbessern. Die Zytotoxizität von UV- und hochintensiver Bestrahlung muss untersucht werden, und ein Photosensibilisator, der während einer FMN-Photoreaktion mit sichtbarem Licht unkompliziert und sicher ist, wäre von großem Nutzen.
Licht kürzerer Wellenlängen hat mehr Energie und verursacht viel eher schwere Schäden an Zellen. In Gegenwart eines geeigneten Photosensibilisators kann die Bestrahlung mit violettem Licht geringer Intensität jedoch pathogene Mikroorganismen hemmen. Die Photosensibilisierung und die Erzeugung von FMN bei Bestrahlung mit violettem Licht ist daher wichtig zu untersuchen, um den Weg zu bestimmen, auf dem ROS aus der FMN-Photolyse die Inaktivierung von  Bakterien erhöht.
Bakterien erhöht.
Antimikrobielle Kontrolle ist ein häufiges Problem und die Entwicklung neuer Antibiotika dauert oft Jahrzehnte. Nach der Bestrahlung mit violettem Licht kann die Photoinaktivierung, die durch FMN vermittelt wird, umweltpathogene Bakterien vernichten. Diese Studie stellt ein wirksames antimikrobielles Protokoll in vitro vor, das violettes Licht verwendet, um die FMN-Photolyse zu steuern und somit für aPDI zu erzeugen  . Die mikrobielle Lebensfähigkeit von S. aureus wird verwendet, um die Machbarkeit von FMN-induziertem aPDI zu bestimmen.
. Die mikrobielle Lebensfähigkeit von S. aureus wird verwendet, um die Machbarkeit von FMN-induziertem aPDI zu bestimmen.
Protocol
Representative Results
Discussion
Ein Photosensibilisator erhöht die photochemische Reaktion chemischer Verbindungen, um ROS zu erzeugen. Pathogene Mikroorganismen können durch Lichtbestrahlung in Gegenwart von Photosensibilisatoren inaktiviert werden. Diese Studie bestimmt den aPDI von S. aureus aufgrund von ROS, das durch violette Lichtbestrahlung eines exogenen Photosensibilisators FMN erzeugt wird.
Wie in Abbildung 3 dargestellt, ist die Extinktion bei FMN bei 444 nm nach 5 Minuten …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Dr. Tak-Wah Wong und Herrn Zong-Jhe Hsieh für ihre Unterstützung bei den Experimenten.
Materials
| Blue, green and red LED lights | Vita LED Technologies Co., Tainan, Taiwan | DC 12 V 5050 | |
| Dimethyl Sulfoxide | Sigma-Aldrich, St. Louis, MO | 190186 | |
| Infrared thermometer | Raytek Co. Santa Cruz, CA | MT4 | |
| LB broth | Difco Co., NJ | ||
| L-Methionine | Sigma-Aldrich, St. Louis, MO | 1.05707 | |
| NBT | Bio Basic, Inc. Markham, Ontario, Canada | ||
| Power supply | China tech Co., New Taipei City, Taiwan | YP30-3-2 | |
| Riboflavin 5′-phosphate | Sigma-Aldrich, St. Louis, MO | R7774 | |
| RNase | New England BioLabs, Inc. Ipswich, MA | ||
| Solar power meter | Tenmars Electronics Co., Taipei, Taiwan | TM-207 | |
| Staphylococcus aureus subsp. aureus | Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 10451 | |
| UV-Vis optical spectrometer | Ocean Optics, Dunedin, FL | USB4000 | |
| UV-Vis spectrophotometer | Hitachi High-Tech Science Corporation,Tokyo, Japan | U-2900 | |
| Violet LED | Long-hui Electronic Co., LTD, Dongguan, China |
References
- Jian, H. L., Cheng, C. W., Chen, L. Y., Liang, J. Y. The photochemistry of riboflavin. MC-Transaction on Biotechnology. 3, 1-11 (2011).
- Lin, Y., Eitenmiller, R. R., Landen, W. O. Riboflavin. Vitamin analysis for the health and food sciences. , 329-360 (2008).
- Xie, L. J., Wang, R. L., Wang, D., Liu, L., Cheng, L. Visible-light-mediated oxidative demethylation of N(6)-methyl adenines. Chemical Communications. 53 (77), 10734-10737 (2017).
- Tim, M. Strategies to optimize photosensitizers for photodynamic inactivation of bacteria. Journal of Photochemistry and Photobiology B: Biology. 150, 2-10 (2015).
- Maisch, T., et al. Photodynamic inactivation of multi-resistant bacteria (PIB) – a new approach to treat superficial infections in the 21st century. Journal of the German Society of Dermatology. 9 (5), 360-366 (2011).
- Hamblin, M. R. Antimicrobial photodynamic inactivation: a bright new technique to kill resistant microbes. Current Opinion in Microbiology. 33, 67-73 (2016).
- Del Rosso, J. Q. Oral Doxycycline in the management of acne vulgaris: Current perspectives on clinical use and recent findings with a new double-scored small tablet formulation. The Journal of Clinical and Aesthetic Dermatology. 8 (5), 19-26 (2015).
- Wong, T. W., et al. Photodynamic inactivation of methicillin-resistant Staphylococcus aureus by indocyanine green and near infrared light. Dematologica Sinica. 36 (1), 8-15 (2018).
- Yuann, J. M. P., et al. Effects of free radicals from doxycycline hyclate and minocycline hydrochloride under blue light irradiation on the deactivation of Staphylococcus aureus, including a methicillin-resistant strain. Journal of Photochemistry and Photobiology B: Biology. 226, 112370 (2022).
- Liang, J. Y., Cheng, C. W., Yu, C. H., Chen, L. Y. Investigations of blue light-induced reactive oxygen species from flavin mononucleotide on inactivation of E. coli. Journal of Photochemistry and Photobiology B: Biology. 143, 82-88 (2015).
- Yang, M. J., et al. Effects of blue-light-induced free radical formation from catechin hydrate on the inactivation of Acinetobacter baumannii, Including a carbapenem-resistant strain. Molecules. 23 (7), 1631 (2018).
- Yuann, J. M. P., et al. A study of catechin photostability using photolytic processing. Processes. 9 (2), 293 (2021).
- Yuann, J. M. P., Wang, J. S., Jian, H. L., Lin, C. C., Liang, J. Y. Effects of Clinacanthus nutans (Burm. f) Lindau leaf extracts on protection of plasmid DNA from riboflavin photoreaction. MC-Transaction on Biotechnology. 4 (1), 45-59 (2012).
- Rineh, A., et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorganic and Medicinal Chemistry Letters. 28 (16), 2736-2740 (2018).
- Dai, T., et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrobial Agents and Chemotherapy. 53 (9), 3929-3934 (2009).
- Nitzan, Y., Ashkenazi, H. Photoinactivation of Acinetobacter baumannii and Escherichia coli B by a cationic hydrophilic porphyrin at various light wavelengths. Current Microbiology. 42 (6), 408-414 (2001).
- Tseng, C. C., et al. Altered susceptibility to the bactericidal effect of photocatalytic oxidation by TiO2 is related to colistin resistance development in Acinetobacter baumannii. Applied Microbiology and Biotechnology. 100 (19), 8549-8561 (2016).
- Boluki, E., et al. Antimicrobial activity of photodynamic therapy in combination with colistin against a pan-drug resistant Acinetobacter baumannii isolated from burn patient. Photodiagnosis and Photodynamic Therapy. 18, 1-5 (2017).
- Yang, M. Y., et al. Blue light irradiation triggers the antimicrobial potential of ZnO nanoparticles on drug-resistant Acinetobacter baumannii. Journal of Photochemistry and Photobiology B, Biology. 180, 235-242 (2018).
- . Code of Federal Regulations Available from: https://www.gpo.gov/fdsys/pkg/CFR-2009-title21-vol6/pdf/CFR-2009-title21-vol6-sec582-5695.pdf (2022)
- Lu, C. Y., et al. Generation and photosensitization properties of the oxidized radical of riboflavin: a laser flash photolysis study. Journal of Photochemistry and Photobiology B, Biology. 52 (1-3), 111-116 (1999).
- Sato, K., et al. The primary cytotoxicity in ultraviolet-a-irradiated riboflavin solution is derived from hydrogen peroxide. The Journal of Investigative Dermatology. 105 (4), 608-612 (1995).
- Tripathi, A. K., et al. Attenuated neuroprotective effect of riboflavin under UV-B irradiation via miR-203/c-Jun signaling pathway in vivo and in vitro. Journal of Biomedical Science. 21 (1), 39 (2014).
- Liang, J. Y., et al. Blue light induced free radicals from riboflavin on E. coli DNA damage. Journal of Photochemistry and Photobiology B, Biology. 119, 60-64 (2013).
- Ottaway, P. B. . The Technology of Vitamins in Food. , 233-244 (1993).
- Kumar, V., et al. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochemistry and Photobiology. 80 (1), 15-21 (2004).
- Ito, K., Inoue, S., Yamamoto, K., Kawanishi, S. 8-Hydroxydeoxyguanosine formation at the 5’site of 5′-GG-3’sequences in double-stranded DNA by UV radiation with riboflavin. Journal of Biological Chemistry. 268 (18), 13221-13227 (1993).
- Liang, J. Y., Yuann, J. M. P., Hsie, Z. J., Huang, S. T., Chen, C. C. Blue light induced free radicals from riboflavin in degradation of crystal violet by microbial viability evaluation. Journal of Photochemistry and Photobiology B, Biology. 174, 355-363 (2017).
- Yang, M. Y., Chang, C. J., Chen, L. Y. Blue light induced reactive oxygen species from flavin mononucleotide and flavin adenine dinucleotide on lethality of HeLa cells. Journal of Photochemistry and Photobiology B, Biology. 173, 325-332 (2017).
- Cui, Z., Huang, Y., Mo, Q., Wang, X., Qian, K. Inactivation of lymphocytes in blood products using riboflavin photochemical treatment with visible light. Photochemistry and Photobiology. 84 (5), 1195-1200 (2008).
- Wong, T. W., Cheng, C. W., Hsieh, Z. J., Liang, J. Y. Effects of blue or violet light on the inactivation of Staphylococcus aureus by riboflavin-5′-phosphate photolysis. Journal of Photochemistry and Photobiology B: Biology. 173, 672-680 (2017).
- Russell, L. F., Vanderslice, J. T. Comprehensive review of vitamin B2 analytical methodology. Journal of Micronutrient Analysis. 8, 257-310 (1990).
- Cheng, C. W., Chen, L. Y., Chou, C. W., Liang, J. Y. Investigations of riboflavin photolysis via coloured light in the nitro blue tetrazolium assay for superoxide dismutase activity. Journal of Photochemistry and Photobiology B: Biology. 148, 262-267 (2015).
- Huang, S. T., et al. Effects of 462 nm light-emitting diode on the inactivation of Escherichia coli and a multidrug-resistant by tetracycline photoreaction. Journal of Clinical Medicine. 7 (9), 278 (2018).
- Barua, M. G., Escalada, J. P., Bregliani, M., Pajares, A., Criado, S. Antioxidant capacity of (+)-catechin visible-light photoirradiated in the presence of vitamin B2. Redox Report: Communications in Free Radical Research. 22 (6), 282-289 (2017).
- Castillo, C., Criado, S., Díaz, M., García, N. A. Riboflavin as a sensitiser in the photodegradation of tetracyclines. Kinetics, mechanism and microbiological implications. Dyes and Pigments. 72 (2), 178-184 (2007).
- Huvaere, K., Sinnaeve, B., Van Bocxlaer, J., Skibsted, L. H. Flavonoid deactivation of excited state flavins: reaction monitoring by mass spectrometry. Journal of Agricultural and Food Chemistry. 60 (36), 9261-9272 (2012).
- Massad, W. A., Bertolotti, S., Garcia, N. A. Kinetics and mechanism of the vitamin B2-sensitized photooxidation of isoproterenol. Photochemistry and Photobiology. 79 (5), 428-433 (2004).
- Maclean, M., MacGregor, S. J., Anderson, J. G., Woolsey, G. High-intensity narrow-spectrum light inactivation and wavelength sensitivity of Staphylococcus aureus. FEMS Microbiology Letters. 285 (2), 227-232 (2008).
- Huang, S. T., et al. The influence of the degradation of tetracycline by free radicals from riboflavin-5′-phosphate photolysis on microbial viability. Microorganisms. 7 (11), 500 (2019).
- Maisch, T., et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives. PLoS One. 9 (12), 111792 (2014).
- Grijzenhout, M., et al. Ultraviolet-B irradiation of platelets induces a dose-dependent increase in the expression of platelet activation markers with storage. British Journal of Haematology. 83 (4), 627-632 (1993).

