리보플라빈-5'-인산염의 가시광선 광분해를 통한 병원체 불활성화
Summary
여기에서는 낮은 강도의 청색 및 보라색 광 조사 하에서 플라 빈 모노 뉴클레오티드 (FMN)의 광분해 중에 생성 된 활성 산소 종으로 병원성 박테리아를 비활성화하는 프로토콜을 제시합니다. FMN 광분해는 위생 공정을위한 간단하고 안전한 방법으로 입증되었습니다.
Abstract
리보플라빈-5′-포스페이트(또는 플라빈 모노뉴클레오티드; FMN)은 가시광선에 민감하다. 활성 산소 종 (ROS)을 포함한 다양한 화합물은 가시 광선 조사시 FMN 광분해로부터 생성 될 수있다. FMN 광분해에서 생성 된 ROS는 황색 포도상 구균 (S. aureus)과 같은 병원성 박테리아를 포함한 미생물에 유해합니다. 이 기사에서는 가시 광선 조사 하에서 FMN과 관련된 광화학 반응을 통해 S. aureus를 비활성화하는 프로토콜을 제시합니다. FMN 광분해 동안 생성 된 슈퍼 옥사이드 라디칼 음이온 ()은 니트로 블루 테트라 졸륨 (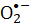 NBT) 환원을 통해 평가됩니다. 반응성
NBT) 환원을 통해 평가됩니다. 반응성 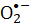 종에 기인하는 S. aureus의 미생물 생존력은 공정의 효과를 결정하는 데 사용되었습니다. 박테리아 불활성화 비율은 FMN 농도에 비례합니다. 보라색 빛은 청색광 조사보다 S. 아우레우스를 비활성화하는 데 더 효율적입니다., 적색 또는 녹색 빛은 FMN 광분해를 유도하지 않습니다. 본 기사는 위생 공정을위한 간단하고 안전한 방법으로 FMN 광분해를 보여줍니다.
종에 기인하는 S. aureus의 미생물 생존력은 공정의 효과를 결정하는 데 사용되었습니다. 박테리아 불활성화 비율은 FMN 농도에 비례합니다. 보라색 빛은 청색광 조사보다 S. 아우레우스를 비활성화하는 데 더 효율적입니다., 적색 또는 녹색 빛은 FMN 광분해를 유도하지 않습니다. 본 기사는 위생 공정을위한 간단하고 안전한 방법으로 FMN 광분해를 보여줍니다.
Introduction
리보플라빈 -5′- 인산염 (FMN)은 리비틸 측쇄의 리보플라빈 5′- 위치에서 인산화에 의해 형성되며 에너지를 생성하는 수많은 세포 과정을 위해 모든 플라 보 단백질에 필요합니다. 또한 인체의 일부 기능을위한 비타민의 역할을합니다1. FMN은 리보플라빈2보다 물에 약 200 배 더 잘 녹습니다.
박테리아의 항균 광역학 불활성화(aPDI)는 박테리아 내성 모드에 의존하지 않기 때문에 박테리아 3,4에 대한 내성을 제어하는 효율적인 방법입니다. 임상 적으로 aPDI는 다중 내성 박테리아 5,6,7,8,9로 인한 병원 내 피부 감염을 줄이기 위해 연조직 감염을 치료하는 데 사용됩니다. aPDI는 또한 활성 산소 종 (ROS)을 생성하여 세포 사멸을 생성합니다. 수퍼옥사이드 라디칼 (), 일중항 산소, 하이드록실 라디칼 (•OH) 및 퍼옥실 라디칼과 같은 ROS는 활성 산소(10,11,12)를 포함하고 정상적으로 반응성( 13)인 자유 라디칼 또는 분자이다. ROS에 의해 유발되는 DNA 손상과 유사하게, 막 과산화 및 내피 세포의 파괴는 또한 세포(12)에서 ROS에 기인하는 불리한 생화학적 반응이다.
13)인 자유 라디칼 또는 분자이다. ROS에 의해 유발되는 DNA 손상과 유사하게, 막 과산화 및 내피 세포의 파괴는 또한 세포(12)에서 ROS에 기인하는 불리한 생화학적 반응이다.
병원성 박테리아에 대한 aPDI의 사용은 메틸티오니늄클로라이드 14, PEI-c e6 접합체 15, 포르피린16, 이산화 티탄 17, 톨루이딘 블루O18 및 산화 아연 나노 입자 19와 같은 화합물의 존재 하에서 미생물을 불활성화시키는 가시 광선 또는 UV 광원을 포함한다. 톨루이딘 블루 O와 메틸렌 블루는 페 노티 아진 늄 염료이며 메틸렌 블루는 독성이 있습니다. 산화 아연 나노 입자와 UV 조사는 건강 및 환경 적 악영향과 관련이 있습니다. 따라서 가시적 인 조사 하에서 광분해를 통해 신뢰할 수 있고 안전하며 간단한 감광제를 사용하는 것은 추가 연구가 필요합니다.
미량 영양소 인 리보플라빈 또는 FMN은 독성이 없으며 실제로 식품 제조 또는 사료 공급에 사용됩니다20. FMN과 리보플라빈은 모두 빛 조사에 매우 민감합니다2. UV 1,2,21,22,23 및 청색광 조사10,24 하에서이 두 화합물은 여기 상태를 달성합니다. 광분해에 의해 생성 된 활성화 된 리보플라빈 또는 FMN은 삼중 항 상태로 승격되고 ROS는 동시에생성됩니다 2,25. Kumar 등은 자외선에 의해 활성화 된 리보플라빈이 병원성 미생물26에서 DNA의 구아닌 부분에 선택적으로 손상을 일으킨다고보고했다. 자외선에 의한 조사 하에서, 광역학적으로 활성화 된 리보플라빈은 이중 가닥 DNA27에서 산화 스트레스에 대한 바이오 마커 인 8-OH-dG의 생성을 촉진하는 것으로 입증된다. S. 아우 레 우스와 대장균은 리보플라빈 또는 FMN 광분해 동안 ROS에 의해 비활성화되는 것으로보고되었습니다 10,24,28. 저자의 이전 연구에 따르면 리보플라빈과 FMN을 포함하는 광분해 반응은 크리스탈 바이올렛, 트리 아릴 메탄 염료 및 생성하는 항균제 를 감소 시키고 크리스탈 바이올렛28의 항균 능력의 대부분을 제거합니다. 플라빈 아데닌 디뉴클레오티드 또는 FMN이 청색광에 의해 조사될 때, 생성된 ROS는 시험관내29에서 그들의 중독을 위해 HeLa 세포에서 세포자멸사를 생성한다. 리보플라빈의 존재하에 광화학 처리를 사용하여, Cui 등은 이들의 증식 및 사이토카인 생성을 억제함으로써 림프구를 불활성화시켰다30.
시키고 크리스탈 바이올렛28의 항균 능력의 대부분을 제거합니다. 플라빈 아데닌 디뉴클레오티드 또는 FMN이 청색광에 의해 조사될 때, 생성된 ROS는 시험관내29에서 그들의 중독을 위해 HeLa 세포에서 세포자멸사를 생성한다. 리보플라빈의 존재하에 광화학 처리를 사용하여, Cui 등은 이들의 증식 및 사이토카인 생성을 억제함으로써 림프구를 불활성화시켰다30.
리보플라빈의 광분해는 UV 10,24에 의한 혈액 병원체의 불활성화에 사용되지만, 자외선 조사(30) 하에서 혈액 성분이 손상 될 수있다. 또한 UV에 노출 된 혈소판은 세포막에서 활성화 마커 P- 셀렉틴 및 LIMP-CD63의 성능을 점진적으로 향상시키는 것으로보고되었습니다. UV 및 고강도 조사의 세포 독성을 조사해야하며 가시 광선을 포함하는 FMN 광반응 중에 복잡하지 않고 안전한 감광제가 유용 할 것입니다.
더 짧은 파장의 빛은 더 많은 에너지를 가지며 세포에 심각한 손상을 줄 가능성이 훨씬 더 큽니다. 그러나, 적합한 감광제의 존재 하에서, 저 강도 보라색 빛으로 조사하면 병원성 미생물을 억제 할 수있다. 따라서 보라색 빛을 조사할 때 FMN에  의한 감광성 및 생성은 FMN으로부터 ROS가 박테리아의 불활성화를 증가시키는 경로를 결정하기 위해 연구하는 것이 중요합니다.
의한 감광성 및 생성은 FMN으로부터 ROS가 박테리아의 불활성화를 증가시키는 경로를 결정하기 위해 연구하는 것이 중요합니다.
항균 제어는 일반적인 문제이며 새로운 항생제의 개발에는 수십 년이 걸리는 경우가 많습니다. 보라색 빛을 조사한 후 FMN에 의해 매개되는 광불활성화는 환경 병원성 박테리아를 전멸시킬 수 있습니다. 이 연구는 FMN 광분해를 유도하여 aPDI를 생성하기  위해 보라색 빛을 사용하는 효과적인 시험관 내 항균 프로토콜을 제시합니다. S. aureus의 미생물 생존력은 FMN 유도 aPDI의 타당성을 결정하는 데 사용됩니다.
위해 보라색 빛을 사용하는 효과적인 시험관 내 항균 프로토콜을 제시합니다. S. aureus의 미생물 생존력은 FMN 유도 aPDI의 타당성을 결정하는 데 사용됩니다.
Protocol
Representative Results
Discussion
감광제는 화합물의 광화학 반응을 증가시켜 ROS를 생성합니다. 병원성 미생물은 감광제의 존재하에 광 조사에 의해 불 활성화 될 수있다. 이 연구는 외인성 감광제 인 FMN의 보라색 광 조사에 의해 생성 된 ROS로 인한 S. aureus의 aPDI 를 결정합니다.
그림 3에서 볼 수 있듯이 FMN의 경우 보라색 또는 청색광을 사용하여 5 분 동안 조사하면 444nm에서의 흡광…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자는 실험을 지원해 준 Tak-Wah Wong 박사와 Zong-Jhe Hsieh 씨에게 감사드립니다.
Materials
| Blue, green and red LED lights | Vita LED Technologies Co., Tainan, Taiwan | DC 12 V 5050 | |
| Dimethyl Sulfoxide | Sigma-Aldrich, St. Louis, MO | 190186 | |
| Infrared thermometer | Raytek Co. Santa Cruz, CA | MT4 | |
| LB broth | Difco Co., NJ | ||
| L-Methionine | Sigma-Aldrich, St. Louis, MO | 1.05707 | |
| NBT | Bio Basic, Inc. Markham, Ontario, Canada | ||
| Power supply | China tech Co., New Taipei City, Taiwan | YP30-3-2 | |
| Riboflavin 5′-phosphate | Sigma-Aldrich, St. Louis, MO | R7774 | |
| RNase | New England BioLabs, Inc. Ipswich, MA | ||
| Solar power meter | Tenmars Electronics Co., Taipei, Taiwan | TM-207 | |
| Staphylococcus aureus subsp. aureus | Bioresource Collection and Research Center (BCRC), Hsinchu, Taiwan | 10451 | |
| UV-Vis optical spectrometer | Ocean Optics, Dunedin, FL | USB4000 | |
| UV-Vis spectrophotometer | Hitachi High-Tech Science Corporation,Tokyo, Japan | U-2900 | |
| Violet LED | Long-hui Electronic Co., LTD, Dongguan, China |
References
- Jian, H. L., Cheng, C. W., Chen, L. Y., Liang, J. Y. The photochemistry of riboflavin. MC-Transaction on Biotechnology. 3, 1-11 (2011).
- Lin, Y., Eitenmiller, R. R., Landen, W. O. Riboflavin. Vitamin analysis for the health and food sciences. , 329-360 (2008).
- Xie, L. J., Wang, R. L., Wang, D., Liu, L., Cheng, L. Visible-light-mediated oxidative demethylation of N(6)-methyl adenines. Chemical Communications. 53 (77), 10734-10737 (2017).
- Tim, M. Strategies to optimize photosensitizers for photodynamic inactivation of bacteria. Journal of Photochemistry and Photobiology B: Biology. 150, 2-10 (2015).
- Maisch, T., et al. Photodynamic inactivation of multi-resistant bacteria (PIB) – a new approach to treat superficial infections in the 21st century. Journal of the German Society of Dermatology. 9 (5), 360-366 (2011).
- Hamblin, M. R. Antimicrobial photodynamic inactivation: a bright new technique to kill resistant microbes. Current Opinion in Microbiology. 33, 67-73 (2016).
- Del Rosso, J. Q. Oral Doxycycline in the management of acne vulgaris: Current perspectives on clinical use and recent findings with a new double-scored small tablet formulation. The Journal of Clinical and Aesthetic Dermatology. 8 (5), 19-26 (2015).
- Wong, T. W., et al. Photodynamic inactivation of methicillin-resistant Staphylococcus aureus by indocyanine green and near infrared light. Dematologica Sinica. 36 (1), 8-15 (2018).
- Yuann, J. M. P., et al. Effects of free radicals from doxycycline hyclate and minocycline hydrochloride under blue light irradiation on the deactivation of Staphylococcus aureus, including a methicillin-resistant strain. Journal of Photochemistry and Photobiology B: Biology. 226, 112370 (2022).
- Liang, J. Y., Cheng, C. W., Yu, C. H., Chen, L. Y. Investigations of blue light-induced reactive oxygen species from flavin mononucleotide on inactivation of E. coli. Journal of Photochemistry and Photobiology B: Biology. 143, 82-88 (2015).
- Yang, M. J., et al. Effects of blue-light-induced free radical formation from catechin hydrate on the inactivation of Acinetobacter baumannii, Including a carbapenem-resistant strain. Molecules. 23 (7), 1631 (2018).
- Yuann, J. M. P., et al. A study of catechin photostability using photolytic processing. Processes. 9 (2), 293 (2021).
- Yuann, J. M. P., Wang, J. S., Jian, H. L., Lin, C. C., Liang, J. Y. Effects of Clinacanthus nutans (Burm. f) Lindau leaf extracts on protection of plasmid DNA from riboflavin photoreaction. MC-Transaction on Biotechnology. 4 (1), 45-59 (2012).
- Rineh, A., et al. Attaching NorA efflux pump inhibitors to methylene blue enhances antimicrobial photodynamic inactivation of Escherichia coli and Acinetobacter baumannii in vitro and in vivo. Bioorganic and Medicinal Chemistry Letters. 28 (16), 2736-2740 (2018).
- Dai, T., et al. Photodynamic therapy for Acinetobacter baumannii burn infections in mice. Antimicrobial Agents and Chemotherapy. 53 (9), 3929-3934 (2009).
- Nitzan, Y., Ashkenazi, H. Photoinactivation of Acinetobacter baumannii and Escherichia coli B by a cationic hydrophilic porphyrin at various light wavelengths. Current Microbiology. 42 (6), 408-414 (2001).
- Tseng, C. C., et al. Altered susceptibility to the bactericidal effect of photocatalytic oxidation by TiO2 is related to colistin resistance development in Acinetobacter baumannii. Applied Microbiology and Biotechnology. 100 (19), 8549-8561 (2016).
- Boluki, E., et al. Antimicrobial activity of photodynamic therapy in combination with colistin against a pan-drug resistant Acinetobacter baumannii isolated from burn patient. Photodiagnosis and Photodynamic Therapy. 18, 1-5 (2017).
- Yang, M. Y., et al. Blue light irradiation triggers the antimicrobial potential of ZnO nanoparticles on drug-resistant Acinetobacter baumannii. Journal of Photochemistry and Photobiology B, Biology. 180, 235-242 (2018).
- . Code of Federal Regulations Available from: https://www.gpo.gov/fdsys/pkg/CFR-2009-title21-vol6/pdf/CFR-2009-title21-vol6-sec582-5695.pdf (2022)
- Lu, C. Y., et al. Generation and photosensitization properties of the oxidized radical of riboflavin: a laser flash photolysis study. Journal of Photochemistry and Photobiology B, Biology. 52 (1-3), 111-116 (1999).
- Sato, K., et al. The primary cytotoxicity in ultraviolet-a-irradiated riboflavin solution is derived from hydrogen peroxide. The Journal of Investigative Dermatology. 105 (4), 608-612 (1995).
- Tripathi, A. K., et al. Attenuated neuroprotective effect of riboflavin under UV-B irradiation via miR-203/c-Jun signaling pathway in vivo and in vitro. Journal of Biomedical Science. 21 (1), 39 (2014).
- Liang, J. Y., et al. Blue light induced free radicals from riboflavin on E. coli DNA damage. Journal of Photochemistry and Photobiology B, Biology. 119, 60-64 (2013).
- Ottaway, P. B. . The Technology of Vitamins in Food. , 233-244 (1993).
- Kumar, V., et al. Riboflavin and UV-light based pathogen reduction: extent and consequence of DNA damage at the molecular level. Photochemistry and Photobiology. 80 (1), 15-21 (2004).
- Ito, K., Inoue, S., Yamamoto, K., Kawanishi, S. 8-Hydroxydeoxyguanosine formation at the 5’site of 5′-GG-3’sequences in double-stranded DNA by UV radiation with riboflavin. Journal of Biological Chemistry. 268 (18), 13221-13227 (1993).
- Liang, J. Y., Yuann, J. M. P., Hsie, Z. J., Huang, S. T., Chen, C. C. Blue light induced free radicals from riboflavin in degradation of crystal violet by microbial viability evaluation. Journal of Photochemistry and Photobiology B, Biology. 174, 355-363 (2017).
- Yang, M. Y., Chang, C. J., Chen, L. Y. Blue light induced reactive oxygen species from flavin mononucleotide and flavin adenine dinucleotide on lethality of HeLa cells. Journal of Photochemistry and Photobiology B, Biology. 173, 325-332 (2017).
- Cui, Z., Huang, Y., Mo, Q., Wang, X., Qian, K. Inactivation of lymphocytes in blood products using riboflavin photochemical treatment with visible light. Photochemistry and Photobiology. 84 (5), 1195-1200 (2008).
- Wong, T. W., Cheng, C. W., Hsieh, Z. J., Liang, J. Y. Effects of blue or violet light on the inactivation of Staphylococcus aureus by riboflavin-5′-phosphate photolysis. Journal of Photochemistry and Photobiology B: Biology. 173, 672-680 (2017).
- Russell, L. F., Vanderslice, J. T. Comprehensive review of vitamin B2 analytical methodology. Journal of Micronutrient Analysis. 8, 257-310 (1990).
- Cheng, C. W., Chen, L. Y., Chou, C. W., Liang, J. Y. Investigations of riboflavin photolysis via coloured light in the nitro blue tetrazolium assay for superoxide dismutase activity. Journal of Photochemistry and Photobiology B: Biology. 148, 262-267 (2015).
- Huang, S. T., et al. Effects of 462 nm light-emitting diode on the inactivation of Escherichia coli and a multidrug-resistant by tetracycline photoreaction. Journal of Clinical Medicine. 7 (9), 278 (2018).
- Barua, M. G., Escalada, J. P., Bregliani, M., Pajares, A., Criado, S. Antioxidant capacity of (+)-catechin visible-light photoirradiated in the presence of vitamin B2. Redox Report: Communications in Free Radical Research. 22 (6), 282-289 (2017).
- Castillo, C., Criado, S., Díaz, M., García, N. A. Riboflavin as a sensitiser in the photodegradation of tetracyclines. Kinetics, mechanism and microbiological implications. Dyes and Pigments. 72 (2), 178-184 (2007).
- Huvaere, K., Sinnaeve, B., Van Bocxlaer, J., Skibsted, L. H. Flavonoid deactivation of excited state flavins: reaction monitoring by mass spectrometry. Journal of Agricultural and Food Chemistry. 60 (36), 9261-9272 (2012).
- Massad, W. A., Bertolotti, S., Garcia, N. A. Kinetics and mechanism of the vitamin B2-sensitized photooxidation of isoproterenol. Photochemistry and Photobiology. 79 (5), 428-433 (2004).
- Maclean, M., MacGregor, S. J., Anderson, J. G., Woolsey, G. High-intensity narrow-spectrum light inactivation and wavelength sensitivity of Staphylococcus aureus. FEMS Microbiology Letters. 285 (2), 227-232 (2008).
- Huang, S. T., et al. The influence of the degradation of tetracycline by free radicals from riboflavin-5′-phosphate photolysis on microbial viability. Microorganisms. 7 (11), 500 (2019).
- Maisch, T., et al. Fast and effective photodynamic inactivation of multiresistant bacteria by cationic riboflavin derivatives. PLoS One. 9 (12), 111792 (2014).
- Grijzenhout, M., et al. Ultraviolet-B irradiation of platelets induces a dose-dependent increase in the expression of platelet activation markers with storage. British Journal of Haematology. 83 (4), 627-632 (1993).

