استراتيجية إثراء ذات طرف دوار للتحليل المتزامن ل N-glycopeptides و Phosphopeptides من أنسجة البنكرياس البشرية
Summary
التعديلات اللاحقة للترجمة (PTMs) تغير هياكل البروتين ووظائفه. يمكن لطرق الإثراء المتزامن لأنواع PTM متعددة أن تزيد من التغطية في التحليلات. نقدم بروتوكولا باستخدام كروماتوغرافيا تقارب المعادن المزدوجة الوظيفية Ti(IV) المجمدة متبوعة بقياس الطيف الكتلي للإثراء والتحليل المتزامن للبروتين N-glycosylation والفسفرة في أنسجة البنكرياس.
Abstract
يمكن أن يوفر قياس الطيف الكتلي تغطية عميقة للتعديلات اللاحقة للترجمة (PTMs) ، على الرغم من أن إثراء هذه التعديلات من المصفوفات البيولوجية المعقدة غالبا ما يكون ضروريا بسبب انخفاض قياس stoichiometry مقارنة بالتحليلات غير المعدلة. معظم سير عمل إثراء PTMs على الببتيدات في سير عمل البروتينات من أسفل إلى أعلى ، حيث يتم هضم البروتينات إنزيميا قبل تحليل الببتيدات الناتجة ، يثري نوعا واحدا فقط من التعديل. ومع ذلك ، فإن المكمل الكامل ل PTMs هو الذي يؤدي إلى وظائف بيولوجية ، وقد يؤدي إثراء نوع واحد من PTM إلى مثل هذا الحديث المتبادل ل PTMs. وقد لوحظ PTM crosstalk بين غليكوزيل البروتين والفسفرة ، وهما PTMs الأكثر شيوعا في البروتينات البشرية وأيضا PTMs الأكثر دراسة باستخدام سير عمل قياس الطيف الكتلي. باستخدام استراتيجية التخصيب المتزامنة الموصوفة هنا ، يتم إثراء كل من PTMs من أنسجة البنكرياس البشرية بعد الوفاة ، وهي مصفوفة بيولوجية معقدة. يتم استخدام كروماتوغرافيا التقارب المعدني المزدوج الوظيفية Ti(IV) المجمدة لفصل أشكال مختلفة من الجليكوزيل والفسفرة في وقت واحد في كسور متعددة بطريقة مريحة تعتمد على طرف الدوران ، مما يسمح بإجراء تحليلات نهائية لتفاعلات PTM المتقاطعة المحتملة. يمكن تطبيق سير عمل التخصيب هذا للجليكو والفوسفوببتيدات على أنواع مختلفة من العينات لتحقيق التنميط العميق لأجهزة PTMs المتعددة وتحديد الجزيئات المستهدفة المحتملة للدراسات المستقبلية.
Introduction
تلعب تعديلات البروتين بعد الترجمة (PTMs) دورا رئيسيا في تعديل هياكل البروتين وبالتالي وظائفها وعملياتها البيولوجية النهائية. يزداد تنوع البروتيوم البشري بشكل كبير بسبب التباين التوافقي الذي توفره PTMs المختلفة. أصبحت دراسة التنوع البروتيني في الصحة والمرض مجالا للبحث ذا أهمية كبيرة في السنوات الأخيرة 2,3.
أصبحت دراسة النماذج البروتينية وبشكل أكثر تحديدا PTMs ذات العمق الكبير أكثر سهولة من خلال تطوير طرق البروتينات القائمة على قياس الطيف الكتلي (MS). باستخدام MS ، يتم تأين التحليلات وتجزئتها وتحديدها بناء على m / z من الشظايا. غالبا ما تكون طرق التخصيب ضرورية بسبب انخفاض الوفرة النسبية ل PTMs مقارنة بأشكال البروتينات غير المعدلة. على الرغم من أن تحليل البروتينات السليمة و PTMs الخاصة بها ، والتي تسمى التحليلات من أعلى إلى أسفل ، أصبحت أكثر روتينية ، إلا أن الهضم الأنزيمي للبروتينات وتحليل الببتيدات المكونة لها في التحليلات من أسفل إلى أعلى لا يزال هو الطريق الأكثر استخداما على نطاق واسع لتحليل PTM. الاثنان الأكثر دراسة على نطاق واسع PTMs ، واثنين من PTMs الأكثر شيوعا في الجسم الحي ، هما glycosylation و phosphorylation4. يلعب هذان الجهازان أدوارا رئيسية في إشارات الخلايا والتعرف عليها ، وبالتالي فهي تعديلات مهمة للتوصيف في أبحاث الأمراض.
غالبا ما توفر الخواص الكيميائية لمختلف PTMs طرقا نحو إثراء هذه PTMs على مستويات البروتين والببتيد قبل التحليل. Glycosylation هو PTM محب للماء بسبب وفرة مجموعات الهيدروكسيل على كل السكريات الأحادية. يمكن استخدام هذه الخاصية لإثراء الجليكوببتيدات في كروماتوغرافيا التفاعل المحب للماء (HILIC) ، والتي يمكن أن تفصل المزيد من الببتيدات المحبة للماء عن الببتيدات غير المعدلة الكارهة للماء5. يضيف الفسفرة مويتي الفوسفات ، الذي يكون مشحونا سالبا إلا عند درجة الحموضة الحمضية. بسبب هذه الشحنة ، يمكن استخدام العديد من الكاتيونات المعدنية ، بما في ذلك التيتانيوم ، لجذب وربط الببتيدات الفوسفورية بينما يتم غسل الأنواع غير المفسفرة. هذا هو مبدأ كروماتوغرافيا تقارب المعادن المجمدة (IMAC). يمكن العثور على مزيد من المناقشات حول هذه الاستراتيجيات وغيرها من استراتيجيات التخصيب للغليكوزيل والفسفرة في المراجعات الأخيرة 6,7.
غالبا ما تكون هناك حاجة إلى كميات كبيرة نسبيا من مواد الببتيد الأولية (0.5 ملغ أو أكثر) لبروتوكولات التخصيب بسبب انخفاض قياس stoichiometry من PTMs على الببتيدات. في السيناريوهات التي قد لا يكون من السهل فيها الحصول على هذه الكمية من العينة، مثل خزعة الورم الأساسية أو تحليلات السائل الدماغي الشوكي، من المفيد استخدام سير العمل السهل الذي ينتج عنه أقصى قدر من المعلومات الجزيئية الحيوية. وقد أبرزت الاستراتيجيات الحديثة التي طورها مختبرنا وغيره التحليل المتزامن والمتوازي للغليكوزيل والفسفرة باستخدام نفس سير عمل إثراء PTM8،9،10،11،12. على الرغم من أن الخصائص الكيميائية لهذين ال PTMs قد تختلف ، إلا أنه يمكن تحليل هذه PTMs في خطوات متعددة بسبب تقنيات الفصل المبتكرة والمواد المستخدمة. على سبيل المثال، تتراكب كروماتوغرافيا التفاعل الكهروستاتيكي المحب للماء (ERLIC) على أساس التفاعلات المحبة للماء بين التحليلات والطور المتنقل مع تفاعلات الشحنة الشحنة بين التحليلات ومادة الطور الثابت13،14،15،16. في درجة الحموضة الحمضية ، يمكن أن يؤدي جذب الببتيدات المفسفرة إلى المرحلة الثابتة إلى تحسين الاحتفاظ بها وفصلها عن الببتيدات غير المعدلة. يمكن استخدام المواد التي تتكون من Ti (IV) المجمدة على المجهرية المحبة للماء للتخليق القائم على HILIC و IMAC لفصل الببتيدات الفوسفاتية والغليكوببتيدات المحايدة والحمضية و mannose-6-phosphorylated17,18. تعرف هذه الاستراتيجية باسم Ti(IV)-IMAC ثنائي الوظائف. يمكن أن يؤدي استخدام هذه الاستراتيجيات لإثراء PTMs متعددة في سير عمل واحد إلى جعل تحليلات تفاعلات PTM المحتملة أكثر سهولة. وبالإضافة إلى ذلك، فإن إجمالي كمية العينة ومتطلبات الوقت أقل من طرق التخصيب التقليدية عند تنفيذها بالتوازي (أي HILIC و IMAC على حصص عينة منفصلة).
لإثبات استراتيجية Ti(IV)-IMAC ثنائية الوظيفة للتحليل المتزامن للغليكوزيل البروتيني والفسفرة ، قمنا بتطبيقها لتحليل أنسجة البنكرياس البشرية بعد الوفاة. ينتج البنكرياس كلا من الإنزيمات الهضمية والهرمونات التنظيمية، بما في ذلك الأنسولين والجلوكاجون. تضعف وظيفة البنكرياس في مرض البنكرياس. في مرض السكري ، يتأثر تنظيم نسبة السكر في الدم ، مما يؤدي إلى ارتفاع مستويات الجلوكوز في الدم. في التهاب البنكرياس ، ينتج الالتهاب عن الهضم التلقائي للعضو3. قد تؤدي التغييرات في ملامح PTM ، بما في ذلك الغليكوزيل والفسفرة ، كما هو الحال في كثير من الأحيان ، إلى أمراض أخرى.
هنا ، نصف بروتوكولا لطريقة التخصيب المتزامن القائمة على طرف الدوران ، استنادا إلى استراتيجية Ti(IV)-IMAC ثنائية الوظيفة ، ل N-glycopeptides و phosphopeptides المشتقة من البروتينات المستخرجة من أنسجة البنكرياس. ويشمل البروتوكول استخراج البروتين وهضمه، والتخصيب، وجمع بيانات التصلب المتعدد، ومعالجة البيانات، كما يتضح من الشكل 1. تتوفر البيانات التمثيلية من هذه الدراسة عبر اتحاد ProteomeXchange مع المعرف PXD033065.
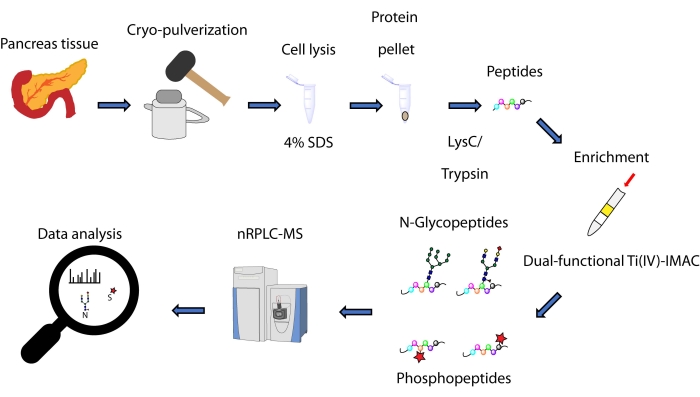
الشكل 1: سير العمل للتحليل المتزامن ل N-glycopeptides و phosphopeptides من أنسجة البنكرياس البشرية. يتم أولا سحق الأنسجة بالتبريد إلى مسحوق ناعم قبل استخراج البروتين باستخدام كبريتات دوديسيل الصوديوم المنظفة (SDS). ثم تخضع البروتينات للهضم الإنزيمي. يتم اقتباس الببتيدات الناتجة قبل التخصيب باستخدام Ti(IV)-IMAC ثنائي الوظائف. يتم جمع البيانات الخام باستخدام كروماتوغرافيا السائل ذات الطور العكسي النانوي – قياس الطيف الكتلي (nRPLC-MS) ويتم تحليلها باستخدام برنامج البحث في قواعد البيانات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يهدف هذا البروتوكول إلى جعل تحليلات PTM أكثر سهولة وتمكين تحليل أكثر انتشارا ل PTMs متعددة في نفس سير العمل. يمكن تطبيق هذا البروتوكول على المصفوفات البيولوجية المعقدة الأخرى ، بما في ذلك الخلايا والسوائل الحيوية.
Protocol
Representative Results
Discussion
وتعد استراتيجية Ti(IV)-IMAC ثنائية الوظيفة مفيدة للتحليل المتزامن للجليكوببتيدات N-glycopeptides والفوسفوببتيدات من نفس العينة في سير عمل إعداد عينة واحدة. كما ثبت أن الأساليب القائمة على ERLIC تؤدي التخصيب المتزامن ل PTMs. تم استخدام كلتا الاستراتيجيتين سابقا لتغطية عميقة في تحليلات PTM14,18<s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا البحث جزئيا من خلال تمويل منحة من المعاهد الوطنية للصحة (R01DK071801 و RF1AG052324 و P01CA250972 و R21AG065728) ومؤسسة أبحاث سكري الأحداث (1-PNF-2016-250-S-B و SRA-2016-168-S-B). كما تم الحصول على البيانات المقدمة هنا جزئيا من خلال دعم من جائزة NIH / NCATS UL1TR002373 من خلال معهد جامعة ويسكونسن للبحوث السريرية والانتقالية. تم شراء أدوات Orbitrap من خلال دعم منحة أدوات مشتركة من المعاهد الوطنية للصحة (NIH-NCRR S10RR029531) ومكتب نائب رئيس الجامعة للبحث والتعليم العالي في جامعة ويسكونسن ماديسون. ونود أيضا أن نشيد بالدعم السخي الذي قدمته منظمة التبرع بالأعضاء والأنسجة بجامعة ويسكونسن التي قدمت البنكرياس البشري للبحوث ومساعدة دان تريميل والدكتورة سارة دي ساكيت والبروفيسور جون أودوريكو لتوفير العينات لمختبرنا. يود فريق البحث لدينا تقديم شكر خاص للعائلات التي تبرعت بالأنسجة لهذه الدراسة. L.L. تعترف بمنحة المعاهد الوطنية للصحة S10OD025084 ، وهي منحة تجريبية لسرطان البنكرياس من مركز سرطان كاربون بجامعة ويسكونسن (233-AAI9632) ، بالإضافة إلى أستاذية Vilas للإنجاز المتميز وأستاذية كرسي تشارلز ملبورن جونسون المتميز بتمويل مقدم من مؤسسة أبحاث خريجي ويسكونسن وكلية الصيدلة بجامعة ويسكونسن ماديسون.
Materials
| Acetic Acid, Glacial (Certified ACS) | Fisher Scientific | A38S-500 | |
| Acetone (Certified ACS) | Fisher Scientific | A18-1 | |
| Acetonitrile, Optima LC/MS Grade | Fisher Scientific | A955-4 | |
| Ammonium Acetate (Crystalline/Certified ACS) | Fisher Scientific | A637-500 | |
| Ammonium Hydroxide (Certified ACS Plus) | Fisher Scientific | A669-212 | |
| Byonic software | Protein Metrics | n/a | Commercial software used for glycoproteomic analysis (https://proteinmetrics.com/byos/) |
| C18 BEH material | Waters | 186002353 | Material removed from column and used to pack nano capillaries (pulledto integrate tip used directly in line with instrument inlet) |
| CAE-Ti-IMAC, 100% | J&K Scientific | 2749380-1G | Material used for dual-functional Ti(IV)-IMAC; can also be used for conventional IMAC/conventional phosphopeptide enrichment |
| Cellcrusher kit | Cellcrusher | n/a | Used for grinding tissue samples into powder before extraction |
| Eppendorf 5424R Microcentrifuge | Fisher Scientific | 05-401-205 | For temperature-controlled centrifugation |
| cOmplete protease inhibitor cocktail tablets | Sigma | 11697498001 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | V3151 | Protein reducing agent |
| Ethanol, 200 proof (100%), USP | Fisher | 22-032-601 | |
| Fisherbrand Analog Vortex Mixer | Fisher Scientific | 02-215-414 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (1.5 mL) | Fisher Scientific | 02-681-320 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (2 mL) | Fisher Scientific | 02-681-321 | |
| Fisherbrand Model 120 Sonic Dismembrator | Fisher Scientific | FB120110 | For sample lysis using ultrasonication |
| Formic Acid, 99.0+%, Optima LC/MS Grade | Fisher Scientific | A117-50 | |
| Fused silica capillary (75 μm inner diameter, 360 μm outer diameter) | Polymicro Technologies LLC | 100 m TSP075375 | For in-house pulled and packed columns with integrated emitter |
| Hydrofluoric acid (48 wt. % in H2O) | Sigma-Aldrich | 339261-100ML | Used for opening emitter of pulled capillary column |
| Iodoacetamide, BioUltra | Sigma | I1149-5G | Protein reducing reagent |
| MaxQuant software | n/a | n/a | Free software used for phosphoproteomic analysis (https://www.maxquant.org/) |
| Multi-therm Shaker with heating and cooling | Benchmark Scientific | H5000-HC | Heating block |
| Oasis HLB 1 cc Vac Cartridge, 10 mg Sorbent per Cartridge, 30 µm, 100/pk | Waters | 186000383 | Larger-scale cartridge desalting for tryptic digests (loading capacity approximately up to 1 mg each) |
| OMIX C18 pipette tips, 100 µL tip, 10 – 100 μL elution volume, 1 x 96 tips | Agilent | A57003100 | Smaller-scale packed pipette tip for desalting for enrichment elutions |
| P-2000 Micropipette Puller | Sutter Instrument Co. | P-2000/F | For pulling nano-capillary columns for LC-MS |
| PhosSTOP phosphatase inhibitor tablets | Sigma | 4906845001 | |
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| PolySAX LP (12 μm, pore size 300 Å) | PolyLC | BMSX1203 | Material for strong anion-exchange chromatography used for ERLIC/conventional glycopeptide enrichment |
| Potassium Phosphate Monobasic (Crystalline/Certified ACS) | Fisher Scientific | P285-500 | |
| Pressure injection cell with integrated magnetic stirplate | Next Advance | PC77-MAG | For packing nano-capillary columns with stationary phase up to 2500 psi limit |
| Proteome Discoverer software | Thermo Fisher Scientific | n/a | Commercial software for proteomics anaysis (with integrated database searching software nodes) and data visualization (https://www.thermofisher.com/us/en/home/industrial/mass-spectrometry/liquid-chromatography-mass-spectrometry-lc-ms/lc-ms-software/multi-omics-data-analysis/proteome-discoverer-software.html) |
| SpeedVac SC110 Vacuum Concentrator Model SC110-120 | Savant | n/a | Centrifugal vacuum concentrator for drying samples (under heat) |
| SDS Solution, 10% Sodium Dodecyl Sulfate Solution, Molecular Biology/Electrophoresis | Fisher Scientific | BP2436200 | |
| Sequencing Grade Modified Trypsin | Promega | V5111 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| TopTip, Empty, 10-200 µL, Pack of 96 | Glygen Corporation | TT2EMT.96 | Empty pipette tip with micron-sized hole used that can be used to pack chromatographic materials for enrichments, bundled with tube adapters |
| Triethylammonium bicarbonate buffer (TEAB, 1 M, pH 8.5 (volatile)) | Sigma | 90360-100ML | |
| Trifluoroacetic acid, Reagent Grade, 99% | Fisher Scientific | 60-017-61 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-500 | |
| Trypsin/Lys-C Mix, Mass Spec Grade | Promega | V5071 | |
| Urea (Certified ACS) | Fisher Scientific | U15-500 | |
| Water, Optima LC/MS Grade | Fisher Scientific | W64 |
References
- Smith, L. M., Kelleher, N. L. Proteoform: a single term describing protein complexity. Nature Methods. 10 (3), 186-187 (2013).
- Pan, S., Brentnall, T. A., Chen, R. Glycoproteins and glycoproteomics in pancreatic cancer. World Journal of Gastroenterology. 22 (42), 9288-9299 (2016).
- Tabang, D. N., Ford, M., Li, L. Recent advances in mass spectrometry-based glycomic and glycoproteomic studies of pancreatic diseases. Frontiers in Chemistry. 9, 707387 (2021).
- Khoury, G. A., Baliban, R. C., Floudas, C. A. Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database. Scientific Reports. 1, 90 (2011).
- Alpert, A. J. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds. Journal of Chromatography A. 499, 177-196 (1990).
- Riley, N. M., Bertozzi, C. R., Pitteri, S. J. A pragmatic guide to enrichment strategies for mass spectrometry-based glycoproteomics. Molecular & Cellular Proteomics. 20, 100029 (2020).
- Low, T. Y., et al. Widening the bottleneck of phosphoproteomics: Evolving strategies for phosphopeptide enrichment. Mass Spectrometry Reviews. 40 (4), 309-333 (2021).
- Cho, K. C., Chen, L., Hu, Y., Schnaubelt, M., Zhang, H. Developing workflow for simultaneous analyses of phosphopeptides and glycopeptides. ACS Chemical Biology. 14 (1), 58-66 (2019).
- Zhou, Y., et al. An integrated workflow for global, glyco-, and phospho-proteomic analysis of tumor tissues. Analytical Chemistry. 92 (2), 1842-1849 (2020).
- Tang, R., et al. Facile preparation of bifunctional adsorbents for efficiently enriching N-glycopeptides and phosphopeptides. Analytica Chimica Acta. 1144, 111-120 (2021).
- Wang, Z., Wang, J., Sun, N., Deng, C. A promising nanoprobe based on hydrophilic interaction liquid chromatography and immobilized metal affinity chromatography for capture of glycopeptides and phosphopeptides. Analytica Chimica Acta. 1067, 1-10 (2019).
- Glover, M. S., et al. Characterization of intact sialylated glycopeptides and phosphorylated glycopeptides from IMAC enriched samples by EThcD fragmentation: Toward combining phosphoproteomics and glycoproteomics. International Journal of Mass Spectrometry. 427, 35-42 (2018).
- Alpert, A. J. Electrostatic repulsion hydrophilic interaction chromatography for isocratic separation of charged solutes and selective isolation of phosphopeptides. Analytical Chemistry. 80 (1), 62-76 (2008).
- Cui, Y., et al. Counterion optimization dramatically improves selectivity for phosphopeptides and glycopeptides in electrostatic repulsion-hydrophilic interaction chromatography. Analytical Chemistry. 93 (22), 7908-7916 (2021).
- Cui, Y., et al. Finding the sweet spot in ERLIC mobile phase for simultaneous enrichment of N-Glyco and phosphopeptides. Journal of the American Society for Mass Spectrometry. 30 (12), 2491-2501 (2019).
- Tabang, D. N., et al. Analysis of pancreatic extracellular matrix protein post-translational modifications via electrostatic repulsion-hydrophilic interaction chromatography coupled with mass spectrometry. Molecular Omics. 17 (5), 652-664 (2021).
- Huang, J., et al. Dual-functional Titanium(IV) immobilized metal affinity chromatography approach for enabling large-scale profiling of protein Mannose-6-Phosphate glycosylation and revealing its predominant substrates. Analytical Chemistry. 91 (18), 11589-11597 (2019).
- Huang, J., et al. Dual-functional Ti(IV)-IMAC material enables simultaneous enrichment and separation of diverse glycopeptides and phosphopeptides. Analytical Chemistry. 93 (24), 8568-8576 (2021).
- Jami-Alahmadi, Y., Pandey, V., Mayank, A. K., Wohlschlegel, J. A. A robust method for packing high resolution C18 RP-nano-HPLC columns. Journal of Visualized Experiments: JoVE. (171), e62380 (2021).
- Bern, M., Kil, Y. J., Becker, C. Byonic: advanced peptide and protein identification software. Current Protocols in Bioinformatics. , (2012).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).
- Zhou, Y., et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets. Nature Communications. 10 (1), 1523 (2019).
- Zacharias, L. G., et al. HILIC and ERLIC enrichment of glycopeptides derived from breast and brain cancer cells. Journal of Proteome Research. 15 (10), 3624-3634 (2016).
- Yang, W., et al. Comparison of enrichment methods for intact N- and O-linked glycopeptides using strong anion exchange and hydrophilic interaction liquid chromatography. Analytical Chemistry. 89 (21), 11193-11197 (2017).
- Toghi Eshghi, S., Shah, P., Yang, W., Li, X., Zhang, H. GPQuest: A spectral library matching algorithm for site-specific assignment of tandem mass spectra to intact N-glycopeptides. Analytical Chemistry. 87 (10), 5181-5188 (2015).
- Liu, M. -. Q., et al. pGlyco 2.0 enables precision N-glycoproteomics with comprehensive quality control and one-step mass spectrometry for intact glycopeptide identification. Nature Communications. 8 (1), 438 (2017).
- Lu, L., Riley, N. M., Shortreed, M. R., Bertozzi, C. R., Smith, L. M. O-Pair Search with MetaMorpheus for O-glycopeptide characterization. Nature Methods. 17 (11), 1133-1138 (2020).
- Caval, T., Heck, A. J. R., Reiding, K. R. Meta-heterogeneity: Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein. Molecular & Cellular Proteomics. 20, 100010 (2021).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Leutert, M., Entwisle, S. W., Villén, J. Decoding post-translational modification crosstalk with proteomics. Molecular & Cellular Proteomics. 20, 100129 (2021).
- Hart, G. W., Slawson, C., Ramirez-Correa, G., Lagerlof, O. Cross talk between O-GlcNAcylation and phosphorylation: Roles in signaling, transcription, and chronic disease. Annual Review of Biochemistry. 80 (1), 825-858 (2011).

