En spin-tip-anrikningsstrategi för samtidig analys av N-glykopeptider och fosfopeptider från humana bukspottkörtelvävnader
Summary
Post-translationella modifieringar (PTM) förändrar proteinstrukturer och funktioner. Metoder för samtidig anrikning av flera PTM-typer kan maximera täckningen i analyser. Vi presenterar ett protokoll med dubbelfunktionell Ti(IV)-immobiliserad metallaffinitetskromatografi följt av masspektrometri för samtidig anrikning och analys av protein N-glykosylering och fosforylering i bukspottkörtelvävnader.
Abstract
Masspektrometri kan ge djup täckning av post-translationella modifieringar (PTM), även om anrikning av dessa modifieringar från komplexa biologiska matriser ofta är nödvändig på grund av deras låga stökiometri jämfört med icke-modifierade analyter. De flesta anrikningsarbetsflöden av PTM på peptider i bottom-up proteomics-arbetsflöden, där proteiner enzymatiskt smälts innan de resulterande peptiderna analyseras, berikar bara en typ av modifiering. Det är dock hela komplementet av PTM som leder till biologiska funktioner, och anrikning av en enda typ av PTM kan missa sådan överhörning av PTM. PTM-överhörning har observerats mellan proteinglykosylering och fosforylering, de två vanligaste PTM: erna i humana proteiner och även de två mest studerade PTM: erna med masspektrometriarbetsflöden. Med hjälp av den samtidiga anrikningsstrategin som beskrivs här berikas båda PTM: erna från post mortem human bukspottkörtelvävnad, en komplex biologisk matris. Dubbelfunktionell Ti (IV) -immobiliserad metallaffinitetskromatografi används för att separera olika former av glykosylering och fosforylering samtidigt i flera fraktioner i en bekväm spinnspetsbaserad metod, vilket möjliggör nedströmsanalyser av potentiella PTM-överhörningsinteraktioner. Detta anrikningsarbetsflöde för glyko- och fosfopeptider kan tillämpas på olika provtyper för att uppnå djup profilering av flera PTM och identifiera potentiella målmolekyler för framtida studier.
Introduction
Protein post-translationella modifieringar (PTM) spelar en viktig roll för att modulera proteinstrukturer och följaktligen deras funktioner och nedströms biologiska processer. Mångfalden i det mänskliga proteomet ökar exponentiellt på grund av den kombinatoriska variationen som erbjuds av olika PTM. Olika varianter av proteiner från deras kanoniska sekvenser som förutsägs av genomet är kända som proteoformer, och många proteoformer härrör från PTM1. Att studera proteoform mångfald inom hälsa och sjukdom har blivit ett forskningsområde av stort intresse de senaste åren 2,3.
Studien av proteoformer och mer specifikt PTM med stort djup har blivit mer lätt genom utvecklingen av masspektrometri (MS) -baserade proteomikmetoder. Med hjälp av MS joniseras, fragmenteras och identifieras analyter baserat på m /z av fragment. Anrikningsmetoder är ofta nödvändiga på grund av den låga relativa förekomsten av PTM jämfört med icke-modifierade former av proteiner. Även om analys av intakta proteiner och deras PTM, kallade top-down-analyser, har blivit mer rutinmässig, är den enzymatiska matsmältningen av proteiner och analysen av deras komponentpeptider i bottom-up-analyser fortfarande den mest använda vägen för PTM-analys. De två mest studerade PTM: erna, och de två vanligaste PTM : erna in vivo, är glykosylering och fosforylering4. Dessa två PTM spelar stora roller i cellsignalering och igenkänning och är därför viktiga modifieringar att karakterisera inom sjukdomsforskning.
De kemiska egenskaperna hos olika PTM ger ofta vägar mot anrikning av dessa PTM vid protein- och peptidnivåerna före analys. Glykosylering är en hydrofil PTM på grund av överflöd av hydroxylgrupper på varje monosackarid. Denna egenskap kan användas för att berika glykopeptider i hydrofil interaktionskromatografi (HILIC), som kan separera mer hydrofila glykopeptider från de hydrofoba icke-modifierade peptiderna5. Fosforylering tillför fosfatdelen, som är negativt laddad utom vid surt pH. På grund av denna laddning kan olika metallkatjoner, inklusive titan, användas för att locka och binda fosfopeptider medan icke-fosforylerade arter tvättas bort. Detta är principen för immobiliserad metallaffinitetskromatografi (IMAC). Ytterligare diskussioner om dessa och andra anrikningsstrategier för glykosylering och fosforylering finns i de senaste granskningarna 6,7.
Jämförelsevis stora mängder utgångspeptidmaterial (0,5 mg eller mer) behövs ofta för anrikningsprotokoll på grund av den låga stökiometrin av PTM på peptider. I scenarier där denna mängd prov kanske inte är lätt att erhålla, såsom tumörkärnbiopsi eller cerebrospinalvätskeanalyser, är det fördelaktigt att använda enkla arbetsflöden som resulterar i maximal biomolekylär information. De senaste strategierna som utvecklats av vårt laboratorium och andra har belyst samtidig och parallell analys av glykosylering och fosforylering med samma PTM-anrikningsarbetsflöde 8,9,10,11,12. Även om de kemiska egenskaperna hos dessa två PTM kan skilja sig åt, kan dessa PTM analyseras i flera steg på grund av de innovativa separationsteknikerna och materialen som används. Till exempel överlagrar elektrostatisk repulsions-hydrofil interaktionskromatografi (ERLIC) separationer baserade på hydrofila interaktioner mellan analyter och den mobila fasen med laddningsladdningsinteraktioner mellan analyter och det stationära fasmaterialet 13,14,15,16. Vid surt pH kan attraktionen av fosforylerade peptider till den stationära fasen förbättra deras retention och separation från icke-modifierade peptider. Material bestående av Ti(IV) immobiliserat på hydrofila mikrosfärer kan användas för HILIC- och IMAC-baserad eluering för att separera fosfopeptider och neutrala, sura och mannos-6-fosforylerade glykopeptider17,18. Denna strategi är känd som dubbelfunktionell Ti (IV) -IMAC. Att använda dessa strategier för att berika flera PTM i ett enda arbetsflöde kan göra analyser av potentiella PTM-överhörningsinteraktioner mer tillgängliga. Dessutom är den totala provmängden och tidskraven mindre än de konventionella anrikningsmetoderna när de utförs parallellt (dvs. HILIC och IMAC på separata prov alikvoter).
För att demonstrera den dubbelfunktionella Ti(IV)-IMAC-strategin för samtidig analys av proteinglykosylering och fosforylering har vi tillämpat den för att analysera post-mortem humana bukspottkörtelvävnader. Bukspottkörteln producerar både matsmältningsenzymer och reglerande hormoner, inklusive insulin och glukagon. Pankreasfunktionen är nedsatt vid bukspottkörtelsjukdom. Vid diabetes påverkas regleringen av blodsockret, vilket leder till högre nivåer av glukos i blodet. Vid pankreatit är inflammation resultatet av automatisk matsmältning av organet3. Förändringar i PTM-profiler, inklusive glykosylering och fosforylering, kan, som ofta är fallet, resultera i andra sjukdomar.
Här beskriver vi ett protokoll för en spin-tip-baserad samtidig anrikningsmetod, baserad på en dubbelfunktionell Ti(IV)-IMAC-strategi, för N-glykopeptider och fosfopeptider härledda från proteiner extraherade från bukspottkörtelvävnad. Protokollet inkluderar proteinutvinning och matsmältning, anrikning, MS-datainsamling och databehandling, vilket kan ses i figur 1. Representativa data från denna studie är tillgängliga via ProteomeXchange Consortium med identifierare PXD033065.
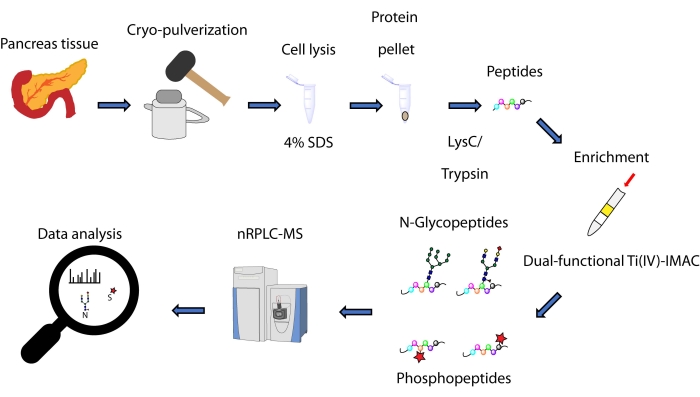
Figur 1: Arbetsflöde för samtidig analys av N-glykopeptider och fosfopeptider från humana bukspottkörtelvävnader. Vävnader pulveriseras först till ett fint pulver före proteinutvinning med användning av tvättmedlet natriumdodecylsulfat (SDS). Proteiner utsätts sedan för enzymatisk matsmältning. De resulterande peptiderna alikvoteras före anrikning med användning av dubbelfunktionell Ti(IV)-IMAC. Rådata samlas in med hjälp av vätskekromatografi-masspektrometri (nRPLC-MS) i nanoskala och analyseras med hjälp av databassökningsprogramvara. Klicka här för att se en större version av denna siffra.
Detta protokoll är avsett att göra PTM-analyser mer tillgängliga och möjliggöra mer omfattande analys av flera PTM i samma arbetsflöde. Detta protokoll kan tillämpas på andra komplexa biologiska matriser, inklusive celler och biofluider.
Protocol
Representative Results
Discussion
Den dubbelfunktionella Ti (IV) -IMAC-strategin är användbar för samtidig analys av N-glykopeptider och fosfopeptider från samma prov i ett enda arbetsflöde för provberedning. ERLIC-baserade metoder har också visat sig utföra samtidig anrikning av PTM. Båda strategierna har tidigare använts för djup täckning i PTM-analyser14,18. Genom att anpassa den dubbla Ti-metoden till att minska provinkubationstiden med hjälp av spin-tips hoppas vi att detta prot…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna forskning stöddes delvis av bidragsfinansiering från NIH (R01DK071801, RF1AG052324, P01CA250972 och R21AG065728) och Juvenile Diabetes Research Foundation (1-PNF-2016-250-S-B och SRA-2016-168-S-B). Data som presenteras här erhölls också delvis genom stöd från en NIH / NCATS UL1TR002373-utmärkelse genom University of Wisconsin Institute for Clinical and Translational Research. Orbitrap-instrumenten köptes genom stöd av ett NIH-delat instrumentbidrag (NIH-NCRR S10RR029531) och rektorskansliet för forskning och forskarutbildning vid University of Wisconsin-Madison. Vi vill också erkänna det generösa stödet från University of Wisconsin Organ and Tissue Donation Organization som tillhandahöll mänsklig bukspottkörtel för forskning och hjälp av Dan Tremmel, Dr. Sara D. Sackett och Prof. Jon Odorico för att tillhandahålla proverna till vårt laboratorium. Vår forskargrupp vill särskilt tacka de familjer som donerade vävnader för denna studie. L.L. erkänner NIH-bidrag S10OD025084, ett bukspottkörtelcancerpilotbidrag från University of Wisconsin Carbone Cancer Center (233-AAI9632), samt en Vilas Distinguished Achievement Professorship och Charles Melbourne Johnson Distinguished Chair Professorship med finansiering från Wisconsin Alumni Research Foundation och University of Wisconsin-Madison School of Pharmacy.
Materials
| Acetic Acid, Glacial (Certified ACS) | Fisher Scientific | A38S-500 | |
| Acetone (Certified ACS) | Fisher Scientific | A18-1 | |
| Acetonitrile, Optima LC/MS Grade | Fisher Scientific | A955-4 | |
| Ammonium Acetate (Crystalline/Certified ACS) | Fisher Scientific | A637-500 | |
| Ammonium Hydroxide (Certified ACS Plus) | Fisher Scientific | A669-212 | |
| Byonic software | Protein Metrics | n/a | Commercial software used for glycoproteomic analysis (https://proteinmetrics.com/byos/) |
| C18 BEH material | Waters | 186002353 | Material removed from column and used to pack nano capillaries (pulledto integrate tip used directly in line with instrument inlet) |
| CAE-Ti-IMAC, 100% | J&K Scientific | 2749380-1G | Material used for dual-functional Ti(IV)-IMAC; can also be used for conventional IMAC/conventional phosphopeptide enrichment |
| Cellcrusher kit | Cellcrusher | n/a | Used for grinding tissue samples into powder before extraction |
| Eppendorf 5424R Microcentrifuge | Fisher Scientific | 05-401-205 | For temperature-controlled centrifugation |
| cOmplete protease inhibitor cocktail tablets | Sigma | 11697498001 | |
| DTT, Molecular Grade (DL-Dithiothreitol) | Promega | V3151 | Protein reducing agent |
| Ethanol, 200 proof (100%), USP | Fisher | 22-032-601 | |
| Fisherbrand Analog Vortex Mixer | Fisher Scientific | 02-215-414 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (1.5 mL) | Fisher Scientific | 02-681-320 | |
| Fisherbrand Low-Retention Microcentrifuge Tubes (2 mL) | Fisher Scientific | 02-681-321 | |
| Fisherbrand Model 120 Sonic Dismembrator | Fisher Scientific | FB120110 | For sample lysis using ultrasonication |
| Formic Acid, 99.0+%, Optima LC/MS Grade | Fisher Scientific | A117-50 | |
| Fused silica capillary (75 μm inner diameter, 360 μm outer diameter) | Polymicro Technologies LLC | 100 m TSP075375 | For in-house pulled and packed columns with integrated emitter |
| Hydrofluoric acid (48 wt. % in H2O) | Sigma-Aldrich | 339261-100ML | Used for opening emitter of pulled capillary column |
| Iodoacetamide, BioUltra | Sigma | I1149-5G | Protein reducing reagent |
| MaxQuant software | n/a | n/a | Free software used for phosphoproteomic analysis (https://www.maxquant.org/) |
| Multi-therm Shaker with heating and cooling | Benchmark Scientific | H5000-HC | Heating block |
| Oasis HLB 1 cc Vac Cartridge, 10 mg Sorbent per Cartridge, 30 µm, 100/pk | Waters | 186000383 | Larger-scale cartridge desalting for tryptic digests (loading capacity approximately up to 1 mg each) |
| OMIX C18 pipette tips, 100 µL tip, 10 – 100 μL elution volume, 1 x 96 tips | Agilent | A57003100 | Smaller-scale packed pipette tip for desalting for enrichment elutions |
| P-2000 Micropipette Puller | Sutter Instrument Co. | P-2000/F | For pulling nano-capillary columns for LC-MS |
| PhosSTOP phosphatase inhibitor tablets | Sigma | 4906845001 | |
| Pierce BCA Protein Assay Kit | Thermo Fisher Scientific | 23225 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| PolySAX LP (12 μm, pore size 300 Å) | PolyLC | BMSX1203 | Material for strong anion-exchange chromatography used for ERLIC/conventional glycopeptide enrichment |
| Potassium Phosphate Monobasic (Crystalline/Certified ACS) | Fisher Scientific | P285-500 | |
| Pressure injection cell with integrated magnetic stirplate | Next Advance | PC77-MAG | For packing nano-capillary columns with stationary phase up to 2500 psi limit |
| Proteome Discoverer software | Thermo Fisher Scientific | n/a | Commercial software for proteomics anaysis (with integrated database searching software nodes) and data visualization (https://www.thermofisher.com/us/en/home/industrial/mass-spectrometry/liquid-chromatography-mass-spectrometry-lc-ms/lc-ms-software/multi-omics-data-analysis/proteome-discoverer-software.html) |
| SpeedVac SC110 Vacuum Concentrator Model SC110-120 | Savant | n/a | Centrifugal vacuum concentrator for drying samples (under heat) |
| SDS Solution, 10% Sodium Dodecyl Sulfate Solution, Molecular Biology/Electrophoresis | Fisher Scientific | BP2436200 | |
| Sequencing Grade Modified Trypsin | Promega | V5111 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher Scientific | S271-500 | |
| TopTip, Empty, 10-200 µL, Pack of 96 | Glygen Corporation | TT2EMT.96 | Empty pipette tip with micron-sized hole used that can be used to pack chromatographic materials for enrichments, bundled with tube adapters |
| Triethylammonium bicarbonate buffer (TEAB, 1 M, pH 8.5 (volatile)) | Sigma | 90360-100ML | |
| Trifluoroacetic acid, Reagent Grade, 99% | Fisher Scientific | 60-017-61 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | Fisher Scientific | BP152-500 | |
| Trypsin/Lys-C Mix, Mass Spec Grade | Promega | V5071 | |
| Urea (Certified ACS) | Fisher Scientific | U15-500 | |
| Water, Optima LC/MS Grade | Fisher Scientific | W64 |
References
- Smith, L. M., Kelleher, N. L. Proteoform: a single term describing protein complexity. Nature Methods. 10 (3), 186-187 (2013).
- Pan, S., Brentnall, T. A., Chen, R. Glycoproteins and glycoproteomics in pancreatic cancer. World Journal of Gastroenterology. 22 (42), 9288-9299 (2016).
- Tabang, D. N., Ford, M., Li, L. Recent advances in mass spectrometry-based glycomic and glycoproteomic studies of pancreatic diseases. Frontiers in Chemistry. 9, 707387 (2021).
- Khoury, G. A., Baliban, R. C., Floudas, C. A. Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database. Scientific Reports. 1, 90 (2011).
- Alpert, A. J. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds. Journal of Chromatography A. 499, 177-196 (1990).
- Riley, N. M., Bertozzi, C. R., Pitteri, S. J. A pragmatic guide to enrichment strategies for mass spectrometry-based glycoproteomics. Molecular & Cellular Proteomics. 20, 100029 (2020).
- Low, T. Y., et al. Widening the bottleneck of phosphoproteomics: Evolving strategies for phosphopeptide enrichment. Mass Spectrometry Reviews. 40 (4), 309-333 (2021).
- Cho, K. C., Chen, L., Hu, Y., Schnaubelt, M., Zhang, H. Developing workflow for simultaneous analyses of phosphopeptides and glycopeptides. ACS Chemical Biology. 14 (1), 58-66 (2019).
- Zhou, Y., et al. An integrated workflow for global, glyco-, and phospho-proteomic analysis of tumor tissues. Analytical Chemistry. 92 (2), 1842-1849 (2020).
- Tang, R., et al. Facile preparation of bifunctional adsorbents for efficiently enriching N-glycopeptides and phosphopeptides. Analytica Chimica Acta. 1144, 111-120 (2021).
- Wang, Z., Wang, J., Sun, N., Deng, C. A promising nanoprobe based on hydrophilic interaction liquid chromatography and immobilized metal affinity chromatography for capture of glycopeptides and phosphopeptides. Analytica Chimica Acta. 1067, 1-10 (2019).
- Glover, M. S., et al. Characterization of intact sialylated glycopeptides and phosphorylated glycopeptides from IMAC enriched samples by EThcD fragmentation: Toward combining phosphoproteomics and glycoproteomics. International Journal of Mass Spectrometry. 427, 35-42 (2018).
- Alpert, A. J. Electrostatic repulsion hydrophilic interaction chromatography for isocratic separation of charged solutes and selective isolation of phosphopeptides. Analytical Chemistry. 80 (1), 62-76 (2008).
- Cui, Y., et al. Counterion optimization dramatically improves selectivity for phosphopeptides and glycopeptides in electrostatic repulsion-hydrophilic interaction chromatography. Analytical Chemistry. 93 (22), 7908-7916 (2021).
- Cui, Y., et al. Finding the sweet spot in ERLIC mobile phase for simultaneous enrichment of N-Glyco and phosphopeptides. Journal of the American Society for Mass Spectrometry. 30 (12), 2491-2501 (2019).
- Tabang, D. N., et al. Analysis of pancreatic extracellular matrix protein post-translational modifications via electrostatic repulsion-hydrophilic interaction chromatography coupled with mass spectrometry. Molecular Omics. 17 (5), 652-664 (2021).
- Huang, J., et al. Dual-functional Titanium(IV) immobilized metal affinity chromatography approach for enabling large-scale profiling of protein Mannose-6-Phosphate glycosylation and revealing its predominant substrates. Analytical Chemistry. 91 (18), 11589-11597 (2019).
- Huang, J., et al. Dual-functional Ti(IV)-IMAC material enables simultaneous enrichment and separation of diverse glycopeptides and phosphopeptides. Analytical Chemistry. 93 (24), 8568-8576 (2021).
- Jami-Alahmadi, Y., Pandey, V., Mayank, A. K., Wohlschlegel, J. A. A robust method for packing high resolution C18 RP-nano-HPLC columns. Journal of Visualized Experiments: JoVE. (171), e62380 (2021).
- Bern, M., Kil, Y. J., Becker, C. Byonic: advanced peptide and protein identification software. Current Protocols in Bioinformatics. , (2012).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Perez-Riverol, Y., et al. The PRIDE database and related tools and resources in 2019: improving support for quantification data. Nucleic Acids Research. 47, 442-450 (2019).
- Zhou, Y., et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets. Nature Communications. 10 (1), 1523 (2019).
- Zacharias, L. G., et al. HILIC and ERLIC enrichment of glycopeptides derived from breast and brain cancer cells. Journal of Proteome Research. 15 (10), 3624-3634 (2016).
- Yang, W., et al. Comparison of enrichment methods for intact N- and O-linked glycopeptides using strong anion exchange and hydrophilic interaction liquid chromatography. Analytical Chemistry. 89 (21), 11193-11197 (2017).
- Toghi Eshghi, S., Shah, P., Yang, W., Li, X., Zhang, H. GPQuest: A spectral library matching algorithm for site-specific assignment of tandem mass spectra to intact N-glycopeptides. Analytical Chemistry. 87 (10), 5181-5188 (2015).
- Liu, M. -. Q., et al. pGlyco 2.0 enables precision N-glycoproteomics with comprehensive quality control and one-step mass spectrometry for intact glycopeptide identification. Nature Communications. 8 (1), 438 (2017).
- Lu, L., Riley, N. M., Shortreed, M. R., Bertozzi, C. R., Smith, L. M. O-Pair Search with MetaMorpheus for O-glycopeptide characterization. Nature Methods. 17 (11), 1133-1138 (2020).
- Caval, T., Heck, A. J. R., Reiding, K. R. Meta-heterogeneity: Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein. Molecular & Cellular Proteomics. 20, 100010 (2021).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Leutert, M., Entwisle, S. W., Villén, J. Decoding post-translational modification crosstalk with proteomics. Molecular & Cellular Proteomics. 20, 100129 (2021).
- Hart, G. W., Slawson, C., Ramirez-Correa, G., Lagerlof, O. Cross talk between O-GlcNAcylation and phosphorylation: Roles in signaling, transcription, and chronic disease. Annual Review of Biochemistry. 80 (1), 825-858 (2011).

