Strumenti microfluidici per sondare le interazioni fungine-microbiche a livello cellulare
Summary
A causa dell’opacità del suolo, le interazioni tra i suoi microbi costituenti non possono essere facilmente visualizzate con risoluzione cellulare. Qui vengono presentati due strumenti microfluidici, che offrono nuove opportunità per studiare le interazioni fungo-microbiche. I dispositivi sono versatili e semplici da usare, consentendo un elevato controllo spaziotemporale e immagini ad alta risoluzione a livello cellulare.
Abstract
I funghi filamentosi sono abitanti di successo del suolo e svolgono un ruolo importante negli ecosistemi del suolo, come nella decomposizione della materia organica e inorganica, nonché nella regolazione dei livelli di nutrienti. Lì trovano anche numerose opportunità di interagire con una varietà di altri microbi come batteri o altri funghi. Studiare le interazioni fungine a livello cellulare, tuttavia, può essere difficile a causa della natura del suolo simile a una scatola nera. Sono in fase di sviluppo nuovi strumenti microfluidici per lo studio delle interazioni fungine; sono evidenziate due piattaforme progettate per studiare le interazioni batterico-fungine e fungino-fungine. All’interno di questi microcanali, le interazioni fungo-microbiche possono essere monitorate in ambienti fisico-chimici controllati a una risoluzione temporale e spaziale più elevata di quanto fosse possibile in precedenza. L’applicazione di questi strumenti ha prodotto numerose nuove intuizioni biologiche, come l’osservazione dell’attaccamento polare batterico alle ife o la rivelazione di antagonismi fungino-fungini non caratterizzati. Una caratteristica fondamentale di queste metodologie riguarda la facilità d’uso di questo strumento da parte di non esperti, producendo tecnologie altamente traducibili per l’uso nei laboratori di microbiologia.
Introduction
Il suolo è un ambiente eccezionalmente diversificato contenente un’abbondanza di microrganismi che sono strumentali ai cicli del carbonio e del fosforo 1,2. I funghi filamentosi sono una componente importante di numerosi ecosistemi come decompositori di materia organica e inorganica e possono migliorare la nutrizione delle piante attraverso la formazione di relazioni simbiotiche 3,4. All’interno del suolo, i funghi interagiscono dinamicamente con una moltitudine di microbi come altri funghi5, batteri6, virus7 e nematodi8. Queste interazioni hanno conseguenze significative per la salute del suolo e delle piante. Tuttavia, a causa della mancanza di sistemi sperimentali appropriati in grado di eseguire l’imaging di microrganismi interagenti ad alta risoluzione, molti rimangono indefiniti.
Le indagini riguardanti le interazioni batterico-fungine (BFI) e le interazioni fungo-fungine (FFI) hanno preziose applicazioni in una vasta gamma di campi, tra cui gli antimicrobici in medicina e gli agenti di controllo biologico in agricoltura. Ad esempio, il fungo Coprinopsis cinerea produce il peptide copsina, che ha dimostrato di esibire attività antibatterica contro il patogeno umano Listeria monocytogenes9. Allo stesso modo, il composto di derivazione fungina, griseofulvina, è ampiamente usato come trattamento per le infezioni fungine umane ed è inoltre in grado di inibire la crescita del fungo patogeno della pianta Alternaria solani10,11. Diversi ceppi del batterio Bacillus subtilis che abita nel suolo hanno anche dimostrato di essere efficaci agenti di biocontrollo del patogeno vegetale fungino Rhizoctonia solani12,13. Tuttavia, a causa delle limitazioni associate alle metodologie tradizionali, i BFI e gli FFA sono poco compresi a livello di singole cellule.
Gli studi convenzionali in genere esplorano BFI e FFI su macroscala usando placche di agar con due o più specie in confronto. La loro interazione è valutata misurando i tassi di crescita e la produzione di metaboliti delle specie in confronto 14,15,16; tuttavia, questa metodologia è risolta solo a livello di colonia. Per studiare le interazioni a livello cellulare, gli inoculanti batterici e fungini possono essere coltivati su vetrini per microscopio rivestiti di agar che vengono poi ripresi al microscopio17. Tuttavia, può essere difficile seguire una singola ifa usando vetrini per microscopio a causa della mancanza di confinamento, il che significa che le immagini time-lapse sono più difficili da ottenere. Inoltre, l’opportunità di confinare spazialmente altri microrganismi all’interno di regioni definite del micelio fungino o di creare ambienti chimici definiti che possono essere perturbati, ad esempio, non è possibile in tali configurazioni. La natura “scatola nera” del suolo aggiunge anche alla complessità dello studio delle interazioni fungo-microbiche a livello di singole cellule18. Osservando le specie interagenti lontano dall’incredibile diversità del microbioma del suolo, è possibile valutare il modo esatto in cui i singoli membri interagiscono. Pertanto, vi è una continua necessità di piattaforme versatili che consentano l’imaging ad alta risoluzione a cella singola di BFI e FFA.
Le tecnologie microfluidiche, i cosiddetti sistemi lab-on-a-chip, forniscono una piattaforma ideale per lo studio di BFI e FONI a livello di singole celle. Il campo della microfluidica, originato da tecnologie sviluppate per l’analisi chimica e la microelettronica, è stato adottato dalle scienze biologiche19. Le tecnologie microfluidiche regolano piccoli volumi di fluidi all’interno di una rete su misura di canali miniaturizzati, aventi almeno una dimensione su scala micrometrica, e il loro uso nella ricerca biologica si sta espandendodi 20. In particolare, sono stati sviluppati dispositivi microfluidici per esaminare la crescita di funghi filamentosi 21,22,23,24,25,26,27,28,29,30. Uno dei vantaggi dell’utilizzo di questa tecnologia è che il confinamento delle ife e la distribuzione dei nutrienti all’interno di microcanali assomiglia più da vicino alla struttura dell’ambiente del suolo rispetto ai metodi convenzionali di agar31. Recentemente, le piattaforme microfluidiche sono state utilizzate per studiare le interazioni tra neutrofili umani e patogeni fungini32, batteri e radici vegetali33, nonché funghi e nematodi34,35.
Uno dei molti vantaggi dell’utilizzo della microfluidica per lo studio delle interazioni microbiche include il controllo specifico dell’ambiente dei microcanali. Ad esempio, i regimi di flusso laminare possono essere sfruttati per generare gradienti di concentrazione definiti, il che è particolarmente utile quando si esamina la chemiotassi batterica36. Un altro vantaggio è che la natura trasparente del poli(dimetilsilossano) (PDMS), un polimero elastomerico economico e biocompatibile comunemente usato nella produzione di dispositivi microfluidici, facilita l’imaging ad alta risoluzione di singole cellule utilizzando la microscopia a campo luminoso e fluorescenza37. Allo stesso modo, il confinamento dei microbi all’interno di microcanali significa che possono essere eseguiti esperimenti time-lapse che tracciano singole cellule, consentendo di registrare e quantificare le singole risposte cellulari37. Infine, poiché i dispositivi microfluidici possono essere progettati per essere facili da usare, possono essere facilmente utilizzati da non esperti38.
Approfondire la conoscenza delle interazioni tra microrganismi che vivono nel suolo è importante per migliorare le pratiche di gestione sostenibile degli ecosistemi che mantengono la biodiversità e per mitigare l’impatto dei cambiamenti climatici sugli ambienti terrestri39. Pertanto, lo sviluppo di nuovi strumenti microfluidici è fondamentale per espandere la comprensione dei funghi e delle loro interazioni a livello cellulare. Il protocollo qui si concentrerà su due dispositivi microfluidici prodotti per lo studio di BFI40 e FFI41 come rappresentato nella Figura 1.
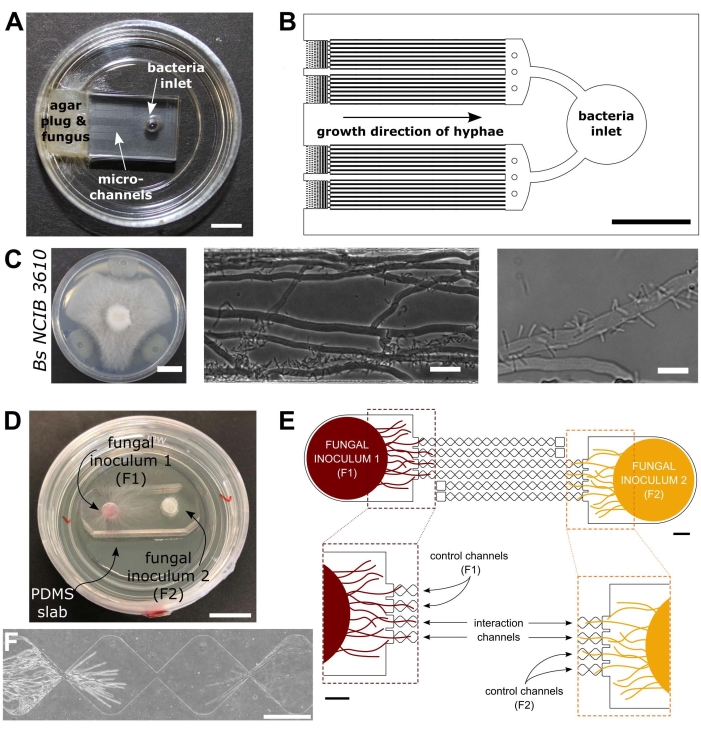
Figura 1: Rappresentazione visiva e schematica dei dispositivi di interazione batterico-fungina (BFI) e di interazione fungo-fungino (FFI). (A) Immagine del dispositivo BFI. Una spina miceliale è posizionata all’ingresso di un’estremità dei microcanali per consentire la crescita ifale nel dispositivo. L’ingresso batterico si trova all’estremità opposta. Barra della scala = 5 mm. (B) Panoramica schematica del dispositivo BFI, raffigurante il posizionamento delle prese batteriche e la direzione della crescita ifale attraverso i microcanali di interazione. I canali sono profondi 10 μm, larghi 100 μm e lunghi 7 mm, con 28 canali di osservazione in totale. (C) Saggio di confronto su piastra di agar tra Coprinopsis cinerea e Bacillus subtilis NCIB 3610, barra di scala = 20 mm (sinistra). Immagini al microscopio che mostrano l’interazione tra C. cinerea e B. subtilis NCIB 3610 all’interno del microcanale (centrale e destro), cioè l’attaccamento polare dei batteri alle ife fungine. Barra della scala = 25 μm (al centro) e 10 μm (a destra). (D) Immagine del dispositivo FFI legato a una capsula di Petri con fondo di vetro, doppia inoculata con tappi miceliali. Barra della scala = 1 cm. (E) Panoramica schematica del dispositivo FFI. Due spine inoculanti fungine vengono introdotte nelle prese d’ingresso alle due estremità del dispositivo, consentendo l’esplorazione ifale dei microcanali. I canali di controllo sono collegati a un solo ingresso fungino e hanno un canale senza uscita, impedendo le interazioni tra i funghi di prova. I canali di interazione collegano entrambe le insenature fungine e consentono interazioni ifali tra i soggetti del test all’interno del microcanale. Ogni canale di interazione è costituito da 18 sezioni a forma di diamante, che misurano una lunghezza totale di 8,8 mm (490 x 430 μm per diamante), 10 μm di profondità e hanno una regione di collegamento tra ciascun diamante di 20 μm. I tipi di canale sono duplicati, barre di scala = 1 mm. (F) Zona di interazione tra due fronti ifali in avvicinamento, che crescono da estremità opposte del canale di interazione interconnesso. Immagine al microscopio a contrasto di fase, barra di scala = 250 μm. I pannelli in questa figura sono stati modificati da Stanley et al., 2014 (A-C)40 e Gimeno et al., 2021 (D-F)41. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Questo articolo presenta un protocollo per lo studio delle interazioni fungo-microbiche utilizzando la microfluidica del canale. Gli autori mirano a dimostrare la versatilità di questi dispositivi e incoraggiare l’adattamento per soddisfare gli interessi del ricercatore. Utilizzando i dispositivi esemplari BFI e FFI, le interazioni fungine-microbiche possono essere studiate in modo più dettagliato di quanto precedentemente accessibile. Rimuovendo la complessità di fondo e l’eterogeneità del suolo, moderando la cresci…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Riconosciamo il sostegno finanziario del Dipartimento di Bioingegneria dell’Imperial College di Londra e del Leverhulme Trust (Research Grant Reference: RPG-2020-352).
Materials
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
References
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).

