Radyoaktif Etiketli Antikorların İmmobilize Antijenlere Bağlanma Afinitesinin (KD) Belirlenmesi
Summary
Burada, radyoaktif işaretli antikorların immobilize antijenlere bağlanma afinitesini (KD) belirlemek için bir yöntem açıklanmaktadır. KD , radyoaktif etiketli bir antikorun antijenine çeşitli konsantrasyonlarda toplam, spesifik ve spesifik olmayan bağlanmasını ölçerek bir doygunluk bağlama deneyinden belirlenebilen denge ayrışma sabitidir.
Abstract
Bağlanma afinitesinin (KD) belirlenmesi, radyoaktif olarak etiketlenmiş antikorların (rAb) karakterizasyonunun önemli bir yönüdür. Tipik olarak, bağlanma afinitesi denge ayrışma sabiti KD ile temsil edilir ve antikor bağlanma bölgelerinin yarısının dengede işgal edildiği antikor konsantrasyonu olarak hesaplanabilir. Bu yöntem, radyoaktif olarak etiketlenmiş herhangi bir antikor veya diğer protein ve peptit iskelelerine genelleştirilebilir. Hücre bazlı yöntemlerin aksine, immobilize antijenlerin seçimi, antikorların uzun süreli depolanmasından sonra bağlanma afinitelerini doğrulamak, bispesifik antikor yapılarındaki fragman antijen bağlayıcı bölge (Fab) kollarının bağlanma afinitelerini ayırt etmek ve farklı hücre hatları arasında antijen ekspresyonunda değişkenlik olup olmadığını belirlemek için özellikle yararlıdır. Bu yöntem, kırılabilir 96 delikli bir plaka üzerinde belirtilen kuyucuklara sabit miktarda antijenin hareketsiz hale getirilmesini içerir. Daha sonra sığır serum albümini (BSA) ile tüm kuyucuklarda nonspesifik bağlanma engellendi. Daha sonra, rAb tüm kuyucuklara bir konsantrasyon gradyanında eklendi. rAb’nin doygunluğa ulaşmasına izin vermek için bir dizi konsantrasyon seçildi, yani tüm antijenlerin sürekli olarak rAb tarafından bağlandığı bir antikor konsantrasyonu. İmmobilize antijeni olmayan belirlenmiş kuyularda, rAb’nin spesifik olmayan bağlanması belirlenebilir. İmmobilize antijenli kuyucuklardaki toplam bağlanmadan spesifik olmayan bağlanma çıkarılarak, rAb’nin antijene spesifik bağlanması belirlenebilir. rAb’nin KD’si , ortaya çıkan doygunluk bağlama eğrisinden hesaplandı. Örnek olarak, bağlanma afinitesi, epidermal büyüme faktörü reseptörü (EGFR) ve sitoplazmik mezenkimal epitel geçişi (cMET) proteinleri için bispesifik bir antikor olan radyoişaretli amivantamab kullanılarak belirlendi.
Introduction
Radyoaktif olarak etiketlenmiş antikorların (rAb) tıpta çeşitli kullanımları vardır. Onkolojide çoğunluğu görüntüleme ve terapötik ajanlar olarak kullanılırken, romatolojiye bağlı inflamasyon, kardiyoloji ve nöroloji için görüntüleme uygulamalarıvardır 1. Görüntüleme rAbs, lezyonları saptamak için yüksek duyarlılığa sahiptir ve tedavi için hasta seçiminde yardımcı olma potansiyeline sahiptir 2,3,4,5. Ayrıca kendi antijenleri için özgüllükleri nedeniyle tedavi için de kullanılırlar. Teranostik olarak bilinen bir stratejide, aynı rAb hem görüntüleme hem de tedavi için kullanılır6.
İdeal olarak, radyoetiketleme için seçilen antikor, radyo-etiketli olmayan yöntemler kullanılarak yüksek bağlanma afinitesine ve özgüllüğüne sahip olduğu zaten kanıtlanmış bir antikordur. Antikorların radyo-etiketlenmesi, antikorların kararlı kovalent bağlar (örneğin radyoiyot) oluşturan bir radyonüklid ile doğrudan kimyasal modifikasyonu yoluyla veya dolaylı olarak daha sonra radyometallere koordine olan şelatörlerle konjugasyon yoluyla sağlanabilir 7,8. Radyoiyot gibi doğrudan radyoetiketleme, antikor üzerindeki tirozin ve histidin kalıntılarını spesifik olarak değiştirir. Bu kalıntılar antijen bağlanması için önemliyse, bu radyokonjugasyon bağlanma afinitesini değiştirecektir. Tersine, antikorların konjugasyonu ve dolaylı radyo-etiketlenmesi için birden fazla yerleşik protokol vardır. Örneğin, antikorların PET görüntülemesi için zirkonyum-89’u (89Zr) bağlamak için kullanılan yaygın bir şelatör, 9,10 antikorunun lizin kalıntılarına rastgele konjuge edilen p-izotiyosiyanatobenzil-desferiksamin (DFO) ‘dir. Antijen bağlayıcı bölgede lizin kalıntıları varsa, bu bölgelerdeki konjugasyon sterik olarak antijen bağlanmasını engelleyebilir ve bu nedenle antikor-antijen bağlanmasını tehlikeye atabilir. Bu nedenle, antikorların dolaylı veya doğrudan radyoetiketlenmesi için kullanılan farklı radyokonjugasyon yöntemleri, antikor radyokonjugatının antijenine bağlanma yeteneği olarak tanımlanan immünoreaktiviteyi potansiyel olarak etkileyebilir 7,11. Bölgeye özgü konjugasyon yöntemleri bu sınırlamayı aşabilir, ancak bu teknikler ek sistein kalıntılarını veya karbonhidrat kalıntıları üzerindeki enzimatik reaksiyonlarda uzmanlığı 12,13,14,15,16 dahil etmek için antikor mühendisliği gerektirir. Bir antikor radyo-etiketlendikten sonra, rAb’nin karakterizasyonunun bir parçası olarak immünoreaktivitenin korunup korunmadığını test etmek önemlidir. İmmünoreaktiviteyi ölçmenin bir yolu, rAb’nin bağlanma afinitesini belirlemektir.
Bu protokolün amacı, rAb-antijen bağlanmasını ölçmek için kurulmuş bir radyoligand doygunluk testi kullanarak rAbs için bağlanma afinitesini belirleme sürecini tanımlamaktır. Bağlanma eğilimi Şekil 1’de özetlenmiştir. Sabit miktarda immobilize antijene daha fazla rAb eklendikçe antijene bağlı antijen miktarı artacaktır. Tüm antijen bağlanma bölgeleri doygun hale getirildikten sonra, bir platoya ulaşılacak ve daha fazla rAbs eklenmesinin bağlı antijen miktarı üzerinde hiçbir etkisi olmayacaktır. Bu modelde, denge ayrışma sabiti (KD), antijen reseptörlerinin yarısını kaplayan antikor konsantrasyonudur17. KD, bir antikorun hedefine ne kadar iyi bağlandığını ve daha yüksek bir bağlanma afinitesine karşılık gelen daha düşük bir KD ile temsil eder. Daha önce ideal bir rAb’nin 1 nanomolar veya daha az18 KD’ye sahip olması gerektiği bildirilmişti. Bununla birlikte, düşük nanomolar aralıkta KD ile daha yeni rAb’ler geliştirilmiştir ve noninvaziv görüntüleme uygulamaları için uygun olduğu düşünülmektedir 19,20,21,22. rAbs’nin radyoligand doygunluk testinde belirlenebilen bir diğer parametre, maksimum antijen bağlanma miktarına karşılık gelen Bmax’tır. Bmax, gerekirse antijen moleküllerinin sayısını hesaplamak için kullanılabilir.
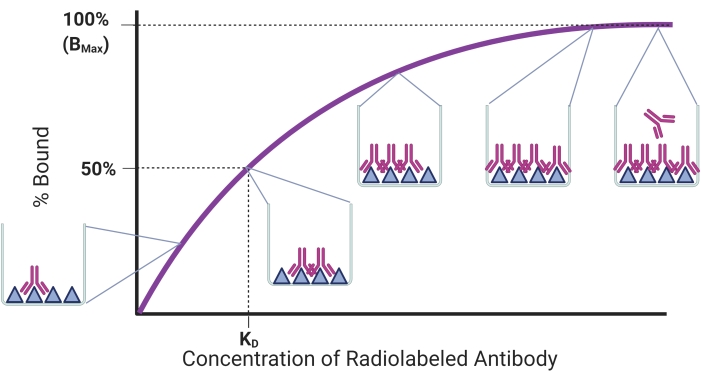
Resim 1: Temsili doygunluk bağlama eğrisi. Antijene bağlı yüzdesi, sabit miktarda antijene eklenen artan antikor konsantrasyonlarına karşı çizilir. Pop-out’lar çeşitli noktalarda bağlanmayı gösterir. Sırasıyla KD ve Bmax’e karşılık gelen konsantrasyon ve bağlanma gösterilmiştir. Bu figür BioRender.com ile yaratılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu tahlil, radyoaktif etiketli bispesifik antikor yapılarının, radyoaktif işaretli bispesifik antikorun kendi antijenlerine bağlanan her bir fragman antijen bağlayıcı bölgesi (Fab) için KD’yi belirlemesi için özellikle önemlidir. Bu protokol, her bir Fab kolunun KD’sini immobilize antijenler üzerinde ayrı ayrı belirlemek için kullanılabilir ve radyokonjugasyondan sonra her bir Fab kolunun kendi antijenine bağlanma afinitesinin etkilenip etkilenmediğini bağımsız olarak karakterize eder. Bu protokol, epidermal büyüme faktörü reseptörü (EGFR) ve sitoplazmik mezenkimal epitelyal geçiş (cMET) proteinleri için bispesifik bir antikor olan radyoaktif işaretli amivantamabın kullanımıile gösterilmiştir 19. Bir Fab kolunun EGFR (α-EGFR) veya cMET’e (α-cMET) bağlandığı ve diğer Fab kolunun bir izotip kontrolü olduğu radyoaktif etiketli tek kollu antikorlar da örnek olarak kullanılmıştır19. Bu protokol, immobilize edilebilen bilinen bir antijene sahip herhangi bir radyoaktif etiketli antikor için de uygundur. Bu protokolde, rAb’nin her bir Fab kolu için spesifik olarak belirlenmiş kuyucuklarda sabit miktarda immobilize antijene rAb’nin seyreltme serisi eklenir. rAb ayrıca, spesifik olmayan bağlanmayı belirlemek için antijen olmadan sadece sığır serum albümini (BSA) ile bloke edilmiş kuyucuklara da eklenir. Spesifik bağlanmayı belirlemek için, immobilize antijene spesifik olmayan bağlanma, toplam rAb bağlanmasından çıkarılır. Elde edilen doygunluk bağlama eğrisi daha sonra yukarıda açıklandığı gibi KD’yi belirlemek için kullanılır.
Bu yöntemin bir avantajı, saflaştırılmış antijenler kullanıldığında, antijen ekspresyon seviyelerinin hücre kültürü sırasında etkilenebileceği ve farklı hücre hatlarının değişken antijen ekspresyon seviyelerine sahip olduğu göz önüne alındığında, antijenlerin kaynağı olarak hücre hatlarının kullanılmasına kıyasla daha yüksek tekrarlanabilirliktir. Radyoaktif etiketli bispesifik antikorlar söz konusu olduğunda, antijenlerden sadece birini diğeri olmadan eksprese eden hücre hatları mevcut olmayabilir, bu da bireysel Fab kollarının bağlanma afinitesini karakterize etmeyi çok zorlaştırır. Özellikle, radyoligand doygunluk testi yönteminin radyoaktif etiketli olmayan yöntemlere göre en önemli avantajı, rAb’nin konjuge edilmemiş fraksiyonunun katkısı olmadan rAb’nin bağlanma afinitesinin spesifik karakterizasyonudur. Yazarların bilgisinin en iyisine göre, şu anda rAb’yi ana konjuge edilmemiş antikorundan ayırmak için herhangi bir saflaştırma tekniği yoktur. Şelatör ve radyonüklidin nispeten küçük boyutu göz önüne alındığında, rAb’nin genel moleküler ağırlığına katkıları, boyut dışlama kromatografisinde önemsizdir. Bu nedenle, herhangi bir radyoetiketleme tekniğinden üretilen ürün hemen hemen her zaman rAb ve ana konjuge edilmemiş antikorun bir karışımıdır. Radyoetiketli doygunluk testi kullanılarak bağlanma afinitesinin karakterize edilmesi, test edilen ürünün yalnızca rAb olmasını sağlar.
Protocol
Representative Results
Discussion
rAbs’nin geliştirilmesinin bir parçası olarak, bir rAb’nin hedefine özellikle yüksek bağlanma afinitesi ile bağlanmasını sağlamak önemlidir. Bağlanma afinitesinin belirlenmesi, rAb’nin immünoreaktivitesinin, immobilize antijen kullanılarak radyoligand doygunluk testi yoluyla radyokonjugasyondan etkilenip etkilenmediğini bildirebilir. BSA’ya rAb bağlanmasının belirlenmesi, immobilize antijene spesifik bağlanmayı daha doğru bir şekilde ölçmek için spesifik olmayan bağlanmayı ölçmek için kullan…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar, [89Zr] Zr-oksalat üretimi için 3D Görüntüleme’ye ve Janssen Pharmaceuticals’taki Dr. Sheri Moores’a antikor sağladıkları için teşekkür ediyor.
Materials
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
References
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).

