T 세포의 바이러스 형질도입을 위한 건식 거대다공성 알긴산 스캐폴드의 제조 및 사용
Summary
본원은 CAR-T 세포 치료를 위한 T 세포를 포함하는 T 세포의 유전공학에 사용하기 위한 효율적인 바이러스 유전자 전달을 매개하는 건식 거대다공성 알기네이트 스캐폴드를 생성하기 위한 프로토콜이다. 스캐폴드는 활성화된 1차 T 세포를 >85% 형질도입으로 형질도입하는 것으로 나타났다.
Abstract
CAR-T 세포 치료를 위한 T 세포의 유전 공학은 지난 몇 년 동안 암 치료의 최전선에 왔습니다. CAR-T 세포는 T 세포로의 바이러스 유전자 전달에 의해 생성됩니다. 바이러스 유전자 전달의 현재 황금 표준은 비용이 많이 들고 시간이 많이 소요되는 레트로넥틴 코팅 플레이트의 스피노클로테이션을 포함합니다. CAR-T 세포를 생성하기 위한 효율적이고 비용 효율적인 방법에 대한 상당한 요구가 존재한다. 여기에 설명된 것은 활성화된 T 세포의 바이러스 형질도입을 효율적으로 촉진하는 Drydux 스캐폴드로 알려진 저렴하고 건조한 거대 다공성 알기네이트 스캐폴드를 제조하는 방법입니다. 스캐폴드는 바이러스가 파종된 레트로넥틴 코팅 플레이트의 금 표준 스피노큘레이션 대신 사용하도록 설계되었으며 세포 형질도입 공정을 단순화합니다. 알긴산염은 칼슘 -D- 글루코 네이트와 가교 결합되고 밤새 동결되어 스캐 폴드를 만듭니다. 동결된 스캐폴드는 동결건조기에서 72시간 동안 동결건조되어 건조 거대다공성 스캐폴드의 형성을 완료한다. 스캐폴드는 바이러스 및 활성화된 T 세포가 유전자 변형 세포를 생성하기 위해 스캐폴드 위에 함께 파종될 때 바이러스 유전자 전달을 매개합니다. 스캐폴드는 >85%의 1차 T 세포 형질도입을 생성하며, 이는 레트로넥틴-코팅된 플레이트에서 스피노클로테이션의 형질도입 효율과 유사하다. 이러한 결과는 건식 거대다공성 알긴산 스캐폴드가 종래의 형질도입 방법에 비해 더 저렴하고 편리한 대안으로서 작용한다는 것을 입증한다.
Introduction
면역 요법은 종양을 특이적으로 표적으로 삼고, 표적을 벗어난 세포 독성을 제한하고, 재발을 방지하는 능력으로 인해 혁신적인 암 치료 패러다임으로 부상했습니다. 특히, 키메라 항원 수용체 T (CAR-T) 세포 요법은 림프종 및 백혈병 치료에 성공하여 인기를 얻고 있습니다. FDA는 2017 년에 최초의 CAR-T 세포 요법을 승인했으며 그 이후로 4 개의 CAR-T 세포 요법 1,2,3,4,5를 추가로 승인했습니다. CAR은 일반적으로 종양 관련 항원 3,4에 특이적인 단일클론 항체의 단일 쇄 가변 단편으로 구성된 항원 인식 도메인을 갖는다. CAR이 종양 관련 항원과 상호 작용할 때 CAR-T 세포가 활성화되어 사이토카인 방출, 세포용해 탈과립, 전사 인자 발현 및 T 세포 증식을 포함하는 항종양 반응을 일으킵니다. CAR-T 세포를 생산하기 위해 환자로부터 혈액을 수집하여 T 세포를 얻습니다. CAR은 바이러스를 사용하여 환자의 T 세포에 유전적으로 추가됩니다. CAR-T 세포는 시험관 내에서 성장하여 환자 2,3,4,6에 다시 주입됩니다. CAR-T 세포의 성공적인 생성은 CAR-T 세포로 유전적으로 변형된 T 세포의 수를 설명하는 형질도입 효율에 의해 결정됩니다.
현재, CAR-T 세포 생성의 황금 표준은 레트로넥틴-코팅된 플레이트 7,8 상의 활성화된 T 세포 및 바이러스의 스핀코테이션이다. 형질 도입은 바이러스 입자가 T 세포의 표면과 결합 할 때 시작됩니다. Retronectin은 바이러스 입자와 세포 사이의 결합 효율을 증가시켜 바이러스와 세포의 공동 국소화를 촉진하고 형질 도입을 향상시킵니다 7,8. 레트로넥틴은 그 자체로는 잘 작동하지 않으며 바이러스 입자를 농축하고 T 세포의 표면 투과성을 증가시켜 바이러스 감염을 더 쉽게 허용함으로써 유전자 전달을 향상시키는 스피노 큘레이션을 동반해야합니다8. 레트로넥틴 코팅 플레이트에서 스피노클로테이션의 성공에도 불구하고 여러 번의 스핀 주기와 값비싼 시약이 필요한 복잡한 공정입니다. 따라서, 더 빠르고 저렴한 바이러스 유전자 전달을 위한 대체 방법이 매우 바람직하다.
알긴산염은 저렴한 비용, 우수한 안전성 프로파일 및 2가 양이온 9,10,11,12와 혼합시 하이드로 겔을 형성하는 능력으로 인해 생물 의학 산업에서 광범위하게 사용되는 천연 음이온 성 다당류입니다. 알긴산은 GMP 준수 폴리머이며 일반적으로 FDA13에 의해 안전 (GRAS)으로 인정됩니다. 양이온과 알긴산염을 가교하면 상처 치유, 작은 화학 약물 및 단백질의 전달, 세포 수송 9,10,11,12,14,15,16에 자주 사용되는 안정적인 하이드로겔이 생성됩니다. 우수한 겔화 특성으로 인해 알긴산염은동결 건조 10,17에 의해 다공성 스캐폴드를 생성하는 데 선호되는 물질입니다. 알긴산염의 이러한 특성은 활성화된 세포의 바이러스 유전자 전달을 매개할 수 있는 스캐폴드를 생산하기 위한 매력적인 후보가 된다.
여기에 설명된 것은 바이러스 유전자 전달에 의해 T 세포를 정적으로 형질도입하는 Drydux 스캐폴드로 알려진 건식 거대다공성 알기네이트 스캐폴드를 제조하기 위한 프로토콜이다(17,18). 이러한 스캐폴드를 만드는 과정은 그림 1에 나와 있습니다. 이러한 스캐폴드는 레트로넥틴 코팅 플레이트의 스핀코클로케이션의 필요성을 제거합니다. 거대다공성 알기네이트 스캐폴드는 바이러스 입자와 T 세포의 상호작용을 촉진하여 조작된 T 세포(17)의 기능 및 생존성에 영향을 미치지 않으면서 단일 단계에서 효율적인 유전자 전달을 가능하게 한다. 올바르게 추적하면 이러한 거대 다공성 알지네이트 스캐폴드는 80% 이상의 형질도입 효율을 가지며, 이는 바이러스 형질도입 공정을 단순화하고 단축시킨다.
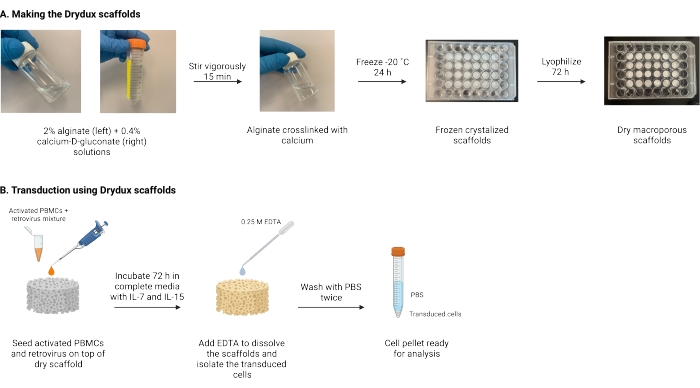
그림 1: 프로토콜의 개략도 및 타임라인. (a) 건식 거대 다공성 알긴산 스캐폴드를 제조하기 위한 타임라인. 알긴산염은 칼슘 -D- 글루코 네이트와 가교되어 밤새 동결됩니다. 동결된 스캐폴드는 72시간 동안 동결건조되어 Drydux 스캐폴드를 생성합니다. (B) 활성화된 세포의 바이러스 형질도입을 위한 타임라인. 활성화된 세포 및 바이러스 (MOI2)를 스캐폴드 상부에 시딩하고, IL-7 및 IL-15가 보충된 완전한 배지에서 인큐베이션한다. 스캐폴드는 혼합물을 흡수하고 바이러스 유전자 전달을 촉진합니다. EDTA는 스캐폴드를 용해시키고 형질도입된 세포를 분리하는데 사용된다. PBS로 2회 세척한 후, 세포 펠렛을 분석에 사용할 수 있다. 약어: PBS = 인산염 완충 식염수; PBMC = 말초 혈액 단핵 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
CAR-T 세포 요법은 연구 및 상업적 응용 분야에서 계속해서 관심을 얻고 있습니다. CAR-T 세포 요법이 혈액 암 치료에 성공했음에도 불구하고 절차의 높은 비용으로 인해 사용이 제한됩니다. 여기에 제시된 프로토콜은 레트로넥틴 코팅 플레이트의 스피노클로케이션 없이 T 세포의 바이러스 유전자 전달을 위한 새로운 방법을 소개합니다. 형질도입을 매개하기 위한 건식 거대다공성 알기네이트 스캐?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작업은 보조금 수여 번호 R37-CA260223, R21CA246414를 통해 국립 보건원의 지원을 받았습니다. 유세포분석 분석에 대한 교육 및 지침에 대해 NCSU 유세포분석 코어에 감사드립니다. 회로도는 Biorender.com 사용하여 생성되었습니다.
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

