Fremstilling og anvendelse af tørre makroporøse alginatstilladser til viral transduktion af T-celler
Summary
Heri er en protokol til oprettelse af tørre makroporøse alginatstilladser, der formidler effektiv viral genoverførsel til brug i genteknologi af T-celler, herunder T-celler til CAR-T-celleterapi. Stilladserne viste sig at transducere aktiverede primære T-celler med >85% transduktion.
Abstract
Genteknologi af T-celler til CAR-T-celleterapi er kommet i spidsen for kræftbehandling i løbet af de sidste par år. CAR-T-celler produceres ved viral genoverførsel til T-celler. Den nuværende guldstandard for viral genoverførsel involverer spinokulation af retronectinbelagte plader, hvilket er dyrt og tidskrævende. Der er et betydeligt behov for effektive og omkostningseffektive metoder til at generere CAR-T-celler. Beskrevet her er en metode til fremstilling af billige, tørre makroporøse alginatstilladser, kendt som Drydux-stilladser, der effektivt fremmer viral transduktion af aktiverede T-celler. Stilladserne er designet til at blive brugt i stedet for guldstandard spinokulation af retronectinbelagte plader podet med virus og forenkle processen til transducering af celler. Alginat er tværbundet med calcium-D-gluconat og frosset natten over for at skabe stilladserne. De frosne stilladser frysetørres i en frysetørrer i 72 timer for at fuldføre dannelsen af de tørre makroporøse stilladser. Stilladserne formidler viral genoverførsel, når virus og aktiverede T-celler podes sammen oven på stilladset for at producere genetisk modificerede celler. Stilladserne producerer >85% primær T-celletransduktion, hvilket kan sammenlignes med transduktionseffektiviteten af spinokulation på retronectinbelagte plader. Disse resultater viser, at tørre makroporøse alginatstilladser tjener som et billigere og mere bekvemt alternativ til den konventionelle transduktionsmetode.
Introduction
Immunterapi er opstået som et revolutionerende kræftbehandlingsparadigme på grund af dets evne til specifikt at målrette tumorer, begrænse off-target cytotoksicitet og forhindre tilbagefald. Især har kimær antigenreceptor T (CAR-T) celleterapi vundet popularitet på grund af dens succes med behandling af lymfomer og leukæmier. FDA godkendte den første CAR-T-celleterapi i 2017 og har siden da godkendt yderligere fire CAR-T-celleterapier 1,2,3,4,5. CAR’er har et antigengenkendelsesdomæne, der normalt består af et enkelt kædevariabelt fragment af et monoklonalt antistof, der er specifikt for et tumorassocieret antigen 3,4. Når en CAR interagerer med sit tumorassocierede antigen, aktiveres CAR-T-cellerne, hvilket fører til et antitumorrespons, der involverer cytokinfrigivelse, cytolytisk degranulering, transkriptionsfaktorekspression og T-celleproliferation. For at producere CAR-T-celler opsamles blod fra patienten for at få deres T-celler. CAR’er tilsættes genetisk til patientens T-celler ved hjælp af en virus. CAR-T-cellerne dyrkes in vitro og infunderes tilbage i patienten 2,3,4,6. Vellykket generering af CAR-T-celler bestemmes af transduktionseffektiviteten, som beskriver antallet af T-celler, der er genetisk modificeret til CAR-T-celler.
I øjeblikket er guldstandarden for CAR-T-cellegenerering spinokulation af aktiverede T-celler og virus på retronectinbelagte plader 7,8. Transduktion begynder, når virale partikler går i indgreb med overfladen af T-cellerne. Retronectin fremmer colokalisering af virus og celler ved at øge bindingseffektiviteten mellem de virale partikler og cellerne, hvilket forbedrer transduktion 7,8. Retronectin fungerer ikke godt alene og skal ledsages af spinokulation, som forbedrer genoverførslen ved at koncentrere de virale partikler og øge T-cellens overfladepermeabilitet, hvilket giver mulighed for lettere virusinfektion8. På trods af succesen med spinokulation på retronectinbelagte plader er det en kompleks proces, der kræver flere spincyklusser og dyre reagenser. Derfor er alternative metoder til viral genoverførsel, der er hurtigere og billigere, meget ønskelige.
Alginat er et naturligt anionisk polysaccharid, der i vid udstrækning anvendes i den biomedicinske industri på grund af dets lave omkostninger, gode sikkerhedsprofil og evne til at danne hydrogeler ved blanding med divalente kationer 9,10,11,12. Alginat er en GMP-kompatibel polymer og er generelt anerkendt som sikker (GRAS) af FDA13. Tværbinding af alginat med kationer skaber stabile hydrogeler, der ofte bruges til sårheling, levering af små kemiske lægemidler og proteiner og celletransport 9,10,11,12,14,15,16. På grund af dets fremragende geleringsegenskaber er alginat det foretrukne materiale til at skabe porøse stilladser ved frysetørring10,17. Disse egenskaber ved alginat gør det til en attraktiv kandidat til fremstilling af et stillads, der kan formidle viral genoverførsel af aktiverede celler.
Beskrevet her er en protokol til fremstilling af tørre makroporøse alginatstilladser, kendt som Drydux-stilladser, der statisk transducerer T-celler ved viral genoverførsel17,18. Processen til fremstilling af disse stilladser er vist i figur 1. Disse stilladser eliminerer behovet for spinokulation af retronectinbelagte plader. De makroporøse alginatstilladser tilskynder til interaktion mellem virale partikler og T-celler for at muliggøre effektiv genoverførsel i et enkelt trin uden at påvirke funktionaliteten og levedygtigheden af de konstruerede T-celler17. Når de følges korrekt, har disse makroporøse alginatstilladser en transduktionseffektivitet på mindst 80%, hvilket forenkler og forkorter den virale transduktionsproces.
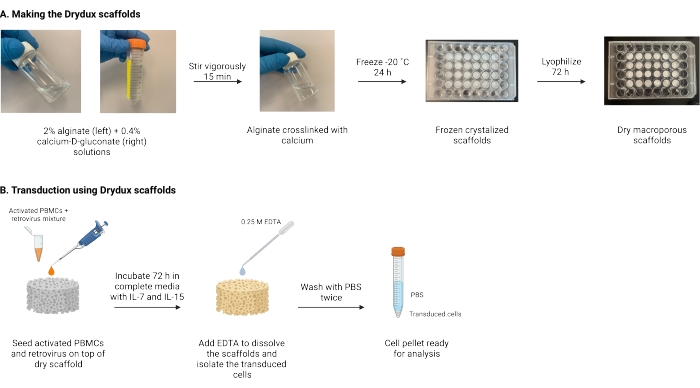
Figur 1: Skematisk og tidslinje for protokollen . (A) Tidslinje for fremstilling af de tørre makroporøse alginatstilladser. Alginat er tværbundet med calcium-D-gluconat og frosset natten over. De frosne stilladser fryses i 72 timer for at skabe Drydux-stilladserne. (B) Tidslinje for viral transduktion af aktiverede celler. Aktiverede celler og virus (MOI 2) podes oven på stilladset og inkuberes i komplette medier suppleret med IL-7 og IL-15. Stilladserne absorberer blandingen og fremmer viral genoverførsel. EDTA bruges til at opløse stilladserne og isolere de transducerede celler. Efter vask to gange med PBS kan cellepelleten bruges til analyse. Forkortelser: PBS = fosfatbufferet saltvand; PBMC’er = mononukleære celler i perifert blod. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
CAR-T-celleterapi fortsætter med at få interesse for både forskning og kommercielle anvendelser. På trods af den succes, CAR-T-celleterapi har haft med at behandle blodkræft, begrænser de høje omkostninger ved proceduren dens anvendelse. Protokollen, der præsenteres her, introducerer en ny metode til viral genoverførsel af T-celler uden behov for spinokulation af retronectinbelagte plader. Fremstilling af tørre makroporøse alginatstilladser til mediering af transduktion er relativt enkel og er en passende bill…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af National Institutes of Health gennem Grant Award Numbers R37-CA260223, R21CA246414. Vi takker NCSU-flowcytometrikernen for træning og vejledning i flowcytometrianalyse. Skemaer blev oprettet med Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

