创建膝关节芯片,用于关节疾病建模和药物测试
Summary
我们提供了从人间充质干细胞生成四种类型的组织的详细方法,这些组织用于概括人膝关节中的软骨、骨骼、脂肪垫和滑膜。这四个组织被集成到一个定制的生物反应器中,并通过微流体连接,从而产生一个膝关节芯片。
Abstract
骨关节炎(OA)等使人衰弱的关节疾病的高患病率构成了很高的社会经济负担。目前,针对关节疾病的可用药物大多是姑息性的。对有效的疾病修饰OA药物(DMOADs)的需求未得到满足,主要是由于缺乏适当的模型来研究疾病机制和测试潜在的DMOADs。在这里,我们描述了一个微型滑膜关节模拟微生理系统(miniJoint)的建立,该系统包括来自人间充质干细胞(MSCs)的脂肪,纤维和骨软骨组织成分。为了获得三维(3D)微组织,在分化之前或之后将MSCs包封在可光交联的甲基丙烯酸化明胶中。然后将充满细胞的组织结构整合到3D打印的生物反应器中,形成miniJoint。引入单独的成骨、纤维化和成脂培养基流以维持各自的组织表型。通过软骨、滑膜和脂肪组织灌注常见的共享流,以实现组织串扰。这种流动模式允许在一个或多个组织成分中诱导扰动以进行机理研究。此外,可以通过所有培养基流的“全身给药”或通过仅将药物添加到共享的“滑液”模拟流中的“关节内给药” 来 测试潜在的DMOAD。因此,miniJoint可以作为一个多功能 的体外 平台,用于有效研究疾病机制和测试个性化医疗中的药物。
Introduction
骨关节炎 (OA) 等关节疾病非常普遍且使人衰弱,是全球残疾的主要原因1。据估计,仅在美国,OA就影响了2700万患者,12.1%的60岁及以上成年人2。不幸的是,目前用于治疗关节疾病的大多数药物都是姑息性的,并且没有有效的疾病改善OA药物(DMOADs)可用3。这种未满足的医疗需求主要源于缺乏研究疾病机制和开发潜在DMOAD的有效模型。传统的二维(2D)细胞培养不能反映关节组织的3D性质,并且组织外植体的培养经常受到显着细胞死亡的阻碍,并且通常无法复制动态组织互连4。此外,遗传和解剖学差异显着降低了动物模型的生理相关性4。
器官芯片(OoCs)或微生理系统是工程,生物学和医学界面的一个有前途的研究领域。这些 体外 平台是最小的功能单位,可复制其 体内 对应物的定义健康或病理特征5。此外,这些小型化系统可以容纳不同的细胞和基质,并模拟不同组织之间的生物物理和生化相互作用。因此,能够忠实地概括天然滑膜关节的微生理系统有望为关节疾病建模和开发潜在的DMOAD提供有效的平台。
人间充质干细胞(MSCs)可以从全身的许多组织中分离出来,并分化为成骨、软骨和成脂谱系6。间充质干细胞已成功用于设计各种组织,包括骨骼,软骨和脂肪组织6,这意味着它们代表了设计膝关节组织成分的有前途的细胞来源。我们最近开发了一种微型关节模拟微生理系统,名为miniJoint,包括MSC衍生的骨骼,软骨,纤维和脂肪组织7。特别是,新颖的设计可以通过微流体流动或渗透实现组织串扰(图1)。在这里,我们提出了芯片组件的制造,组织组件的工程,芯片中工程组织的培养以及用于下游分析的组织收集的协议。
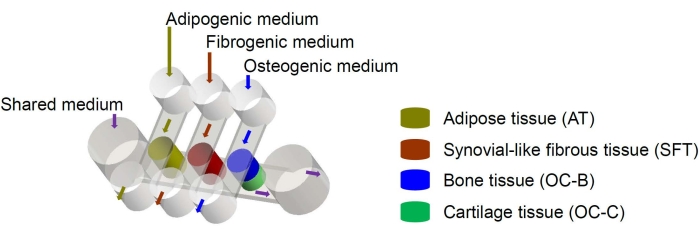
图 1:miniJoint 芯片示意图,显示了不同组织组件和介质流的排列。 OC = 骨软骨组织。 请点击此处查看此图的大图。
Protocol
Representative Results
Discussion
在本文中,我们提出了一种用于创建膝关节芯片系统的协议,其中骨骼,软骨,脂肪组织和滑膜样组织由MSC形成并在定制的生物反应器中共同培养。这种具有即插即用功能的多组分人类细胞衍生系统是研究关节疾病发病机制和开发药物的新工具。
鉴于不同的组织有利于特定的培养基,因此为每个组织提供相应的培养基并防止流动之间的自由培养基交换至关重要。特别是,在?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项研究主要由美国国立卫生研究院(UG3 / UH3TR002136,UG3 / UH3TR003090)资助。此外,我们感谢Paul Manner博士(华盛顿大学)提供人体组织样本,感谢Jian Tan博士帮助分离MSCs和创建细胞池。
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

