Creación de una articulación de rodilla en un chip para modelar enfermedades articulares y probar medicamentos
Summary
Proporcionamos métodos detallados para generar cuatro tipos de tejidos a partir de células madre mesenquimales humanas, que se utilizan para recapitular el cartílago, el hueso, la almohadilla de grasa y la membrana sinovial en la articulación de la rodilla humana. Estos cuatro tejidos se integran en un biorreactor personalizado y se conectan a través de microfluídica, generando así una articulación de rodilla en un chip.
Abstract
La alta prevalencia de enfermedades articulares debilitantes como la osteoartritis (OA) plantea una alta carga socioeconómica. Actualmente, los medicamentos disponibles que se dirigen a los trastornos articulares son en su mayoría paliativos. La necesidad insatisfecha de fármacos eficaces modificadores de la enfermedad (DMOAD) ha sido causada principalmente por la ausencia de modelos apropiados para estudiar los mecanismos de la enfermedad y probar los DMOAD potenciales. Aquí, describimos el establecimiento de un sistema microfisiológico en miniatura que imita la articulación sinovial (miniJoint) que comprende componentes de tejido adiposo, fibroso y osteocondral derivados de células madre mesenquimales humanas (MSC). Para obtener los microtejidos tridimensionales (3D), las MSC se encapsularon en gelatina metacrilatada fotoreticulable antes o después de la diferenciación. Las construcciones de tejido cargadas de células se integraron en un biorreactor impreso en 3D, formando el miniJoint. Se introdujeron flujos separados de medios osteogénicos, fibrogénicos y adipogénicos para mantener los fenotipos tisulares respectivos. Se perfundió una corriente comúnmente compartida a través del cartílago, los tejidos sinoviales y adiposos para permitir la diafonía del tejido. Este patrón de flujo permite la inducción de perturbaciones en uno o más de los componentes del tejido para estudios mecanicistas. Además, los DMOAD potenciales pueden probarse a través de la “administración sistémica” a través de todos los flujos del medio o la “administración intraarticular” agregando los medicamentos solo al flujo compartido de simulación de “líquido sinovial”. Por lo tanto, el miniJoint puede servir como una plataforma in vitro versátil para estudiar de manera eficiente los mecanismos de la enfermedad y probar medicamentos en medicina personalizada.
Introduction
Las enfermedades articulares como la osteoartritis (OA) son altamente prevalentes y debilitantes y representan una de las principales causas de discapacidad en todo el mundo1. Se estima que solo en los Estados Unidos, la OA afecta a 27 millones de pacientes y ocurre en el 12.1% de los adultos de 60 años o más de2. Desafortunadamente, la mayoría de los medicamentos utilizados actualmente para controlar las enfermedades articulares son paliativos, y no hay medicamentos eficaces modificadores de la enfermedad (DMOA) disponibles3. Esta necesidad médica no satisfecha se deriva principalmente de la ausencia de un modelo eficaz para estudiar los mecanismos de la enfermedad y desarrollar posibles DMOAD. El cultivo celular bidimensional convencional (2D) no refleja la naturaleza 3D de los tejidos articulares, y el cultivo de explantes tisulares a menudo se ve obstaculizado por una muerte celular significativa y generalmente no logra replicar las interconexiones tisulares dinámicas4. Además, las diferencias genéticas y anatómicas reducen significativamente la relevancia fisiológica de los modelos animales4.
Los órganos en chips (OoC), o sistemas microfisiológicos, son un campo de investigación prometedor en la interfaz de la ingeniería, la biología y la medicina. Estas plataformas in vitro son unidades funcionales mínimas que replican características sanas o patológicas definidas de sus contrapartes in vivo 5. Además, estos sistemas miniaturizados pueden albergar diversas células y matrices y simular las interacciones biofísicas y bioquímicas entre diferentes tejidos. Por lo tanto, un sistema microfisiológico que pueda recapitular fielmente la articulación sinovial nativa promete ofrecer una plataforma efectiva para modelar enfermedades articulares y desarrollar posibles DMOAD.
Las células madre mesenquimales humanas (MSC) pueden aislarse de muchos tejidos en todo el cuerpo y diferenciarse en linajes osteogénicos, condrogénicos y adipogénicos6. Las MSC se han utilizado con éxito para diseñar diversos tejidos, incluidos el hueso, el cartílago y el tejido adiposo6, lo que significa que representan una fuente celular prometedora para la ingeniería de los componentes tisulares de la articulación de la rodilla. Recientemente desarrollamos un sistema microfisiológico en miniatura que imita las articulaciones, llamado miniJoint, que comprende hueso, cartílago, fibroso y tejido adiposo derivado de MSC7. En particular, el novedoso diseño permite la diafonía del tejido por flujo microfluídico o permeación (Figura 1). Aquí, presentamos los protocolos para la fabricación de los componentes del chip, la ingeniería de los componentes del tejido, el cultivo de los tejidos diseñados en el chip y la colección de tejidos para análisis posteriores.
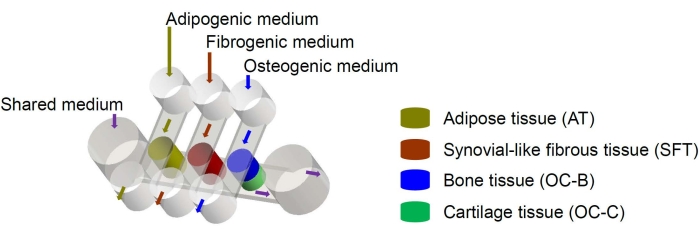
Figura 1: Esquema del chip miniJoint que muestra la disposición de los diferentes componentes tisulares y flujos del medio. OC = tejido osteocondral. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
En este artículo, presentamos un protocolo para crear un sistema de articulación de rodilla en un chip, en el que el hueso, el cartílago, el tejido adiposo y los tejidos similares a la membrana sinovial se forman a partir de MSC y se cocultivan dentro de un biorreactor personalizado. Este sistema multicomponente derivado de células humanas con características plug-and-play representa una nueva herramienta para estudiar la patogénesis de las enfermedades articulares y desarrollar fármacos.
<p class="jove_conte…Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue apoyada principalmente por fondos de los Institutos Nacionales de Salud (UG3 / UH3TR002136, UG3 / UH3TR003090). Además, agradecemos al Dr. Paul Manner (Universidad de Washington) por proporcionar las muestras de tejido humano y al Dr. Jian Tan por su ayuda para aislar las MSC y crear el grupo celular.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

