Opprettelse av et kneledd på en brikke for modellering av leddsykdommer og testing av medisiner
Summary
Vi tilbyr detaljerte metoder for å generere fire typer vev fra humane mesenkymale stamceller, som brukes til å rekapitulere brusk, bein, fettpute og synovium i det menneskelige kneleddet. Disse fire vevene er integrert i en tilpasset bioreaktor og koblet sammen gjennom mikrofluidikk, og genererer dermed et kneledd på en brikke.
Abstract
Den høye forekomsten av invalidiserende leddsykdommer som slitasjegikt (OA) utgjør en høy sosioøkonomisk belastning. For tiden er de tilgjengelige legemidlene som retter seg mot leddforstyrrelser for det meste palliative. Det udekkede behovet for effektive sykdomsmodifiserende OA-legemidler (DMOAD) har først og fremst vært forårsaket av fravær av egnede modeller for å studere sykdomsmekanismer og teste potensielle DMOADer. Her beskriver vi etableringen av et miniatyr synovialt leddlignende mikrofysiologisk system (miniJoint) som består av fett-, fibrøse og osteokondrale vevskomponenter avledet fra humane mesenkymale stamceller (MSC). For å oppnå de tredimensjonale (3D) mikrovevene ble MSC innkapslet i fotokryssbindbar metakryrylert gelatin før eller etter differensiering. De cellebelastede vevskonstruksjonene ble deretter integrert i en 3D-printet bioreaktor, som danner miniJoint. Separate strømmer av osteogene, fibrogene og adipogene medier ble introdusert for å opprettholde de respektive vevsfenotypene. En vanlig delt strøm ble perfusert gjennom brusk, synovial og fettvev for å muliggjøre vevskrysstale. Dette strømningsmønsteret tillater induksjon av forstyrrelser i en eller flere av vevskomponentene for mekanistiske studier. Videre kan potensielle DMOADer testes via enten “systemisk administrasjon” gjennom alle mediumstrømmene eller “intraartikulær administrasjon” ved å legge legemidlene til bare den delte “synovialvæsken” -simulerende strømning. Dermed kan miniJoint fungere som en allsidig in vitro-plattform for effektiv studier av sykdomsmekanismer og testing av legemidler i persontilpasset medisin.
Introduction
Leddsykdommer som slitasjegikt (OA) er svært utbredt og ødeleggende og representerer en ledende årsak til funksjonshemming over hele verden1. Det er anslått at i USA alene påvirker OA 27 millioner pasienter og forekommer hos 12.1% av voksne i alderen 60 og over2. Dessverre er de fleste legemidler som for tiden brukes til å håndtere leddsykdommer, palliative, og ingen effektive sykdomsmodifiserende OA-legemidler (DMOAD) er tilgjengelige3. Dette udekkede medisinske behovet stammer først og fremst fra fraværet av en effektiv modell for å studere sykdomsmekanismer og utvikle potensielle DMOADer. Den konvensjonelle todimensjonale (2D) cellekulturen reflekterer ikke 3D-naturen til leddvev, og kulturen av vevseksplanter hindres ofte av betydelig celledød og klarer vanligvis ikke å replikere de dynamiske vevsforbindelsene4. I tillegg reduserer genetiske og anatomiske forskjeller signifikant den fysiologiske relevansen av dyremodeller4.
Organs-on-chips (OoC), eller mikrofysiologiske systemer, er et lovende forskningsfelt i grensesnittet mellom ingeniørfag, biologi og medisin. Disse in vitro-plattformene er minimale funksjonelle enheter som replikerer definerte sunne eller patologiske trekk ved deres in vivo-kolleger 5. Videre kan disse miniatyriserte systemene være vert for forskjellige celler og matriser og simulere de biofysiske og biokjemiske interaksjonene mellom forskjellige vev. Derfor lover et mikrofysiologisk system som trofast kan rekapitulere det opprinnelige synovialleddet å tilby en effektiv plattform for modellering av leddsykdommer og utvikling av potensielle DMOADer.
Humane mesenkymale stamceller (MSC) kan isoleres fra mange vev i hele kroppen og differensieres i osteogene, kondrogene og adipogene linjer6. MSC har blitt brukt til å konstruere forskjellige vev, inkludert bein, brusk og fettvev6, noe som betyr at de representerer en lovende cellekilde for engineering av vevskomponentene i kneleddet. Vi har nylig utviklet et miniatyrleddlignende mikrofysiologisk system, kalt miniJoint, som består av MSC-avledet bein, brusk, fibrøst og fettvev7. Spesielt muliggjør den nye designen vevskrysstale ved mikrofluidisk strømning eller permeasjon (figur 1). Her presenterer vi protokollene for fremstilling av brikkekomponentene, konstruksjonen av vevskomponentene, kulturen til det konstruerte vevet i brikken og samlingen av vev for nedstrømsanalyser.
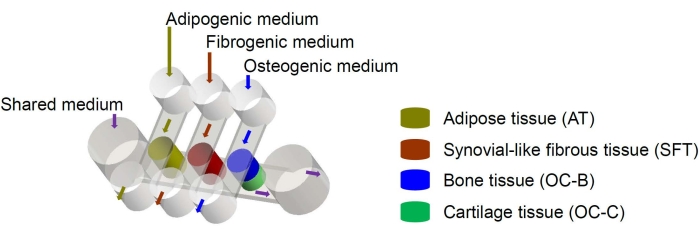
Figur 1: Skjematisk fremstilling av miniJoin-brikken som viser arrangementet av de forskjellige vevskomponentene og mediumstrømmene. OC = osteokondralt vev. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
I denne artikkelen presenterer vi en protokoll for å lage et kneledd-on-a-chip-system, hvor bein, brusk, fettvev og synoviumlignende vev dannes fra MSC og dyrkes sammen i en tilpasset bioreaktor. Dette multikomponent, humane celleavledede systemet med plug-and-play-funksjoner representerer et nytt verktøy for å studere patogenesen av leddsykdommer og utvikle medisiner.
Gitt at forskjellige vev favoriserer spesifikke kulturmedier, er det avgjørende å gi det respektive mediet for hvert vev…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne forskningen ble primært støttet av finansiering fra National Institutes of Health (UG3 / UH3TR002136, UG3 / UH3TR003090). I tillegg takker vi Dr. Paul Manner (University of Washington) for å gi de menneskelige vevsprøvene og Dr. Jian Tan for deres hjelp med å isolere MSCene og skape cellebassenget.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

