Criação de uma articulação do joelho em um chip para modelagem de doenças articulares e testes de medicamentos
Summary
Fornecemos métodos detalhados para gerar quatro tipos de tecidos a partir de células-tronco mesenquimais humanas, que são usadas para recapitular a cartilagem, osso, coxim gorduroso e sinóvia na articulação do joelho humano. Esses quatro tecidos são integrados em um biorreator personalizado e conectados através de microfluídica, gerando assim uma articulação do joelho em um chip.
Abstract
A alta prevalência de doenças articulares debilitantes como a osteoartrite (OA) representa um alto ônus socioeconômico. Atualmente, as drogas disponíveis que têm como alvo as desordens articulares são, em sua maioria, paliativas. A necessidade não atendida de drogas modificadoras de doença (DMOADs) eficazes tem sido causada principalmente pela ausência de modelos apropriados para estudar os mecanismos da doença e testar potenciais DMOADs. Neste trabalho, descrevemos o estabelecimento de um sistema microfisiológico mini-sinovial que mimetiza a articulação sinovial (miniJoint) composto por componentes do tecido adiposo, fibroso e osteocondral derivados de células-tronco mesenquimais humanas (CTMs). Para a obtenção dos microtecidos tridimensionais (3D), as CTMs foram encapsuladas em gelatina metacrilada fotoreticulável antes ou após a diferenciação. As construções de tecido carregadas de células foram então integradas em um biorreator impresso em 3D, formando a miniJoint. Fluxos separados de meios osteogênicos, fibrogênicos e adipogênicos foram introduzidos para manter os respectivos fenótipos teciduais. Um fluxo comumente compartilhado foi perfundido através da cartilagem, sinovial e tecido adiposo para permitir o crosstalk tecidual. Este padrão de fluxo permite a indução de perturbações em um ou mais dos componentes teciduais para estudos mecanísticos. Além disso, potenciais DMOADs podem ser testados através de “administração sistêmica” através de todos os fluxos de meio ou “administração intra-articular” adicionando os medicamentos apenas ao fluxo compartilhado de simulador de “líquido sinovial”. Assim, o miniJoint pode servir como uma plataforma in vitro versátil para estudar eficientemente os mecanismos de doenças e testar drogas em medicina personalizada.
Introduction
Doenças articulares como a osteoartrite (OA) são altamente prevalentes e debilitantes e representam uma das principais causas de incapacidade em todo omundo1. Estima-se que, somente nos EUA, a OA afete 27 milhões de pacientes e ocorra em 12,1% dos adultos com 60 anos oumais2. Infelizmente, a maioria dos medicamentos atualmente utilizados para o manejo de doenças articulares é paliativa, e não há drogas modificadoras de doença (DMOADs) eficazes3. Essa necessidade médica não atendida decorre principalmente da ausência de um modelo eficaz para estudar os mecanismos da doença e desenvolver potenciais DMOADs. A cultura celular bidimensional (2D) convencional não reflete a natureza 3D dos tecidos articulares, e a cultura de explantes teciduais é frequentemente dificultada por morte celular significativa e geralmente falha em replicar as interconexões teciduais dinâmicas4. Além disso, diferenças genéticas e anatômicas reduzem significativamente a relevância fisiológica de modelos animais4.
Organs-on-chips (OoCs), ou sistemas microfisiológicos, são um campo de pesquisa promissor na interface da engenharia, biologia e medicina. Essas plataformas in vitro são unidades funcionais mínimas que replicam características saudáveis ou patológicas definidas de suas contrapartes in vivo 5. Além disso, esses sistemas miniaturizados podem hospedar diversas células e matrizes e simular as interações biofísicas e bioquímicas entre diferentes tecidos. Portanto, um sistema microfisiológico que possa recapitular fielmente a articulação sinovial nativa promete oferecer uma plataforma eficaz para modelar doenças articulares e desenvolver potenciais DMOADs.
As células-tronco mesenquimais humanas (CTMs) podem ser isoladas de vários tecidos do corpo e diferenciadas em linhagens osteogênicas, condrogênicas e adipogênicas6. As CTMs têm sido usadas com sucesso para a engenharia de vários tecidos, incluindo osso, cartilagem e tecido adiposo6, o que significa que representam uma fonte celular promissora para a engenharia dos componentes teciduais da articulação do joelho. Recentemente, desenvolvemos um sistema microfisiológico que mimetiza uma articulação em miniatura, denominado miniJoint, que compreende os tecidos ósseo, cartilaginoso, fibroso e adiposo derivados dasCTMs7. Em particular, o novo design permite crosstalk tecidual por fluxo microfluídico ou permeação (Figura 1). Aqui, apresentamos os protocolos para a fabricação dos componentes do chip, a engenharia dos componentes do tecido, a cultura dos tecidos projetados no chip e a coleta de tecidos para análises a jusante.
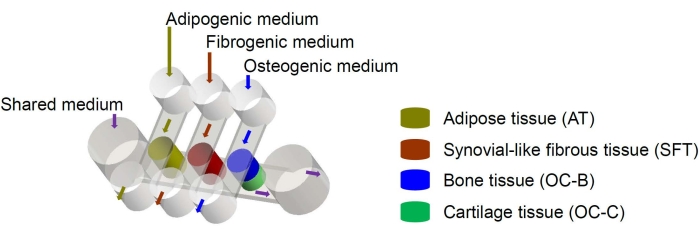
Figura 1: Esquema do chip miniJoint mostrando a disposição dos diferentes componentes do tecido e fluxos médios. CO = tecido osteocondral. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Neste artigo, apresentamos um protocolo para a criação de um sistema de articulação do joelho em um chip, no qual osso, cartilagem, tecido adiposo e tecidos semelhantes à sinóvia são formados a partir de CTMs e co-cultivados dentro de um biorreator personalizado. Este sistema multicomponente, derivado de células humanas com características plug-and-play, representa uma nova ferramenta para estudar a patogênese de doenças articulares e desenvolver drogas.
Como diferentes tecidos fav…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi apoiada principalmente por financiamento do National Institutes of Health (UG3/UH3TR002136, UG3/UH3TR003090). Além disso, agradecemos ao Dr. Paul Manner (Universidade de Washington) por fornecer as amostras de tecido humano e ao Dr. Jian Tan por sua ajuda no isolamento das CTMs e na criação do pool de células.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

