Hücre Dışı Vezikül Alt Kümelerinin Analizi için Çok Katlı Yüzey Plazmon Rezonans Görüntüleme Çipi Üzerinde Multimodal Analitik Platform
Summary
Bu makale, hücre dışı vezikül alt kümelerinin karakterizasyonu için artan verime sahip yeni nesil multiparametrik analitik platformlar önermektedir. Yöntem, bir mikroarray biyoçipinde sıkışmış veziküler hedefleri nitelemek için Raman spektroskopisi ile birleştiğinde, atomik kuvvet mikroskobu ile metrolojik ve morfomekanik analizlerle çoklanmış biyosensing yöntemlerinin bir kombinasyonuna dayanmaktadır.
Abstract
Hücre dışı veziküller (EV’ler), çapı 50 ila birkaç yüz nanometre arasında değişen tüm hücreler tarafından üretilen ve hücreler arası iletişim aracı olarak kullanılan membran türevli, küçük veziküllerdir. Çeşitli hastalıklar için umut verici tanı ve tedavi araçları olarak ortaya çıkmaktadırlar. Hücreler tarafından boyut, kompozisyon ve içerik farklılıkları olan EV’ler üretmek için kullanılan iki ana biyogenez işlemi vardır. Boyut, bileşim ve hücre kökenindeki yüksek karmaşıklıkları nedeniyle, karakterizasyonları analitik tekniklerin bir kombinasyonunu gerektirir. Bu proje, EV’lerin alt popülasyonlarının karakterizasyonu için artan verime sahip yeni nesil multiparametrik analitik platformların geliştirilmesini içermektedir. Bu amaca ulaşmak için çalışma, grup tarafından kurulan nanobiyoanalitik platformdan (NBA) başlar ve bu, bir mikroarray biyoçip üzerinde sıkışmış veziküler hedeflerin atomik kuvvet mikroskobu (AFM) ile metrolojik ve morfomekanik analizlerle çoklanmış biyosensing yöntemlerinin bir kombinasyonuna dayanan EV’lerin orijinal bir araştırmasına izin verir. Amaç, bu EV araştırmasını Raman spektroskopisi ile fenotipik ve moleküler bir analizle tamamlamaktı. Bu gelişmeler, klinik potansiyele sahip biyolojik sıvılardaki EV alt kümelerinin ayırt edilmesi için çok modlu ve kullanımı kolay bir analitik çözümün önerilmesini mümkün kılmaktadır.
Introduction
Tanı ve terapötiklerde EV araştırmalarına artan ilgi 1,2,3,4,5, bu alanın karşılaştığı zorluklarla birleştiğinde, bu veziküllerin ölçülmesi veya karakterize edilmesi için çok çeşitli yaklaşım ve tekniklerin geliştirilmesi ve uygulanmasıyla sonuçlanmıştır. EV tanımlaması için en yaygın kullanılan yöntemler, EV’lerin kökenini doğrulamak için proteine özgü immünoblotlama ve proteomikler, yapılarını doğrulamak için iletim elektron mikroskobu (TEM) ve bir numune hacmindeki sayı ve boyut dağılımlarını ölçmek için nanopartikül izleme analizidir (NTA).
Bununla birlikte, bu tekniklerin hiçbiri kendi başlarına EV alt kümelerini karakterize etmek için gereken tüm bilgileri vermez. EV’lerin biyokimyasal ve fiziksel özelliklerindeki çeşitlilik nedeniyle doğal heterojenliği, özellikle bir karışımda (ham numune) bulunan EV’ler için güvenilir ve tekrarlanabilir küresel analizleri engellemektedir. Bu nedenle, tespit ve karakterizasyon yöntemleri, EV’ler için hem bireysel hem de genel olarak daha hızlı olan ancak seçici olmayan diğer yöntemleri tamamlamak için gereklidir6.
TEM (veya kriyoTEM) veya AFM ile yüksek çözünürlüklü görüntüleme, nanometrik çözünürlük 7,8,9,10,11,12 olan EV’lerin morfolojisinin ve metrolojisinin belirlenmesini sağlar. Bununla birlikte, EV’ler gibi biyolojik nesneler için elektron mikroskobu kullanımının ana sınırlaması, numunenin sabitlenmesini ve dehidrasyonunu gerektiren çalışmayı yürütmek için bir vakuma duyulan ihtiyaçtır. Bu tür bir preparat, gözlemlenen yapılardan çözelti içi EV morfolojisine çevrilmesini zorlaştırır. Numunenin bu dehidrasyonunu önlemek için, kriyoTEM tekniği EV karakterizasyonu için en uygunolanıdır 13. EV’lerin ultrayapısını belirlemek için yaygın olarak kullanılır. Veziküllerin biyofonksiyonelleştirilmiş altın nanopartiküller tarafından immüno-etiketlenmesi, EV’lerin spesifik alt popülasyonlarını tanımlamayı ve bunları karmaşık bir biyolojik numunede bulunan diğer parçacıklardan ayırt etmeyi de mümkün kılar. Bununla birlikte, elektronik mikroskopi ile analiz edilen düşük sayıda EV’den dolayı, karmaşık ve heterojen bir numuneyi temsil eden bir karakterizasyonu gerçekleştirmek genellikle zordur.
Bu boyut heterojenliğini ortaya çıkarmak için, Uluslararası Hücre Dışı Veziküller Derneği (ISEV), yüksek çözünürlüklü14 olan bireysel EV’leri ortaya çıkarmak için daha küçük görüntülerle birlikte yeterli sayıda geniş alan görüntüsünün analiz edilmesini önermektedir. AFM, EV’lerin incelenmesi için optik yaklaşımlara ve elektronik kırınım tekniklerine bir alternatiftir. Bu teknik, bir destek üzerinde biriken numuneyi satır satır tarayan ve uç ile bir geri besleme döngüsü aracılığıyla mevcut elemanlar arasındaki mesafeyi ayarlayan esnek bir konsol tarafından tutulan keskin bir uç kullanır. Bu, numunenin topografyasını karakterize etmeyi ve morfomekanik bilgitoplamayı mümkün kılar 15,16,17,18. EV’ler, atomik olarak düz bir substrat üzerinde biriktirildikten sonra veya çeşitli alt popülasyonları karakterize etmek için antikorlar, peptitler veya aptamerler tarafından işlevselleştirilen belirli bir substrat üzerinde yakalandıktan sonra AFM tarafından taranabilir18,19. Ön arıtma, etiketleme veya dehidrasyona gerek kalmadan karmaşık biyolojik numunelerdeki EV’lerin yapısını, biyomekaniğini ve membranöz biyomoleküler içeriğini ölçme ve eşzamanlı olarak araştırma kabiliyeti nedeniyle, AFM artık EV’leri sıcaklık ve ortamın fizyolojik koşulları altında ince ve multiparametrik bir şekilde karakterize etmek için giderek daha fazla kullanılmaktadır.
Bu makale, çoklanmış bir formatta (biyo) kimyasal olarak işlevselleştirilebilen çekirdek bir altın biyoçip kullanan bir metodoloji önermektedir. Bu substrat, EV alt kümelerinin yüzey plazmon rezonansı ile biyo-tespitini birleştiren güçlü bir analitik platformun temel taşıdır ve EV’ler çip üzerinde adsorbe edildiğinde / aşılandığında veya immüno-yakalandığında, AFM, EV’lerin metrolojik ve morfomekanik karakterizasyonunu sağlar. Çip üzerinde yakalanan EV alt kümelerinin Raman imzası ile birleştiğinde, bu analitik platform, biyolojik numunelerde bulunan EV’lerin etiketsiz bir şekilde ve ön analitik adımlara gerek kalmadan kalifikasyonunu sağlar. Bu makale, substrat hazırlama ve veri toplamada son derece titiz bir metodoloji ile desteklenen güçlü tekniklerin kombinasyonunun, EV analizini derin, kesin ve sağlam hale getirdiğini göstermektedir.
Önerilen yaklaşımın prensibi, bir altın substrat hazırlamak, EV alt tiplerini adsorbe / greft veya yakalamak ve her bir EV alt kümesinin boyutunu ve morfolojisini tahmin etmek için bunları AFM ile taramaktır. Ek olarak, bu adsorbe edilen EV’ler Raman spektroskopisi ile analiz edilir. Bu substrat, aslında, artan karmaşıklığa sahip üç tür arayüz sunabilir: çıplak, kimyasal olarak işlevselleştirilmiş veya ligand mikrodizileri. Protokolün farklı adımlarını tanımlamadan önce, okuyucular, yüzey plazmon rezonans görüntüleme (SPRi), AFM ve spektroskopiyi birleştiren Şekil 1’deki nanobiyoanalitik platform (NBA) yaklaşımının şematik sunumuna atıfta bulunulur.
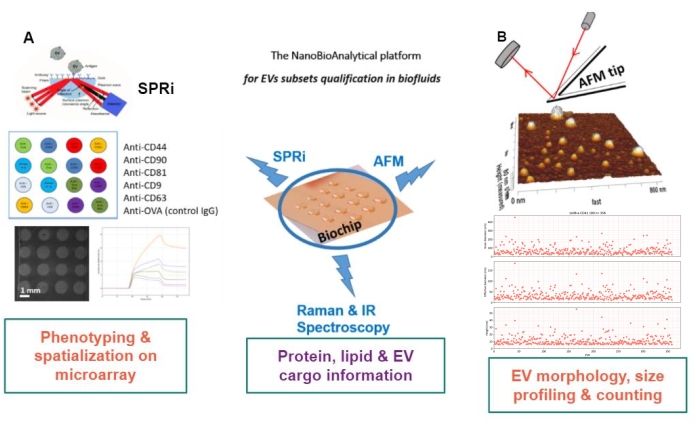
Resim 1: NanoBioAnalytical platformu. Yaklaşım, (A) yüzey plazmon rezonans görüntülemeyi, (B) atomik kuvvet mikroskobu ve kızılötesi / Raman (nano) spektroskopisini birleştirir, hepsi aynı substrat üzerinde çalışır – çoklanmış bir altın çip. Kısaltmalar: NBA = NanoBioAnalytical platform; SPRi = yüzey plazmon rezonans görüntüleme; AFM = atomik kuvvet mikroskobu; EV = hücre dışı vezikül. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Çekirdek altın biyoçip, platformun kalbini oluşturur, çünkü tüm etiketsiz karakterizasyon teknikleri bu biyoçip üzerinde gerçekleştirilir. EV karakterizasyonunun ihtiyaçlarına (küresel/toplam EV’ler veya EV alt kümeleri) ve kullanılan yöntemlerin sınırlamalarına/taleplerine göre, üç tip altın biyoçip yüzeyi geliştirilmiştir: ya “çıplak”, kimyasal olarak işlevselleştirilmiş “C11/C16” ya da “ligand” altın yüzey olarak adlandırılan ligand-biyoişlevselleştirilmiş.
“ Çıplak” olarak adlandırılan çıplak biyoçip, EV’lerin altın üzerinde basit adsorpsiyonunu sağlar. Kullanılan tamponu seçmek ve bu adsorpsiyonu pasif bir şekilde (inkübasyon ve daha sonra durulama adımları) veya akış altında (SPRi’de) izlemek mümkündür. Dahası, bu pasif adsorpsiyon ya tüm çip üzerinde (makrodizi olarak) gerçekleştirilebilir ya da bir mikropipet gözcüsü kullanılarak mikrodizilerde lokalize edilebilir. “Akış altındaki prosedür”, araştırmacıların kinetiği ve EV adsorpsiyon seviyesini takip etmelerini sağlar. Çıplak altın substrat üzerindeki bu yaklaşım, kimyasal tabaka arayüzü analitik yönteme müdahale edebildiğinde (örneğin, Raman spektroskopisi için) benimsenir.
“C11 / C16” olarak adlandırılan kimyasal olarak işlevselleştirilmiş biyoçip, amaç EV örneğinin küresel bir görünümüne sahip olmak olduğunda, tiyolatlar ile birincil amid bağları oluşturarak altın yüzeyde kovalent olarak bağlanmış EV’lerin yoğun ve sağlam bir “halısı” oluşturmak için kullanılır. Aslında, bu durumda, altın, merkapto-1-undekanol (11-MUOH: “C11”) ve merkapto-1-hekzadekanoik asidin (16-MHA: “C16”) tiyolat karışımı ile işlevselleştirilir ve tiyolatların bir kısmı, hedeflerle kovalent bağlanma oluşturmak için kimyasal olarak aktive edilir. Yine, bu strateji ya pasif olarak (inkübasyon ve daha sonra durulama adımları, ya “makrodizi” de ya da bir mikropipet gözcüsü kullanarak birden fazla mikrodizide) ya da altın yüzeydeki kinetiği ve EV aşılama seviyesini takip etmek için akış hızlarının altında (SPRi’de) gerçekleştirilebilir.
“ Ligandlar” olarak adlandırılan ligand-biyoişlevselleştirilmiş biyoçip , biyolojik numunede bir arada bulunan farklı EV alt kümelerini seçici olarak (afinite ile) yakalamak için farklı ligandları (örneğin, antikorlar, reseptörler) kovalent olarak aşılamak için kimyasal olarak aktive edilir.
Protocol
Representative Results
Discussion
En yaygın kullanılan EV tanımlaması için son yöntemler, EV’lerin kökenini doğrulamak için proteine özgü immünoblotlama, yapılarını doğrulamak için TEM ve bir numune hacmi3’teki sayı ve boyut dağılımlarını ölçmek için NTA’dır. Bununla birlikte, (biyo) tıbbi araştırmalarda EV’lere olan yüksek ilgi ve mevcut analitik araçların sınırlamaları, bilimsel topluluğu EV karakterizasyonu, ayrımcılığı ve nicelleştirmesi için yeni yöntemler geliştirmeye teşvik etm…
Disclosures
The authors have nothing to disclose.
Acknowledgements
IVETh çekirdek tesisinden (Paris) Kelly Aubertin ve Fabien Picot, Raman görüntüleme deneyleri için kabul edildi. Thierry Burnouf (Taipei Tıp Üniversitesi, Tayvan) ve Zuzana Krupova (Helincourt, Fransa’dan), sırasıyla kan trombositi ve sığır sütü örneklerinden elde edilen EV örneklerini sağladıkları için kabul edilmektedir. Çalışma, bölge Bourgogne Franche-Comté ve EUR EIPHI lisansüstü okulu tarafından desteklenmiştir (NOVICE projesi, 2021-2024). Bu çalışmanın bir kısmı CLIPP platformu kullanılarak ve Rabah Zeggari’ye teşekkür ettiğimiz FEMTO-ENGINEERING’deki RENATECH temiz oda tesislerinde yapıldı.
Materials
| CD41a antibody | Diaclone SAS (France) | 447528 | |
| CP920 | Microparticles GmbH, Germany | 448303 | |
| DXR3xi | Thermo Fisher Scientific | T1502 | |
| EDC | Sigma | A6272 | |
| Ethanolamine | Sigma | P5368-10PAK | |
| Evs derived from platelet concentrates | Collaboration : Pr T. Burnouf (TMU, Taipei) | S2889 | |
| Evs from bovine milk | Collaboration : Dr Z. Krupova (Excilone, Helincourt – France) | 3450 | |
| Glutaraldehyde | Sigma | 56845 | |
| Gwyddion | 853.223.020 | ||
| Magnetron sputtering | PLASSYS | SAB5300165 | |
| mercapto-1-hexadecanoic acid | Sigma | G5882 | |
| Mercapto-1-undecanol | Sigma | O8001 | |
| Mountains SPIP ones | Digital Surf | ||
| NanoWizard 3 Bioscience | Bruker-JPK | ||
| Octyl Glucoside (OG) | Sigma | ||
| Ovalbumine antibody | Sigma | ||
| Phosphate Buffer Saline (PBS) | Sigma | ||
| Rat Albumin Serum (RSA) | Sigma | ||
| Sodium acetate buffer | Sigma | ||
| SPR-Biacore 3000 | GE Healthcare/ Cytiva life sciences | ||
| SPRi Biochip | MIMENTO technology platform | The biochips were produced in-house in the clean room, Besancon | |
| SPRi Plex II | Horiba Scientific | ||
| Sulfo-NHS | Sigma |
References
- Silva, A. K. A., et al. Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translatiOn to clinicaL perspectiVEs – EVOLVE France". Advanced Drug Delivery Reviews. 179, 114001 (2021).
- Xunian, Z., Kalluri, R. Biology and therapeutic potential of mesenchymal stem cell-derived exosomes. Cancer Science. 111 (9), 3100-3110 (2020).
- Hartjes, T. A., et al. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioengineering. 6 (1), 7 (2019).
- Xing, Y., et al. Analysis of extracellular vesicles as emerging theranostic nanoplatforms. Coordination Chemistry Reviews. 424, 213506 (2020).
- Wang, T., Xing, Y., Cheng, Z., Yu, F. Analysis of single extracellular vesicles for biomedical applications with especial emphasis on cancer investigations. Trends in Analytical Chemistry. 152, 116604 (2022).
- Boireau, W., Elie-Caille, C. Extracellular vesicles: Definition, isolation and characterization. Medecine Sciences: M/S. 37 (12), 1092-1100 (2021).
- Brisson, A. R., et al. Extracellular vesicles from activated platelets: A semiquantitative cryo-electron microscopy and immuno-gold labeling study. Platelets. 28 (3), 263-271 (2017).
- Yuana, Y., et al. Atomic force microscopy: A novel approach to the detection of nanosized blood microparticles. Journal of Thrombosis and Haemostasis. 8 (2), 315-323 (2010).
- Sebaihi, N., de Boeck, B., Yuana, Y., Nieuwland, R., Pétry, J. Dimensional characterization of extracellular vesicles using atomic force microscopy. Measurement Science and Technology. 28 (3), 034006 (2017).
- Beekman, P., et al. Immuno-capture of extracellular vesicles for individual multi-modal characterization using AFM, SEM and Raman spectroscopy. Lab on a Chip. 19 (15), 2526-2536 (2019).
- Malenica, M., et al. Perspectives of microscopy methods for morphology characterisation of extracellular vesicles from human biofluids. Biomedicines. 9 (6), 603 (2021).
- Verweij, F. J., et al. The power of imaging to understand extracellular vesicle biology in vivo. Nature Methods. 18 (9), 1013-1026 (2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Obeid, S., et al. NanoBioAnalytical characterization of extracellular vesicles in 75-nm nanofiltered human plasma for transfusion: A tool to improve transfusion safety. Nanomedicine: Nanotechnology, Biology, and Medicine. 20, 101977 (2019).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for «on-chip» qualification and quantification of platelet-derived microparticles. Biosensors and Bioelectronics. 93, 250-259 (2017).
- Ridolfi, A., et al. AFM-based high-throughput nanomechanical screening of single extracellular vesicles. Analytical Chemistry. 92 (15), 10274-10282 (2020).
- Vorselen, D., et al. The fluid membrane determines mechanics of erythrocyte extracellular vesicles and is softened in hereditary spherocytosis. Nature Communications. 9 (1), 4960 (2018).
- Hardij, J., et al. Characterisation of tissue factor bearing extracellular vesicles with AFM: Comparison of air-tapping-mode AFM and liquid Peak Force AFM. Journal of Extracellular Vesicles. 2, 21045 (2013).
- Jorgensen, M., et al. Extracellular Vesicle (EV) Array: Microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping. Journal of Extracellular Vesicles. 2, 20920 (2013).
- Remy-Martin, F., et al. Surface plasmon resonance imaging in arrays coupled with mass spectrometry (SUPRA-MS): Proof of concept of on-chip characterization of a potential breast cancer marker in human plasma. Analytical and Bioanalytical Chemistry. 404 (2), 423-432 (2012).
- Czamara, K., et al. Raman spectroscopy of lipids: A review. Journal of Raman Spectroscopy. 46 (1), 4-20 (2015).
- Penders, J., et al. Single particle automated Raman trapping analysis of breast cancer cell-derived extracellular vesicles as cancer biomarkers. ACS Nano. 15 (11), 18192-18205 (2021).
- Baek, S. J., Park, A., Ahn, Y. J., Choo, J. Baseline correction using asymmetrically reweighted penalized least squares smoothing. Analyst. 140 (1), 250-257 (2015).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246 (2016).
- Ertsgaard, C. T., et al. Integrated nanogap platform for sub-volt dielectrophoretic trapping and real-time Raman imaging of biological nanoparticles. Nano Letters. 18 (9), 5946-5953 (2018).
- Maas, S. L., et al. Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics. Journal of Controlled Release. 200, 87-96 (2015).

