בדיקת סידן פלואורסצנטית "דו-תוספת" לבדיקת תפוקה גבוהה של קולטנים מצומדים לחלבון G רקומביננטי
Summary
בעבודה זו מתוארת בדיקה פלואורסצנטית של סידן תוך-תאי בעל תפוקה גבוהה עבור צלחות של 384 בארות לסינון ספריות מולקולות קטנות על קולטנים מצומדים לחלבון G רקומביננטי (GPCRs). המטרה, קולטן קינין מקרציית קדחת הבקר, Rhipicephalus microplus, מתבטאת בתאי CHO-K1. בדיקה זו מזהה אגוניסטים ואנטגוניסטים המשתמשים באותם תאים במבחן “תוספת כפולה” אחת.
Abstract
קולטנים מצומדים לחלבון G (GPCRs) מייצגים את משפחת-העל הגדולה ביותר של קולטנים והם המטרות של תרופות אנושיות רבות. סינון בתפוקה גבוהה (HTS) של ספריות מולקולות קטנות אקראיות מול GPCRs משמש את תעשיית התרופות לגילוי תרופות ספציפיות למטרה. במחקר זה, נעשה שימוש ב-HTS כדי לזהות ליגנדות חדשניות של מולקולות קטנות של GPCRs נוירופפטידים ספציפיים לחסרי חוליות כבדיקות למחקרים פיזיולוגיים של וקטורים של פתוגנים קטלניים אנושיים ווטרינריים.
קולטן קינין הספציפי לחסרי חוליות נבחר כיעד משום שהוא מווסת תהליכים פיזיולוגיים חשובים רבים אצל חסרי חוליות, כולל דיאורזה, האכלה ועיכול. יתר על כן, הפרמקולוגיה של GPCRs חסרי חוליות רבים מאופיינת בצורה גרועה או אינה מאופיינת כלל; לכן, הפרמקולוגיה הדיפרנציאלית של קבוצות קולטנים אלה ביחס ל- GPCRs הקשורים במטזואנים אחרים, במיוחד בני אדם, מוסיפה ידע ליחסי המבנה-פעילות של GPCRs כמשפחת-על. בדיקת HTS פותחה עבור תאים בלוחות של 384 בארות לגילוי ליגנדות של קולטן קינין מקרציית קדחת הבקר, או קרציית בקר דרומית, Rhipicephalus microplus. קולטן הקרצייה קינין התבטא ביציבות בתאי CHO-K1.
קולטן קינין, כאשר הוא מופעל על ידי נוירופפטידים אנדוגניים של קינין או אגוניסטים אחרים של מולקולות קטנות, גורם לשחרור Ca2+ ממאגרי סידן לתוך הציטופלסמה. בדיקת סידן פלואורסצנטית זו בשילוב עם גישת “תוספת כפולה” יכולה לזהות מולקולות “פוגעות” פונקציונליות של אגוניסט ואנטגוניסט באותה צלחת בדיקה. כל בדיקה נערכה באמצעות לוחות תרופות שנשאו מערך של 320 מולקולות קטנות אקראיות. התקבל גורם Z אמין של 0.7, וזוהו שלוש מולקולות אגוניסט ושני אנטגוניסטים כאשר ה-HTS היה בריכוז סופי של 2 מיקרומטר. ניתן להתאים את בדיקת הסידן הפלואורסצנטית המדווחת כאן לסינון GPCRs אחרים המפעילים את מפל האיתות Ca2+ .
Introduction
קולטנים מצומדים לחלבון G (GPCRs), הנמצאים משמרים ועד בני אדם, מייצגים את משפחת-העל הגדולה ביותר של קולטנים באורגניזמים רבים1. הם ממלאים תפקידים קריטיים בוויסות כמעט כל התהליכים הביולוגיים בבעלי חיים. ישנם 50-200 GPCRs בגנום של פרוקי רגליים, כלומר הם מייצגים את משפחת קולטני הממברנההגדולה ביותר 2. הם מסווגים לשש מחלקות עיקריות, A-F, בהתבסס על דמיון הרצף והפונקציות שלהם3. GPCRs מתמרים אותות חוץ-תאיים שונים, כגון אלה של הורמונים, נוירופפטידים, אמינים ביוגניים, גלוטמט, פרוטון, ליפוגליקופרוטאינים ופוטונים4. GPCRs מצמידים לחלבוני G הטרוטרימרים (Gα, Gβ ו-Gγ) כדי להעביר אותות במורד הזרם. GPCRs המצומדים לחלבוני Gαs או Gα i/o מגבירים או מקטינים, בהתאמה, את רמות האדנוזין מונופוספט (cAMP) התוך-תאיים 3′, 5′-מחזורי על-ידיהפעלה או עיכוב של אדניליל ציקלאז. GPCRs המצומדים ל-Gαq/11 גורמים לשחרור סידן ממאגרי הסידן ברשתית האנדופלסמית על-ידי הפעלת מסלול הפוספוליפאז C (PLC)-אינוזיטול-1,4,5-טריפוספט (IP3). GPCRs המצומדים ל- Gα12/13 מפעילים את גורמי החלפת הנוקלאוטידים RhoGTPase 5,6. GPCRs הם המטרה של יותר מ -50% של תרופות אנושיות ו acaricide, amitraz4. כאשר GPCRs מתמרים אותות כה מגוונים, הם מהווים יעדים מבטיחים לפיתוח חומרי הדברה חדשניים המשבשים תפקודים פיזיולוגיים ספציפיים לחסרי חוליות.
המטרה של HTS היא לזהות מולקולות פגיעות שיכולות לווסת את תפקודי הקולטן. HTS כולל פיתוח בדיקות, מזעור ואוטומציה7. GPCRs נוירופפטידים של פרוקי רגליים מעורבים ברוב הפונקציות הפיזיולוגיות, כגון התפתחות, נפילה ואקדיזיס, הפרשה, גיוס אנרגיה ורבייה4. רוב הנוירופפטידים GPCRs של פרוקי רגליים ומטזואנים מאותתים דרך מפל איתות הסידן 2,6,8,9,10, כגון בקולטני הפפטיד המיואינהימבורי וה-SIFamide של הקרצייה השחורה Ixodes scapularis; הליגנדות שלהם הן אנטגוניסטיות במבחני תנועתיות אחוריים, כאשר SIF מעורר התכווצות ו- MIP מעכב אותו11,12. קולטן דמוי NPY של יתוש הקדחת הצהובה, Aedes aegypti, מווסת את נקבת הפונדקאית המחפשת13. בהשוואה למבחנים חלופיים אחרים לגיוס סידן, כגון בדיקת הסידן הביולומינסנציהaequorin 14, בדיקת הסידן הפלואורסצנטי קלה לביצוע, אינה דורשת העברה של חלבונים אחרים המזהים סידן רקומביננטי, והיא חסכונית. בדיקת הסידן הפלואורסצנטי מייצרת אות ממושך בהשוואה לאות הקינטי המהיר המתקבל בבדיקת הסידן הביולומינסנציה של אקוורין14,15.
בדוגמה כאן, קולטן קינין מקרציית קדחת הבקר, Rhipicephalus microplus, התבטא באופן רקומביננטי בקו התאים CHO-K1 ושימש לבדיקת סידן פלואורסצנטי. יש רק גן אחד של קולטן קינין שנמצא במיקרופלוס R. ; הקולטן מאותת דרך מסלול איתות תלוי חלבון Gq ומפעיל את השטף של Ca2+ ממאגרי סידן לתוך החלל התוך-תאי16. ניתן לזהות ולכמת את התהליך הזה על-ידי פלואורופור, שמעורר אות פלואורסצנטי בעת קשירת יוני סידן (איור 1).
קולטן קינין הוא GPCR ספציפי לחסרי חוליות, השייך לקולטנים דמויי רודופסין מסוג A. קינין הוא נוירופפטיד איתות עתיק שנמצא במולוסקה, סרטנאים, חרקים ואקרי 4,17,18. קולופטרנים (חיפושיות) חסרים את מערכת האיתות של קינין; אצל היתוש Aedes aegypti, יש רק קולטן קינין אחד שקושר שלושה אדסקינינים, בעוד שלדרוזופילה מלנוגסטר יש קולטן קינין אחד עם דרוסוקינין כליגנדייחודי 19,20,21. אין קינינים הומולוגיים או קולטני קינין אצל בעלי חוליות. למרות שהתפקוד המדויק של קינין אינו ידוע בקרציות, הנקבות המושתקות ב-RNAi של קולטן קינין של R. microplus מראות ירידה משמעותית בכושר הרבייה22. קינינים הם פפטידים פלוטרופיים בחרקים. ב Drosophila melanogaster, הם מעורבים הן במערכת ויסות העצבים המרכזית והן ההיקפית 23, טרום אקדיזה24, האכלה 25, מטבוליזם 26, ודפוסי פעילות שינה26,27, כמו גם תנועה זחל 28. קינינים מווסתים את ההתכווצות האחורית, דיאורזיס והזנה ביתוש A. aegypti 29,30,31. לפפטידים של קינין יש פנטפפטיד C-terminal Phe-X1-X2-Trp-Gly-NH2 שמור, שהוא הרצף המינימלי הנדרש לפעילות ביולוגית32. הספציפיות של פרוקי הרגליים, הגודל הקטן של הליגנד האנדוגני, מה שהופך אותם לנוחים להפרעות של מולקולות קטנות, והתפקודים הפליאוטרופיים בחרקים הופכים את קולטן קינין למטרה מבטיחה להדברה4.
מבחן “התוספת הכפולה” (איור 2) מאפשר זיהוי של אגוניסטים או אנטגוניסטים באותה בדיקת HTS15. הוא מותאם מבדיקת “תוספת כפולה” המשמשת בדרך כלל בתעשיית התרופות לגילוי תרופות33. בקצרה, התוספת הראשונה של תרופות לצלחת התא מאפשרת זיהוי של אגוניסטים פוטנציאליים בספרייה הכימית כאשר אות פלואורסצנטי גבוה יותר מזוהה בהשוואה ליישום של בקרת הממס. לאחר 5 דקות של דגירה עם מולקולות קטנות אלה, אגוניסט ידוע (פפטיד קינין) מוחל על כל הבארות. אותן בארות שקיבלו באופן אקראי אנטגוניסט מצלחת התרופה מציגות אות פלואורסצנטי נמוך יותר על תוספת אגוניסטית בהשוואה לבארות הבקרה שקיבלו את הממס בתוספת הראשונה. בדיקה זו מאפשרת זיהוי של אגוניסטים ואנטגוניסטים פוטנציאליים עם אותם תאים. בפרויקט HTS סטנדרטי, מולקולות פגיעות אלה יאומתו עוד יותר באמצעות מבחני מינון-תגובה ועל ידי מבחני פעילות ביולוגית נוספים, שאינם מוצגים כאן.
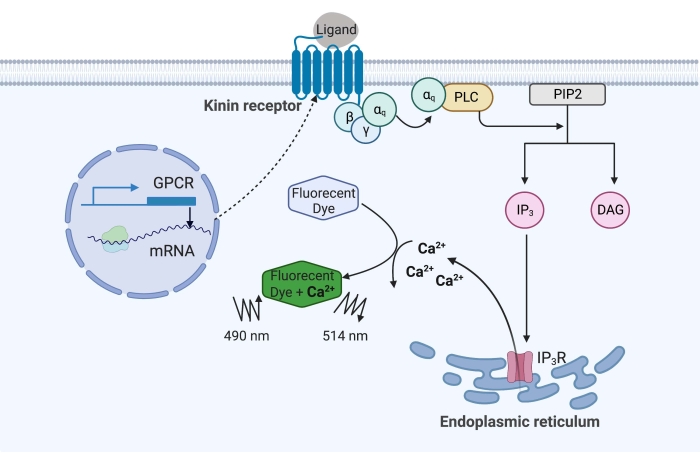
איור 1: המחשה של מנגנון בדיקת הסידן הפלואורסצנטי. חלבון ה-Gq מפעיל את מסלול איתות הסידן התוך-תאי. קולטן קינין (קולטן מצומד לחלבון G) בא לידי ביטוי רקומביננטי בתאי CHO-K1. כאשר הליגנד האגוניסט נקשר לקולטן, חלבון ה-Gq הקשור לקולטן קינין מפעיל את PLC, מה שמזרז את ההמרה של מולקולת PIP2 ל-IP3 ו-DAG. לאחר מכן, IP 3 נקשר ל-IP3R על פני השטח של הרשתית האנדופלסמית, מה שמוביל לשחרור Ca 2+ לתוך הציטופלסמה, שם יוני Ca2+ נקשרים לפלואורופורים ומעוררים אות פלואורסצנטי. ניתן לקבל את אות הפלואורסצנציה על ידי עירור ב 490 ננומטר ולזהות ב 514 ננומטר. קיצורים: GPCR = קולטן מצומד חלבון G; PLC = פוספוליפאז C; PIP2 = פוספטידילינוזיטול 4,5-ביספוספט; IP3 = אינוזיטול טריספוספט; DAG = דיאצילגליצרול; IP3 R = קולטן IP3. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
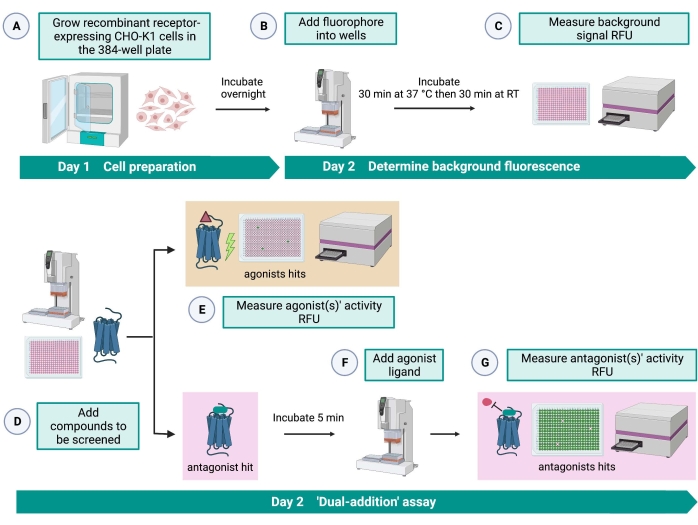
איור 2: תהליך העבודה של הקרנה בתפוקה גבוהה של מולקולות קטנות על קולטן מצומד לחלבון G המתבטא בתאי CHO-K1. (A) תאי CHO-K1 רקומביננטיים המבטאים ביציבות את קולטן הקינין נוספו לצלחת 384 באר (10,000 תאים/באר) באמצעות מערכת טיפול בנוזל (25 μL/well) ודוגרו באינקובטור CO2 לח במשך 12-16 שעות. (ב ) חיץ הבדיקה המכיל את הצבע הפלואורסצנטי (25 μL/well) נוסף ללוחית התא באמצעות מערכת טיפול בנוזל. הצלחת דוגרה במשך 30 דקות בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות ושיוותה ב-RT למשך 30 דקות נוספות. (D) תמיסות סמים מצלחת ספרייה של 384 בארות וממס ריק (כולם ב-0.5 μL/well) נוספו ללוחית הבדיקה התאית באמצעות מערכת טיפול בנוזלים. (E) תגובות פלואורסצנטיות של סידן תאי נמדדו עם קורא הצלחות מיד לאחר הוספת תמיסות התרופה; תרכובות המעוררות אותות פלואורסצנטיים גבוהים מהממוצע נבחרו כפגיעות אגוניסטיות. להיטים אנטגוניסטיים שחוסמים את ה-GPCR (אייקון למטה) נחשפו לאחר הוספת האגוניסט הפפטידי במהלך שלב G. (F) באותה צלחת בדיקה, לאחר 5 דקות של דגירה של התאים עם תרכובות הקרנה, פפטיד אגוניסט אנדוגני Rhimi-K-1 (QFSPWGamide) של קולטן קינין קרציות נוסף לכל באר (1 μM). (G) תגובות פלואורסצנטיות תאיות לאחר תוספת הפפטיד האגוניסטית נמדדו על ידי קורא הלוחות באופן מיידי. תרכובות המעכבות את האות הפלואורסצנטי נבחרו כפגיעות אנטגוניסטיות. קיצורים: GPCR = קולטן מצומד חלבון G; RT = טמפרטורת החדר; RFU = יחידות פלואורסצנטיות יחסיות. נוצר באמצעות BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
המטרה של HTS היא לזהות מולקולות פגיעות באמצעות סינון מספר עצום של מולקולות קטנות. לכן, התוצאות מדוגמה זו מייצגות רק חלק קטן מניסוי HTS קונבנציונלי. יתר על כן, מולקולות הפגיעה שזוהו צריכות להיות מאומתות במבחנים במורד הזרם, כגון בדיקה תלוית מינון על אותו קו תאים רקומביננטי ועל קו תאים CHO-K1 הנושא …
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי פרס USDA-NIFA-AFRI לבריאות ורווחת בעלי חיים (פרס מספר 2022-67015-36336, PVP [מנהל הפרויקט]) ומקרנות תחרותיות מתוכנית המענקים למחלות וקטוריות חרקים של טקסס A&M AgriLife (FY’22-23) ל- P.V.P. קבוצת הסגל A.W.E.S.O.M.E. של המכללה לחקלאות ומדעי החיים, TAMU, מוכרת על עזרה בעריכת כתב היד. טבלה משלימה S2 מכילה נתונים מספריית מולקולות קטנות פנימית, אקראית, שהתקבלו ממעבדתו של ד”ר ג’יימס סאצ’טיני באוניברסיטת A&M בטקסס A&M AgriLife Research.
Materials
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10×96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
References
- Hanlon, C. D., Andrew, D. J. Outside-in signaling – A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 – Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).

