Un ensayo de fluorescencia de calcio de "doble adición" para el cribado de alto rendimiento de receptores acoplados a proteínas G recombinantes
Summary
En este trabajo, se describe un ensayo de fluorescencia de calcio intracelular de alto rendimiento para placas de 384 pocillos para examinar bibliotecas de moléculas pequeñas en receptores acoplados a proteínas G recombinantes (GPCR). El objetivo, el receptor de cinina de la garrapata de la fiebre del ganado, Rhipicephalus microplus, se expresa en las células CHO-K1. Este ensayo identifica agonistas y antagonistas utilizando las mismas células en un ensayo de “doble adición”.
Abstract
Los receptores acoplados a proteínas G (GPCR) representan la superfamilia más grande de receptores y son el objetivo de numerosos medicamentos humanos. La industria farmacéutica utiliza el cribado de alto rendimiento (HTS) de bibliotecas aleatorias de moléculas pequeñas contra GPCR para el descubrimiento de fármacos específicos del objetivo. En este estudio, se empleó un HTS para identificar nuevos ligandos de moléculas pequeñas de GPCR de neuropéptidos específicos de invertebrados como sondas para estudios fisiológicos de vectores de patógenos humanos y veterinarios mortales.
El receptor de quinina específico de invertebrados se eligió como objetivo porque regula muchos procesos fisiológicos importantes en los invertebrados, incluida la diuresis, la alimentación y la digestión. Además, la farmacología de muchos GPCR de invertebrados está mal caracterizada o no está caracterizada en absoluto; por lo tanto, la farmacología diferencial de estos grupos de receptores con respecto a los GPCR relacionados en otros metazoos, especialmente humanos, agrega conocimiento a las relaciones estructura-actividad de GPCR como una superfamilia. Se desarrolló un ensayo HTS para células en placas de 384 pocillos para el descubrimiento de ligandos del receptor de cinina de la garrapata de la fiebre del ganado, o garrapata del ganado del sur, Rhipicephalus microplus. El receptor de quinina de garrapata se expresó de manera estable en las células CHO-K1.
El receptor de quinina, cuando es activado por neuropéptidos de quinina endógenos u otros agonistas de moléculas pequeñas, desencadena la liberación de Ca2+ de las reservas de calcio en el citoplasma. Este ensayo de fluorescencia de calcio combinado con un enfoque de “doble adición” puede detectar moléculas “golpeadas” agonistas funcionales y antagonistas en la misma placa de ensayo. Cada ensayo se realizó utilizando placas de fármacos que transportaban una matriz de 320 moléculas pequeñas aleatorias. Se obtuvo un factor Z’ fiable de 0,7, y se identificaron tres moléculas agonistas y dos antagonistas cuando el HTS estaba en una concentración final de 2 μM. El ensayo de fluorescencia de calcio reportado aquí se puede adaptar para detectar otros GPCR que activan la cascada de señalización Ca2+ .
Introduction
Los receptores acoplados a proteínas G (GPCR), que están presentes desde la levadura hasta los humanos, representan la mayor superfamilia de receptores en muchos organismos1. Desempeñan un papel crítico en la regulación de casi todos los procesos biológicos en los animales. Hay 50-200 GPCR en el genoma de los artrópodos, lo que significa que representan la superfamilia de receptores de membrana más grande2. Se clasifican en seis clases principales, A-F, en función de su similitud de secuencia y funciones3. Los GPCR transducen diversas señales extracelulares, como las de hormonas, neuropéptidos, aminas biogénicas, glutamato, protones, lipoglicoproteínas y fotones4. Los GPCR se acoplan a las proteínas G heterotrímero (Gα, Gβ y Gγ) para transmitir señales aguas abajo. Los GPCR acoplados a las proteínas Gαs o Gαi/o aumentan o disminuyen, respectivamente, los niveles intracelulares de 3′, 5′ -monofosfato de adenosina cíclico (cAMP) mediante la activación o inhibición de la adenilil ciclasa. Los GPCR acoplados a Gαq/11 inducen la liberación de calcio de las reservas de calcio del retículo endoplásmico mediante la activación de la vía de la fosfolipasa C (PLC)-inositol-1,4,5-trifosfato (IP3). Los GPCR acoplados a Gα12/13 activan los factores de intercambio de nucleótidos RhoGTPasa 5,6. Los GPCR son el objetivo de más del 50% de los medicamentos humanos y un acaricida, amitraz4. A medida que los GPCR transducen señales tan diversas, son objetivos prometedores para desarrollar nuevos pesticidas que interrumpen las funciones fisiológicas específicas de los invertebrados.
El objetivo de HTS es identificar moléculas de impacto que puedan modular las funciones del receptor. HTS implica el desarrollo de ensayos, miniaturización y automatización7. Los GPCR del neuropéptido artrópodo están involucrados en la mayoría de las funciones fisiológicas, como el desarrollo, la muda y la ecdisis, la excreción, la movilización de energía y la reproducción4. La mayoría de los GPCR neuropeptídicos de artrópodos y metazoos señalan a través de la cascada de señalización de calcio 2,6,8,9,10, como en el péptido mioinhibitorio y los receptores SIFamida de la garrapata de patas negras Ixodes scapularis; sus ligandos son antagónicos en los ensayos de motilidad del intestino posterior, con SIF provocando contracción y MIP inhibiéndola11,12. Un receptor similar al NPY del mosquito de la fiebre amarilla, Aedes aegypti, regula la búsqueda de huéspedes femeninos13. En comparación con otros ensayos alternativos de movilización de calcio, como el ensayo de bioluminiscencia cálcica aequorina14, el ensayo de fluorescencia de calcio es fácil de realizar, no requiere la transfección de otras proteínas detectoras de calcio recombinantes y es rentable. El ensayo de fluorescencia de calcio produce una señal prolongada en comparación con la señal cinética rápida obtenida en el ensayo de bioluminiscencia cálcica aequorina14,15.
En el ejemplo aquí, el receptor de cinina de la garrapata de la fiebre del ganado, Rhipicephalus microplus, se expresó recombinantemente en la línea celular CHO-K1 y se utilizó para el ensayo de fluorescencia de calcio. Solo hay un gen receptor de cinina que se encuentra en R. microplus; el receptor señala a través de una vía de señalización dependiente de la proteína Gq y desencadena el flujo de Ca2+ de las reservas de calcio al espacio intracelular16. Este proceso puede ser detectado y cuantificado por un fluoróforo, que provoca una señal de fluorescencia al unir iones de calcio (Figura 1).
El receptor de quinina es un GPCR específico de invertebrados, que pertenece a los receptores similares a la rodopsina de clase A. La quinina es un antiguo neuropéptido de señalización que está presente en moluscos, crustáceos, insectas y acari 4,17,18. Los coleópteros (escarabajos) carecen del sistema de señalización de cininas; en el mosquito Aedes aegypti, solo hay un receptor de quinina que se une a tres aedeskininas, mientras que Drosophila melanogaster tiene un receptor de cinina con drosokinina como ligando único 19,20,21. No hay cininas homólogas o receptores de cinina en vertebrados. Aunque la función exacta de la cinina es desconocida en las garrapatas, las hembras silenciadas por ARNi del receptor de cinina de R. microplus muestran una aptitud reproductiva significativamente reducida22. Las cininas son péptidos pleotrópicos en insectos. En Drosophila melanogaster, están involucrados en los sistemas reguladores nerviosos central y periférico 23, pre-ecdisis24, alimentación 25, metabolismo 26 y patrones de actividad del sueño26,27, así como locomoción larvaria 28. Las cininas regulan la contracción del intestino posterior, la diuresis y la alimentación en el mosquito A. aegypti 29,30,31. Los péptidos de cinina tienen un pentapéptido C-terminal conservado Phe-X1-X2-Trp-Gly-NH2, que es la secuencia mínima requerida para la actividad biológica32. La especificidad de los artrópodos, el pequeño tamaño del ligando endógeno, que los hace susceptibles a la interferencia de moléculas pequeñas, y las funciones pleiotrópicas en los insectos hacen del receptor de cinina un objetivo prometedor para el control de plagas4.
El ensayo de “doble adición” (Figura 2) permite la identificación de agonistas o antagonistas en el mismo ensayo HTS15. Está adaptado de un ensayo de “doble adición” que se utiliza comúnmente en la industria farmacéutica para el descubrimiento de fármacos33. En resumen, la primera adición de fármacos en la placa celular permite la identificación de posibles agonistas en la biblioteca química cuando se detecta una señal de fluorescencia más alta en comparación con la aplicación del control de disolvente. Después de 5 minutos de incubación con estas moléculas pequeñas, se aplica un agonista conocido (péptido de cinina) a todos los pocillos. Aquellos pocillos que recibieron al azar un antagonista de la placa de fármaco muestran una señal de fluorescencia más baja tras la adición de agonistas en comparación con los pocillos de control que recibieron el solvente en la primera adición. Este ensayo permite la identificación de posibles agonistas y antagonistas con las mismas células. En un proyecto estándar de HTS, estas moléculas de éxito se validarían aún más a través de ensayos de dosis-respuesta y mediante ensayos de actividad biológica adicionales, que no se muestran aquí.
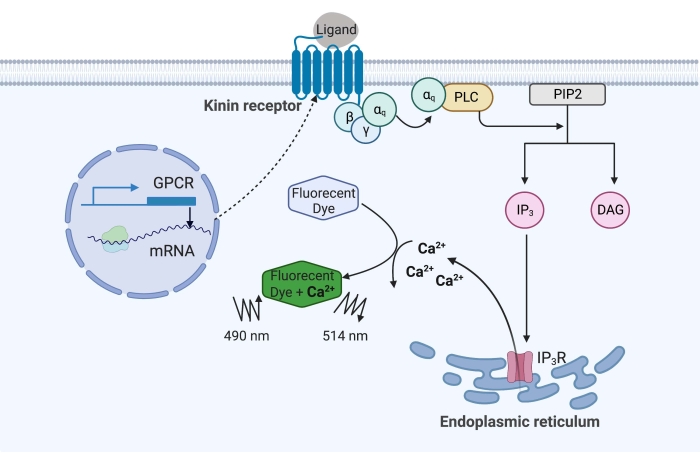
Figura 1: Ilustración del mecanismo de ensayo de fluorescencia de calcio. La proteína Gq desencadena la vía de señalización de calcio intracelular. El receptor de cinina (receptor acoplado a proteína G) se expresó recombinantemente en células CHO-K1. Cuando el ligando agonista se une al receptor, la proteína Gq asociada con el receptor de quinina activa PLC, que cataliza la conversión de una molécula PIP2 en IP3 y DAG. IP 3 luego se une al IP3R en la superficie del retículo endoplásmico, lo que lleva a la liberación de Ca 2+ en el citoplasma, donde los iones de Ca2+ se unen a los fluoróforos y provocan una señal de fluorescencia. La señal de fluorescencia puede obtenerse por excitación a 490 nm y detectarse a 514 nm. Abreviaturas: GPCR = receptor acoplado a proteína G; PLC = fosfolipasa C; PIP2 = fosfatidilinositol 4,5-bisfosfato; IP3 = trifosfato de inositol; DAG = diacilglicerol; IP3 R = receptor IP3. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
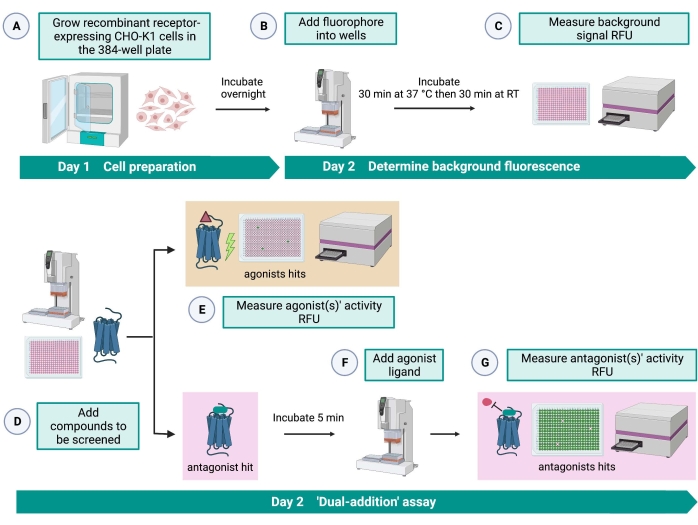
Figura 2: El flujo de trabajo para el cribado de alto rendimiento de moléculas pequeñas en un receptor acoplado a proteína G expresado en células CHO-K1. (A) Las células CHO-K1 recombinantes que expresan de manera estable el receptor de cinina se agregaron a la placa de 384 pocillos (10,000 células / pocillo) utilizando un sistema de manejo de líquidos (25 μL / pocillo) y se incubaron en una incubadora humidificada de CO2 durante12-16 h. (B ) El tampón de ensayo que contenía el colorante fluorescente (25 μL/pocillo) se añadió a la placa celular utilizando un sistema de manipulación de líquidos. La placa se incubó durante 30 min a 37 °C durante 30 min y se equilibró a RT durante otros 30 min. (C) La señal de fluorescencia de fondo de las células en cada pocillo se midió con un lector de placas. (D) Se agregaron soluciones farmacológicas de una placa de biblioteca de 384 pocillos y disolvente en blanco (todo a 0,5 μL/pocillo) a la placa de ensayo celular utilizando un sistema de manejo de líquidos. (E) Las respuestas de fluorescencia de calcio celular se midieron con el lector de placas inmediatamente después de la adición de las soluciones farmacológicas; Los compuestos que provocan señales de fluorescencia superiores a la media se seleccionaron como agonistas acertados. Los golpes antagonistas que bloquean el GPCR (icono a continuación) se revelaron después de la adición del agonista peptídico durante el paso G. (F) En la misma placa de ensayo, después de 5 minutos de incubación de las células con compuestos de cribado, se añadió un péptido agonista endógeno Rhimi-K-1 (QFSPWGamida) del receptor de quinina de garrapata a cada pocillo (1 μM). (G) Las respuestas de fluorescencia celular después de la adición del péptido agonista fueron medidas por el lector de placas inmediatamente. Los compuestos que inhiben la señal de fluorescencia se seleccionaron como antagonistas de los hits. Abreviaturas: GPCR = receptor acoplado a proteína G; RT = temperatura ambiente; RFU = unidades de fluorescencia relativa. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El objetivo de HTS es identificar moléculas de impacto a través de la detección de un número masivo de moléculas pequeñas. Por lo tanto, los resultados de este ejemplo solo representan una pequeña parte de un experimento HTS convencional. Además, las moléculas de éxito identificadas deben validarse en ensayos posteriores, como un ensayo dependiente de la dosis en la misma línea celular recombinante y en una línea celular CHO-K1 que lleve solo el vector vacío, que se puede realizar simultáneamente para salva…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por el Premio de Salud y Bienestar Animal USDA-NIFA-AFRI (número de premio 2022-67015-36336, PVP [Director del proyecto]) y de fondos competitivos del Programa de Subvenciones para Enfermedades de Vectores de Insectos de Investigación de Texas A&M AgriLife (FY’22-23) a P.V.P. El grupo de profesores A.W.E.S.O.M.E. de la Facultad de Agricultura y Ciencias de la Vida, TAMU, es reconocido por su ayuda en la edición del manuscrito. La Tabla Suplementaria S2 contiene datos de una biblioteca interna, aleatoria y de moléculas pequeñas obtenida del laboratorio del Dr. James Sacchettini en la Universidad de Texas A&M y Texas A&M AgriLife Research.
Materials
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10×96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
References
- Hanlon, C. D., Andrew, D. J. Outside-in signaling – A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 – Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).

