مقايسة مضان الكالسيوم "مزدوجة الإضافة" للفحص عالي الإنتاجية لمستقبلات البروتين G المؤتلف
Summary
في هذا العمل ، تم وصف مقايسة مضان الكالسيوم عالية الإنتاجية داخل الخلايا لألواح 384 بئرا لفحص مكتبات الجزيئات الصغيرة على مستقبلات البروتين G المقترنة المؤتلفة (GPCRs). يتم التعبير عن الهدف ، مستقبل كينين من قراد حمى الماشية ، Rhipicephalus microplus ، في خلايا CHO-K1. يحدد هذا الفحص الناهضات والخصوم باستخدام نفس الخلايا في مقايسة “الإضافة المزدوجة” الواحدة.
Abstract
تمثل مستقبلات البروتين G المقترنة (GPCRs) أكبر عائلة فائقة من المستقبلات وهي أهداف للعديد من الأدوية البشرية. تستخدم صناعة الأدوية الفحص عالي الإنتاجية (HTS) لمكتبات الجزيئات الصغيرة العشوائية مقابل GPCRs لاكتشاف الأدوية الخاصة بالهدف. في هذه الدراسة ، تم استخدام HTS لتحديد روابط جديدة صغيرة الجزيئات من GPCRs العصبية الخاصة باللافقاريات كتحقيقات للدراسات الفسيولوجية لنواقل مسببات الأمراض البشرية والبيطرية القاتلة.
تم اختيار مستقبل كينين الخاص باللافقاريات كهدف لأنه ينظم العديد من العمليات الفسيولوجية المهمة في اللافقاريات ، بما في ذلك إدرار البول والتغذية والهضم. علاوة على ذلك ، فإن علم الأدوية للعديد من GPCRs اللافقارية ضعيف الوصف أو لا يتميز على الإطلاق. لذلك ، فإن علم الصيدلة التفاضلي لهذه المجموعات من المستقبلات فيما يتعلق ب GPCRs ذات الصلة في metazoans الأخرى ، وخاصة البشر ، يضيف المعرفة إلى العلاقات بين الهيكل والنشاط ل GPCRs كعائلة فائقة. تم تطوير اختبار HTS للخلايا في 384 لوحة بئر لاكتشاف روابط مستقبلات كينين من قراد حمى الماشية ، أو قراد الماشية الجنوبي ، Rhipicephalus microplus. تم التعبير عن مستقبل كينين القراد بثبات في خلايا CHO-K1.
مستقبلات كينين ، عند تنشيطها بواسطة ببتيدات كينين العصبية الداخلية أو غيرها من ناهضات الجزيئات الصغيرة ، تؤدي إلى إطلاق Ca2+ من مخازن الكالسيوم إلى السيتوبلازم. يمكن لمقايسة مضان الكالسيوم هذه جنبا إلى جنب مع نهج “الإضافة المزدوجة” اكتشاف ناهض وظيفي وجزيئات “ضرب” مضادة في نفس لوحة الفحص. تم إجراء كل اختبار باستخدام لوحات المخدرات التي تحمل مجموعة من 320 جزيئا صغيرا عشوائيا. تم الحصول على عامل Z موثوق به يبلغ 0.7 ، وتم تحديد ثلاثة جزيئات ناهضة وجزيئين مصادين عندما كان HTS عند تركيز نهائي 2 ميكرومتر. يمكن تكييف مقايسة مضان الكالسيوم المبلغ عنها هنا لفحص GPCRs الأخرى التي تنشط سلسلة إشارات Ca2+ .
Introduction
تمثل مستقبلات G المقترنة بالبروتين (GPCRs) ، الموجودة من الخميرة إلى البشر ، أكبر عائلة فائقة من المستقبلات في العديد من الكائنات الحية1. يلعبون أدوارا حاسمة في تنظيم جميع العمليات البيولوجية تقريبا في الحيوانات. هناك 50-200 GPCRs في جينوم المفصليات ، مما يعني أنها تمثل أكبر عائلة فائقة لمستقبلات الغشاء2. يتم تصنيفها إلى ست فئات رئيسية ، A-F ، بناء على تشابه تسلسلها ووظائفها3. تقوم GPCRs بتحويل إشارات مختلفة خارج الخلية ، مثل تلك الخاصة بالهرمونات ، والببتيدات العصبية ، والأمينات الحيوية ، والغلوتامات ، والبروتون ، والبروتينات الشحمية ، والفوتونات4. يقترن GPCRs ببروتينات G غير المتجانسة (Gα و Gβ و Gγ) لنقل إشارات المصب. GPCRs المقترنة ببروتينات Gαs أو Gαi / o تزيد أو تنقص ، على التوالي ، مستويات أحادي فوسفات الأدينوزين الحلقي 3 ‘، 5’-cyclic (cAMP) عن طريق تنشيط أو تثبيط سيكلاز الأدينيل. تحفز GPCRs المقترنة ب Gαq / 11 إطلاق الكالسيوم من مخازن الكالسيوم في الشبكة الإندوبلازمية عن طريق تنشيط مسار الفوسفوليباز C (PLC) -الإينوزيتول-1،4،5-ثلاثي الفوسفات (IP3). تعمل GPCRs المقترنة ب Gα12/13 على تنشيط عوامل تبادل النوكليوتيدات RhoGTPase 5,6. GPCRs هي هدف أكثر من 50 ٪ من الأدوية البشرية ومبيد للقراد ، amitraz4. وبما أن هذه المحطات تنقل مثل هذه الإشارات المتنوعة، فإنها تعد أهدافا واعدة لتطوير مبيدات آفات جديدة تعطل الوظائف الفسيولوجية الخاصة باللافقاريات.
الهدف من HTS هو تحديد جزيئات الضرب التي يمكنها تعديل وظائف المستقبلات. يتضمن HTS تطوير الفحص والتصغير والأتمتة7. تشارك GPCRs المفصلية العصبية في معظم الوظائف الفسيولوجية ، مثل التنمية ، وطرح الريش و ecdysis ، والإفراز ، وتعبئة الطاقة ، والتكاثر4. تشير معظم GPCRs الببتيد العصبي للمفصليات والميتازوان من خلال سلسلة إشارات الكالسيوم2،6،8،9،10 ، كما هو الحال في مستقبلات الببتيد المثبط للعضل ومستقبلات SIFamide للقراد الأسود Ixodes scapularis. روابطهم معادية في مقايسات حركية الأمعاء الخلفية ، حيث تثير SIF انكماشا ويثبطها MIP11,12. ينظم مستقبل يشبه NPY لبعوضة الحمى الصفراء ، Aedes aegypti ، مضيفة أنثى تسعى13. بالمقارنة مع مقايسات تعبئة الكالسيوم البديلة الأخرى مثل مقايسة التلألؤ الحيوي للكالسيوم aequorin14 ، فإن مقايسة مضان الكالسيوم سهلة التنفيذ ، ولا تتطلب نقل بروتينات الكشف عن الكالسيوم المؤتلف الأخرى ، وهي فعالة من حيث التكلفة. تنتج مقايسة مضان الكالسيوم إشارة طويلة مقارنة بالإشارة الحركية السريعة التي تم الحصول عليها في مقايسة التلألؤ الحيوي للكالسيوم aequorin14,15.
في المثال هنا ، تم التعبير عن مستقبل كينين من قراد حمى الماشية ، Rhipicephalus microplus ، بشكل مؤتلف في خط خلية CHO-K1 واستخدم في مقايسة مضان الكالسيوم. لا يوجد سوى جين واحد لمستقبلات كينين موجود في R. microplus. إشارات المستقبل من خلال مسار إشارات يعتمد على بروتين Gq ويؤدي إلى تدفق Ca2+ من مخازن الكالسيوم إلى الفضاء داخل الخلايا16. يمكن اكتشاف هذه العملية وقياسها بواسطة الفلوروفور ، الذي يثير إشارة مضان عند ربط أيونات الكالسيوم (الشكل 1).
مستقبلات كينين هي GPCR خاص باللافقاريات ، والذي ينتمي إلى مستقبلات تشبه رودوبسين من الفئة أ. Kinin هو ببتيد عصبي قديم للإشارات موجود في Mollusca و Crustacea و Insecta و Acari4،17،18. تفتقر غمدية الأجنحة (الخنافس) إلى نظام إشارات كينين ؛ في البعوض Aedes aegypti ، لا يوجد سوى مستقبل كينين واحد يربط ثلاثة aedeskinins ، في حين أن ذبابة الفاكهة الميلانوجاستر لديها مستقبل كينين واحد مع ذبابة الفاكهة كرابط فريد19،20،21. لا توجد كينين متماثل أو مستقبلات كينين في الفقاريات. على الرغم من أن الوظيفة الدقيقة للكينين غير معروفة في القراد ، إلا أن الإناث الصامتات مستقبلات الكينين RNAi من R. microplus تظهر انخفاضا كبيرا في اللياقة الإنجابية22. Kinins هي الببتيدات متعددة الخواص في الحشرات. في ذبابة الفاكهة الميلانية ، يشاركون في كل من الأنظمة التنظيمية العصبية المركزية والمحيطية23 ، ما قبل ecdysis 24 ، التغذية 25 ، الأيض 26 ، وأنماط نشاط النوم26,27 ، وكذلك حركة اليرقات 28. تنظم Kinins تقلص الأمعاء الخلفية ، إدرار البول ، والتغذية في البعوض A. aegypti29،30،31. تحتوي ببتيدات الكينين على خماسي الببتيد الطرفي C المحفوظ Phe-X1-X2-Trp-Gly-NH2 ، وهو الحد الأدنى للتسلسل المطلوب للنشاط البيولوجي32. إن خصوصية المفصليات ، وصغر حجم الليجند الداخلي ، مما يجعلها قابلة للتداخل الجزيئي الصغير ، والوظائف متعددة الاتجاهات في الحشرات تجعل مستقبلات كينين هدفا واعدا لمكافحة الآفات4.
يسمح اختبار “الإضافة المزدوجة” (الشكل 2) بتحديد الناهضات أو الخصوم في نفس اختبار HTS15. تم تكييفه من مقايسة “الإضافة المزدوجة” التي يشيع استخدامها في صناعة الأدوية لاكتشاف الأدوية33. باختصار ، تسمح الإضافة الأولى للأدوية في صفيحة الخلية بتحديد الناهضات المحتملة في المكتبة الكيميائية عند اكتشاف إشارة مضان أعلى مقارنة بتطبيق التحكم في المذيبات. بعد 5 دقائق من الحضانة مع هذه الجزيئات الصغيرة ، يتم تطبيق ناهض معروف (كينين ببتيد) على جميع الآبار. تلك الآبار التي استقبلت بشكل عشوائي مضادا من لوحة الدواء تظهر إشارة مضان أقل عند إضافة ناهض مقارنة بآبار التحكم التي تلقت المذيب في الإضافة الأولى. يسمح هذا الفحص بعد ذلك بتحديد الناهضات والخصوم المحتملين بنفس الخلايا. في مشروع HTS القياسي ، سيتم التحقق من صحة هذه الجزيئات الضاربة من خلال فحوصات الاستجابة للجرعة ومقايسات النشاط البيولوجي الإضافية ، والتي لا تظهر هنا.
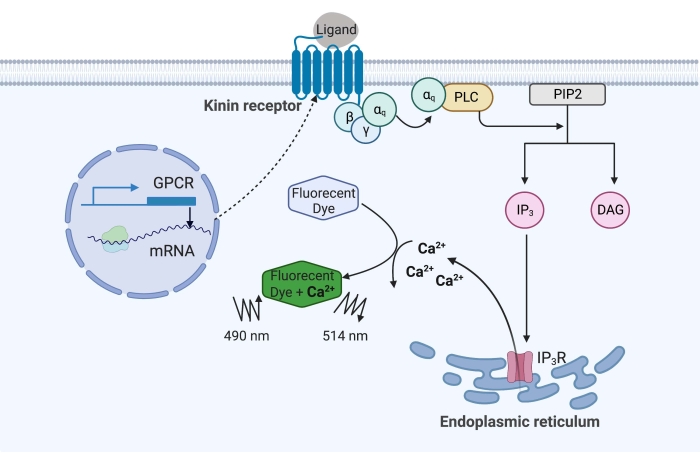
الشكل 1: رسم توضيحي لآلية فحص مضان الكالسيوم. يحفز بروتين Gq مسار إشارات الكالسيوم داخل الخلايا. تم التعبير عن مستقبل كينين (مستقبل البروتين المقترن بالبروتين G) بشكل مؤتلف في خلايا CHO-K1. عندما يرتبط الربيطة الناهضة بالمستقبل ، فإن بروتين Gq المرتبط بمستقبل كينين ينشط PLC ، الذي يحفز تحويل جزيء PIP2 إلى IP3 و DAG. ثم يرتبط IP 3 ب IP3R على سطح الشبكة الإندوبلازمية ، مما يؤدي إلى إطلاق Ca 2+ في السيتوبلازم ، حيث ترتبط أيونات Ca2+ بالفلوروفورات وتثير إشارة مضانة. يمكن الحصول على إشارة التألق عن طريق الإثارة عند 490 نانومتر واكتشافها عند 514 نانومتر. الاختصارات: GPCR = G مستقبلات البروتين المقترنة ؛ PLC = فوسفوليباز ج ؛ PIP2 = فوسفاتيديلينوسيتول 4،5-ثنائي الفوسفات ؛ IP3 = اينوزيتول ثلاثي الفوسفات; DAG = دياسيل جليسرول ؛ IP3 R = مستقبل IP3. تم إنشاؤها باستخدام BioRender.com. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
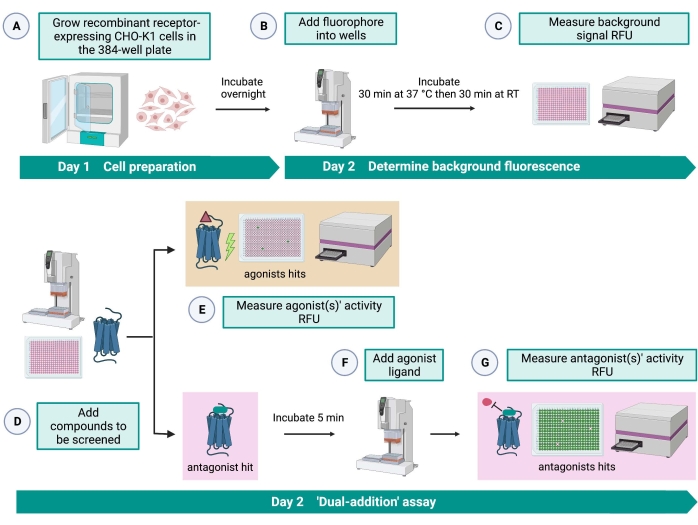
الشكل 2: سير العمل للفحص عالي الإنتاجية للجزيئات الصغيرة على مستقبل مقترن بالبروتين G معبرا عنه في خلايا CHO-K1. (أ) تمت إضافة خلايا CHO-K1 المؤتلفة التي تعبر بثبات عن مستقبل كينين إلى لوحة 384 بئرا (10000 خلية / بئر) باستخدام نظام معالجة السوائل (25 ميكرولتر / بئر) وتم تحضينها في حاضنة CO2 مرطبة لمدة 12-16 ساعة. وأضيف مخزن الفحص الذي يحتوي على صبغة الفلورسنت (25 ميكرولتر/بئر) إلى صفيحة الخلية باستخدام نظام مناولة السوائل. تم تحضين الصفيحة لمدة 30 دقيقة عند 37 درجة مئوية لمدة 30 دقيقة وتمت موازنتها عند RT لمدة 30 دقيقة أخرى. (ج) تم قياس إشارة مضان الخلفية للخلايا في كل بئر باستخدام قارئ لوحة. (د) تمت إضافة المحاليل الدوائية من لوحة مكتبة 384 بئرا ومذيب فارغ (جميعها عند 0.5 ميكرولتر / بئر) إلى لوحة الفحص الخلوي باستخدام نظام معالجة السوائل. (ه) تم قياس استجابات مضان الكالسيوم الخلوي باستخدام قارئ اللوحة مباشرة بعد إضافة محاليل الدواء؛ تم اختيار المركب (المركبات) التي تثير إشارات مضان أعلى من المتوسط كضربة (ضربات) ناهضة. تم الكشف عن نتائج المضاد التي تمنع GPCR (الرمز أدناه) بعد إضافة ناهض الببتيد خلال الخطوة G. (F) في نفس لوحة الفحص ، بعد 5 دقائق من حضانة الخلايا بمركبات الغربلة ، تمت إضافة ببتيد ناهض داخلي المنشأ Rhimi-K-1 (QFSPWGamide) لمستقبل كينين القراد إلى كل بئر (1 ميكرومتر). (ز) تم قياس استجابات التألق الخلوي بعد إضافة الببتيد الناهض بواسطة قارئ اللوحة على الفور. تم اختيار المركب (المركبات) التي تثبط إشارة التألق كضربة (ضربات) مضادة. الاختصارات: GPCR = G مستقبلات البروتين المقترنة ؛ RT = درجة حرارة الغرفة ؛ RFU = وحدات مضان نسبية. تم إنشاؤها باستخدام BioRender.com. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
Representative Results
Discussion
الهدف من HTS هو تحديد جزيئات الضرب من خلال فحص أعداد هائلة من الجزيئات الصغيرة. لذلك ، فإن النتائج من هذا المثال لا تمثل سوى جزء صغير من تجربة HTS التقليدية. علاوة على ذلك ، يجب التحقق من صحة جزيئات الضرب المحددة في مقايسات المصب مثل الفحص المعتمد على الجرعة على نفس خط الخلية المؤتلف وعلى خط خل?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من خلال جائزة USDA-NIFA-AFRI لصحة الحيوان ورفاهيته (رقم الجائزة 2022-67015-36336 ، PVP [مدير المشروع]) ومن الصناديق التنافسية من برنامج منحة أمراض ناقلات الحشرات لأبحاث Texas A&M AgriLife (FY’22-23) إلى P.V.P. تم الاعتراف بمجموعة أعضاء هيئة التدريس A.W.E.S.O.M.E. في كلية الزراعة وعلوم الحياة ، TAMU ، للمساعدة في تحرير المخطوطة. يحتوي الجدول التكميلي S2 على بيانات من مكتبة داخلية عشوائية صغيرة الجزيئات تم الحصول عليها من مختبر الدكتور جيمس ساكيتي في جامعة تكساس إيه آند إم وأبحاث تكساس إيه آند إم الزراعية.
Materials
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10×96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
References
- Hanlon, C. D., Andrew, D. J. Outside-in signaling – A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 – Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).

