Et "dual-addition" calciumfluorescensassay til high-throughput screening af rekombinante G-proteinkoblede receptorer
Summary
I dette arbejde beskrives et højt gennemløb, intracellulært calciumfluorescensassay for 384-brøndplader til screening af små molekylebiblioteker på rekombinante G-proteinkoblede receptorer (GPCR’er). Målet, kininreceptoren fra kvægfeberflåten, Rhipicephalus microplus, udtrykkes i CHO-K1-celler. Dette assay identificerer agonister og antagonister, der bruger de samme celler i et “dual-addition” assay.
Abstract
G-proteinkoblede receptorer (GPCR’er) repræsenterer den største superfamilie af receptorer og er målene for adskillige humane lægemidler. High-throughput screening (HTS) af tilfældige små molekylebiblioteker mod GPCR’er bruges af medicinalindustrien til målspecifik lægemiddelopdagelse. I denne undersøgelse blev en HTS anvendt til at identificere nye småmolekyleligander af hvirvelløse dyrspecifikke neuropeptid-GPCR’er som sonder til fysiologiske undersøgelser af vektorer af dødelige humane og veterinære patogener.
Den hvirvelløse dyrespecifikke kininreceptor blev valgt som mål, fordi den regulerer mange vigtige fysiologiske processer hos hvirvelløse dyr, herunder diurese, fodring og fordøjelse. Desuden er farmakologien hos mange hvirvelløse GPCR’er dårligt karakteriseret eller slet ikke karakteriseret; derfor tilføjer den differentierede farmakologi af disse grupper af receptorer med hensyn til de relaterede GPCR’er i andre metazoer, især mennesker, viden til struktur-aktivitetsforholdet mellem GPCR’er som en superfamilie. Et HTS-assay blev udviklet til celler i 384-brøndplader til opdagelse af ligander af kininreceptoren fra kvægfeberflåten eller den sydlige kvægflåt, Rhipicephalus microplus. Tick kininreceptoren blev stabilt udtrykt i CHO-K1-celler.
Kininreceptoren, når den aktiveres af endogene kininneuropeptider eller andre små molekyleagonister, udløser Ca2+ frigivelse fra calciumbutikker ind i cytoplasmaet. Dette calciumfluorescensassay kombineret med en “dual-addition” tilgang kan detektere funktionelle agonist og antagonist “hit” molekyler i samme analyseplade. Hvert assay blev udført ved hjælp af lægemiddelplader, der bærer en række 320 tilfældige små molekyler. En pålidelig Z’-faktor på 0,7 blev opnået, og tre agonist- og to antagonist-hitmolekyler blev identificeret, når HTS var ved en slutkoncentration på 2 μM. Det calciumfluorescensassay, der rapporteres her, kan tilpasses til at screene andre GPCR’er, der aktiverer Ca2+ signalkaskaden.
Introduction
G-proteinkoblede receptorer (GPCR’er), som er til stede fra gær til mennesker, repræsenterer den største superfamilie af receptorer i mange organismer1. De spiller afgørende roller i reguleringen af næsten alle biologiske processer hos dyr. Der er 50-200 GPCR’er i leddyrs genom, hvilket betyder, at de repræsenterer den største membranreceptor-superfamilie2. De er klassificeret i seks hovedklasser, A-F, baseret på deres sekvenslighed og funktioner3. GPCR’er transducerer forskellige ekstracellulære signaler, såsom hormoner, neuropeptider, biogene aminer, glutamat, proton, lipoglycoproteiner og fotoner4. GPCR’er kobles til heterotrimer G-proteiner (Gα, Gβ og Gγ) for at transmittere nedstrømssignaler. GPCR’er koblet til Gαs eller Gαi / o-proteiner øger eller reducerer henholdsvis de intracellulære 3′, 5′-cykliske adenosinmonophosphatniveauer (cAMP) ved at aktivere eller hæmme adenylylcyclase. GPCR’er koblet til Gαq/11 inducerer calciumfrigivelse fra de endoplasmatiske retikulumcalciumlagre ved at aktivere phospholipase C (PLC)-inositol-1,4,5-triphosphat (IP3) vejen. GPCR’er koblet til Gα12/13 aktiverer RhoGTPase-nukleotidbyttefaktorer 5,6. GPCR’er er målet for mere end 50% af humane lægemidler og et acaricid, amitraz4. Da GPCR’er transducerer så forskellige signaler, er de lovende mål for udvikling af nye pesticider, der forstyrrer hvirvelløse dyr-specifikke fysiologiske funktioner.
Målet med HTS er at identificere hitmolekyler, der kan modulere receptorfunktioner. HTS involverer analyseudvikling, miniaturisering og automatisering7. Arthropod neuropeptid GPCR’er er involveret i de fleste fysiologiske funktioner, såsom udvikling, smeltning og ecdysis, udskillelse, energimobilisering og reproduktion4. De fleste neuropeptid-GPCR’er af leddyr og metazoer signalerer gennem calciumsignalkaskaden 2,6,8,9,10, såsom i myohæmmende peptid- og SIFamidreceptorer i den sortbenede flåt Ixodes scapularis; deres ligander er antagonistiske i bagtarmmotilitetsanalyser, hvor SIF fremkalder sammentrækning og MIP hæmmer det11,12. En NPY-lignende receptor af gul feber myg, Aedes aegypti, regulerer kvindelig vært søger13. Sammenlignet med andre alternative calciummobiliseringsassays såsom aequorin-calciumbioluminescensanalysen14 er calciumfluorescensanalysen let at udføre, kræver ikke transfektion af andre rekombinante calciumdetekterende proteiner og er omkostningseffektiv. Calciumfluorescensanalysen frembringer et forlænget signal sammenlignet med det hurtige kinetiske signal opnået i aequorincalciumbioluminescensanalysen14,15.
I eksemplet her blev kininreceptoren fra kvægfeberflåten, Rhipicephalus microplus, rekombinant udtrykt i CHO-K1-cellelinjen og anvendt til calciumfluorescensassayet. Der findes kun ét kininreceptorgen i R. microplus; receptoren signalerer gennem en Gq-proteinafhængig signalvej og udløser udstrømningen af Ca2+ fra calciumlagre til det intracellulære rum16. Denne proces kan detekteres og kvantificeres af en fluorofor, som fremkalder et fluorescenssignal ved binding af calciumioner (figur 1).
Kininreceptoren er en hvirvelløse dyr-specifik GPCR, som tilhører klasse A Rhodopsin-lignende receptorer. Kinin er et gammelt signalneuropeptid, der er til stede i Mollusca, Crustacea, Insecta og Acari 4,17,18. Coleopterans (biller) mangler kinin signalsystemet; i myggen Aedes aegypti er der kun en kininreceptor, der binder tre aedeskininer, mens Drosophila melanogaster har en kininreceptor med drosokinin som en unik ligand 19,20,21. Der er ingen homologe kininer eller kininreceptorer hos hvirveldyr. Selvom kinins nøjagtige funktion er ukendt i flåter, viser kininreceptorens RNAi-tavse hunner af R. microplus signifikant reduceret reproduktionsegnethed22. Kininer er pleotropiske peptider i insekter. I Drosophila melanogaster er de involveret i både de centrale og perifere nervereguleringssystemer23, præ-ecdysis24, fodring25, stofskifte 26 og søvnaktivitetsmønstre 26,27 samt larvebevægelse 28. Kinins regulerer hindgut sammentrækning, diurese og fodring i myggen A. aegypti 29,30,31. Kininpeptiderne har et konserveret C-terminalt pentapeptid Phe-X1-X2-Trp-Gly-NH2, som er den mindste krævede sekvens for biologisk aktivitet32. Arthropodspecificiteten, den lille størrelse af den endogene ligand, som gør dem modtagelige for småmolekyleinterferens, og de pleiotropiske funktioner i insekter gør kininreceptoren til et lovende mål for skadedyrsbekæmpelse4.
“Dual-addition”-assayet (figur 2) gør det muligt at identificere agonister eller antagonister i samme HTS-assay15. Det er tilpasset fra et “dual-addition” assay, der almindeligvis anvendes i medicinalindustrien til lægemiddelopdagelse33. Kort sagt tillader den første tilsætning af lægemidler i cellepladen identifikation af potentielle agonister i det kemiske bibliotek, når der detekteres et højere fluorescenssignal sammenlignet med anvendelsen af opløsningsmiddelkontrollen. Efter 5 minutters inkubation med disse små molekyler påføres en kendt agonist (kininpeptid) på alle brøndene. De brønde, der tilfældigt modtog en antagonist fra lægemiddelpladen, viser et lavere fluorescenssignal ved agonisttilsætning sammenlignet med kontrolhullerne, der modtog opløsningsmidlet i den første tilsætning. Dette assay tillader derefter identifikation af potentielle agonister og antagonister med de samme celler. I et standard HTS-projekt ville disse hitmolekyler blive yderligere valideret gennem dosis-respons-assays og ved yderligere biologiske aktivitetsassays, som ikke er vist her.
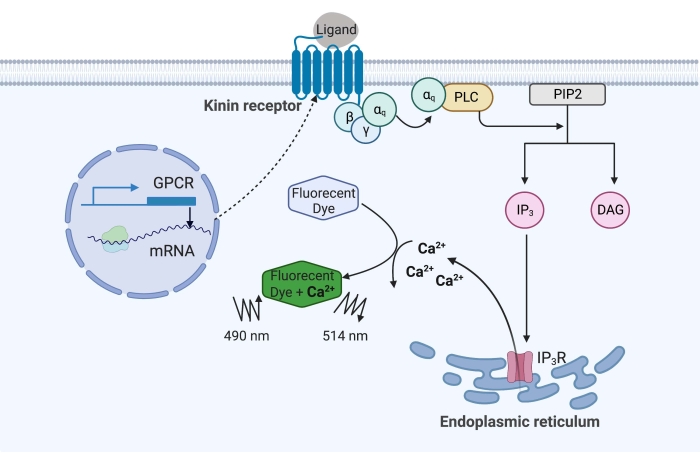
Figur 1: Illustration af calciumfluorescensanalysemekanismen. Gq-proteinet udløser den intracellulære calciumsignalvej. Kininreceptoren (G-proteinkoblet receptor) blev rekombinant udtrykt i CHO-K1-celler. Når agonistenaganden binder til receptoren, aktiverer Gq-proteinet, der er forbundet med kininreceptoren, PLC, som katalyserer omdannelsen af et PIP2-molekyle til IP3 og DAG. IP 3 binder derefter til IP3R på overfladen af det endoplasmatiske retikulum, hvilket fører til frigivelse af Ca 2+ i cytoplasmaet, hvor Ca2+ ioner binder til fluoroforerne og fremkalder et fluorescenssignal. Fluorescenssignalet kan opnås ved excitation ved 490 nm og detekteres ved 514 nm. Forkortelser: GPCR = G proteinkoblet receptor; PLC = phospholipase C; PIP2 = phosphatidylinositol-4,5-bisphosphat; IP3 = inositoltrisphosphat; DAG = diacylglycerol; IP3 R = IP3 receptor. Oprettet med BioRender.com. Klik her for at se en større version af denne figur.
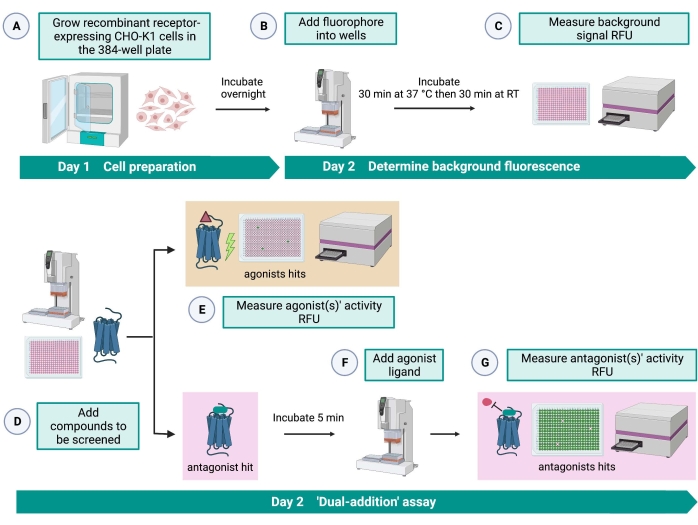
Figur 2: Arbejdsgangen for high-throughput screening af små molekyler på en G-proteinkoblet receptor udtrykt i CHO-K1-celler. (A) Rekombinante CHO-K1-celler, der stabilt udtrykker kininreceptoren, blev tilsat til 384-brøndpladen (10.000 celler / brønd) ved hjælp af et væskehåndteringssystem (25 μL / brønd) og inkuberet i en befugtet CO2 -inkubator i 12-16 timer. (B ) Analysebufferen indeholdende det fluorescerende farvestof (25 μL/hul) blev tilsat cellepladen ved hjælp af et væskehåndteringssystem. Pladen blev inkuberet i 30 minutter ved 37 °C i 30 minutter og ekvilibreret ved RT i yderligere 30 minutter. (C) Baggrundsfluorescenssignalet fra cellerne i hvert hul blev målt med en pladelæser. (D) Lægemiddelopløsninger fra en 384-brønds biblioteksplade og blindopløsningsmiddel (alle ved 0,5 μL / brønd) blev tilsat til den cellulære analyseplade ved hjælp af et væskehåndteringssystem. (E) Cellulære calciumfluorescensresponser blev målt med pladelæseren umiddelbart efter tilsætning af lægemiddelopløsningerne; Forbindelse(r), der fremkaldte fluorescenssignaler, der var højere end gennemsnittet, blev udvalgt som agonisthits. Antagonisthits, der blokerer GPCR (ikonet nedenfor) blev afsløret efter tilsætning af peptidagonisten under trin G. (F) I samme analyseplade blev der efter 5 minutters inkubation af cellerne med screeningsforbindelser tilsat et endogent agonistpeptid Rhimi-K-1 (QFSPWGamid) af flåtkininreceptoren til hvert hul (1 μM). (G) Cellulære fluorescensresponser efter tilsætning af agonistpeptid blev straks målt af pladelæseren. Forbindelse(r), der hæmmer fluorescenssignalet, blev valgt som antagonisthits. Forkortelser: GPCR = G proteinkoblet receptor; RT = stuetemperatur; RFU = relative fluorescensenheder. Oprettet med BioRender.com. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Målet med HTS er at identificere hitmolekyler gennem screening af et massivt antal små molekyler. Derfor repræsenterer resultaterne fra dette eksempel kun en lille del af et konventionelt HTS-eksperiment. Desuden skal de identificerede hitmolekyler valideres i downstream-assays, såsom et dosisafhængigt assay på den samme rekombinante cellelinje og på en CHO-K1-cellelinje, der kun bærer den tomme vektor, som kan udføres samtidigt for at redde små molekyler. Cytotoksicitetsanalyser vil hjælpe med at demonstrere,…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af USDA-NIFA-AFRI Animal Health and Well-Being Award (Award number 2022-67015-36336, PVP [Project Director]) og fra konkurrencedygtige midler fra Texas A&M AgriLife Research Insect Vector Diseases Grant Program (FY’22-23) til P.V.P. A.W.E.S.O.M.E. fakultetsgruppen ved College of Agriculture and Life Sciences, TAMU, anerkendes for hjælp til redigering af manuskriptet. Supplerende tabel S2 indeholder data fra et internt, tilfældigt, lille molekylebibliotek hentet fra Dr. James Saccettinis laboratorium ved Texas A &M University og Texas A &M AgriLife Research.
Materials
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10×96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
References
- Hanlon, C. D., Andrew, D. J. Outside-in signaling – A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 – Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).

