ステントル・コエルレウスの馴化の研究
Summary
特定の力と周波数で機械的パルスを送出できるマイクロコントローラ基板リンク装置を用いて 、ステントの 馴化を定量化する手法を紹介します。また、装置を組み立て、外部摂動を最小限に抑える方法で実験を設定する方法も含まれています。
Abstract
学習は通常、複雑な神経系に関連していますが、単一細胞に至るまで、あらゆるレベルの生命がインテリジェントな行動を示すことができるという証拠が増えています。自然システムと人工システムの両方で、学習は新しい情報に基づくシステムパラメータの適応更新であり、インテリジェンスは学習を容易にする計算プロセスの尺度です。 ステントル・コエルレウス は単細胞の池に生息する生物で、刺激を繰り返すと行動反応が低下する学習形態である慣れを示します。 ステントーター は機械的刺激に応答して収縮しますが、これは水生捕食者からの明らかな脱出反応です。しかし、繰り返される低力摂動は慣れを誘発し、収縮確率の漸進的な減少によって実証されます。ここでは、特定の力と周波数で機械的パルスを送出できるマイクロコントローラ基板連動装置を用いて、外部摂動を最小化するような装置の構築方法や実験設定方法など 、ステンター の馴化を定量化する手法を紹介します。 機械的にステンターを刺激するための前述のアプローチとは対照的に、この装置は、単一の実験の過程でコンピュータ制御下で刺激の力を変えることを可能にし、したがって適用することができる入力シーケンスの多様性を大幅に増加させる。単一セルのレベルで慣れを理解することは、複雑な回路に依存しない学習パラダイムを特徴付けるのに役立ちます。
Introduction
学習は通常、複雑な神経系に関連していますが、単一細胞に至るまで、あらゆるレベルの生命がインテリジェントな行動を示すことができるという証拠が増えています。自然系と人工系の両方で、学習は新しい情報1に基づくシステムパラメータの適応更新であり、知能は学習を容易にする計算プロセスの尺度です2。
ステントル・コエルレウス は単細胞の池に生息する生物で、刺激を繰り返すと行動反応が低下する学習形態である慣れを示します3。 ステントーは 機械的刺激に応答して収縮し3、これは水生捕食者からの明らかな脱出応答である。しかし、繰り返される低力摂動は慣れを誘発し、収縮確率の漸進的な減少によって実証される3。慣れた ステンター は、高強度の機械的刺激4 または光刺激5を受けた後も収縮します。これらの観察結果は、動物6の慣れに関するトンプソンとスペンサーの古典的な基準と一致しており、元の収縮反応の減少は、疲労やATPの枯渇ではなく学習によるものであることを強く示唆しています。自由生活細胞として、 ステントール は、多細胞組織の場合のように、周囲の細胞からの干渉をあまり受けずに研究することができます。 Stentor は、その大きなサイズ(1 mm)、定量化可能な慣れ反応3、注射とマイクロマニピュレーションの容易さ7、完全に配列決定されたゲノム8、RNA干渉(RNAi)ツール9の可用性など、いくつかの追加機能により、学習を研究するための扱いやすいシステムとなっています。このモデル生物を使用して、脳や神経系なしで細胞学習を探索するには、 ステント 細胞を刺激して応答を測定するための再現可能な手順が必要です。
ここでは、特定の力と周波数で機械的パルスを送出できるマイクロコントローラ基板連動装置を用いて、外部摂動を最小化するような装置の構築方法や実験設定方法など 、ステンター の馴化を定量化する手法を紹介します(図1)。単一セルのレベルで慣れを理解することは、複雑な回路に依存しない学習パラダイムを特徴付けるのに役立ちます。

図1:慣れ実験のセットアップ。ステントを含むペトリプレートは、馴化装置の柔軟な金属定規の上に置かれる。次に、馴化装置の電機子は、指定された力と周波数で金属定規に当たり、細胞のフィールド全体に刺激波を生成します。USB顕微鏡カメラは、刺激に対するステントーターの反応を記録します。この図の拡大版を表示するには、ここをクリックしてください。
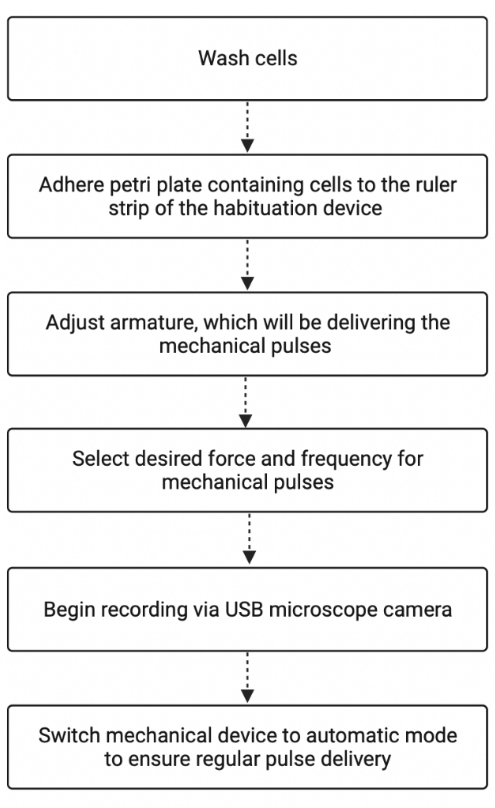
図2:馴化実験ワークフローのまとめ。 図は、慣れ装置を使用して ステントール を研究することに関連する基本的なステップを示しています。図は BioRender.com で作成されました。BioRender.com(2022)による「プロセスフローチャート」から適応。https://app.biorender.com/biorender-templates から取得。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
プロトコルの最も重要なステップは、ステントーが収縮が起こるのに最適な状態にあることを確認することに関連しています。慣れアッセイにおける収縮反応では、ステントールが自由に泳いでいるときに収縮することはめったにないため、粘着性のホールドファストを使用して表面に固定する必要があります。ただし、慣れ実験に使用される35 mmペトリプレートの底面は、ポリオルニチンでコーティングされていない限り、通常、固定に役立ちません。さらに、ステントー忘却のタイムスケールは2〜6時間3であるため、慣れ実験の開始前に最低2時間の間、ステントーターを機械的摂動にさらすことはできません。ステントが馴化実験開始時刻の2時間以内に機械的刺激を受ける場合、この事前刺激が実験の前にわずかなレベルの馴化を誘発し、それによって馴化装置が最初の機械的パルスを送達した後の収縮確率を低下させる可能性がある。最後に、分析段階では、機械的刺激に応答して収縮した細胞の割合を正確に読み取るには、パルス送達の前に発生する偶発的な自発的な収縮ではなく、パルス後に収縮するステントーの数のみをカウントすることが重要です。
プロトコルは、馴化装置によって送達される機械的パルスの力および周波数を変えることによって、異なるタイプの馴化ダイナミクスを研究するように容易に修正することができる。これはまた、 Stentorで発生する可能性のある感作などの他のタイプの学習を探求する機会を提供します。マイクロコントローラボードのプログラムコード自体を調整して、さまざまなパターンのメカニカルタップを Stentorに送ることもできます。
このプロトコルでトラブルシューティングする潜在的な問題の1つは、ステントーアンカーの頻度が低いことであり、慣れ実験で観察できるステントーターの数を制限する可能性があります。アンカー頻度は、最近給餌されていない、または汚染されているステントール培養物では減少することがあります。この問題に対処するには、Linら10に記載されているプロトコルに従って、新しい培養を開始するためにStentorの新しいバッチを洗浄し、定期的に給餌する必要があります。
このプロトコルは、一度に1枚の ステントール プレートしかテストできないという点で制限されており、比較的低いスループットの測定になります。さらに、現在のソフトウェアでは、単一細胞画像解析の自動化はできません。したがって、取得されるほとんどのデータは母集団レベルです。馴化装置と画像解析ツールの将来のモデルは、ハイスループットの単一細胞実験を容易にする可能性があります。
ステントールの慣れは、Wood3で説明されている方法を使用して以前に研究されてきましたが、この新しいプロトコルにより、実験を自動化できます。自動化により、研究者は特定の力と周波数の機械的パルスを再現可能に送達できるだけでなく、デバイスを監視なしで数日間稼働させたままにできるため、長期間の慣れ実験も容易になります。さらに、ウッドの実験3で採用されたソレノイドの代わりにステッピングモーターを使用すると、時間の経過とともに減磁のリスクが軽減され、1回の実験中に刺激の強さを変化させることができます。
細胞の馴化を研究することで、注意欠陥/多動性障害(ADHD)や慣れが損なわれているトゥレット症候群などの状態の臨床的洞察が明らかになる可能性があります11。 ステントの 慣れメカニズムはまた、複雑な細胞回路に依存しない新しい非シナプス学習パラダイムを明らかにする可能性があります。最後に、単一細胞学習に関する洞察は、多細胞組織内の細胞を再プログラミングする方法を刺激する可能性があり、病気と戦うための別の潜在的な手段です。
Disclosures
The authors have nothing to disclose.
Acknowledgements
ステントールの学習について数え切れないほどの議論をしてくれたタチアナ・マクショクに感謝します。この研究は、NSF助成金MCB-2012647、NIH助成金R35 GM130327、およびFourmentin-Guilbert財団からのI2CELL賞によって資金提供されました。
Materials
| 0.01% Poly-ornithine | Millipore Sigma | P4957 | Used to coat Petri plate |
| 35-mm Petri plate | Benz Microscope Optics Center Inc. | L331 | Contains Stentor during experiments |
| 6-well plate | StemCell Technologies | 38016 | Used to wash Stentor |
| Aluminum breadboard, 4" x 24" x 1/2" (x1) | Thorlabs | MB424 | Used to construct habituation device |
| Big easy driver stepper motor driver board (x1) | Sparkfun | ROB-12859 | Used to construct habituation device |
| Construction rail, 1" x 5'' (x2) | Newport | Newport CR-1 | Used to construct habituation device |
| Laptop | Apple Store | https://www.apple.com/macbook-air-m1/ | Connect laptop to USB microscope to visualize experiments |
| Large right-angle bracket (x1) | Thorlabs | AP90RL | Used to construct habituation device |
| Microcontroller board | Arduino | A000066 | Used to control habituation device |
| Nema 17 Stepper Motor Bipolar 59Ncm 2A 84oz.in 48mm 4-Lead | Stepperonline.com | 5-17HS19-2004S1 | Used to construct habituation device |
| Pasteurized spring water | Carolina | 132458 | Media for Stentor experiments |
| Right-angle bracket (x3) | Thorlabs | AP90 | Used to construct habituation device |
| Stemi 2000 stereo microscope | Zeiss | Used to visualize Stentor during wash steps | |
| Stentor coeruleus | Carolina | 131598 | These are the cells used for habituation experiments |
| USB microscope | Celestron | 44308 | Used to visualize and record experiments |
| Webcam recorder | Apple Store | https://apps.apple.com/us/app/webcam-recorder/id1508067444?mt=12 | Install this application to take videos of experiments |
References
- Dussutour, A. Learning in single cell organisms. Biochemical and Biophysical Research Communications. 564, 92-102 (2021).
- Sternberg, R. J. Intelligence. Dialogues in Clinical Neuroscience. 14 (1), 19-27 (2012).
- Wood, D. C. Parametric studies of the response decrement produced by mechanical stimuli in the protozoan, Stentor coeruleus. Journal of Neurobiology. 1 (3), 345-360 (1969).
- Tang, S. K. Y., Marshall, W. F. Cell learning. Current Biology. 28 (20), 1180-1184 (2018).
- Wood, D. C. Stimulus specific habituation in a protozoan. Physiology and Behavior. 11 (3), 349-354 (1973).
- Thompson, R. F., Spencer, W. A. Habituation: A model phenomenon for the study of neuronal substrates of behavior. Psychological Review. 73 (1), 16-43 (1966).
- Slabodnick, M. M., Marshall, W. M. Stentor coeruleus. Current Biology. 24 (17), 783-784 (2014).
- Slabodnick, M. M., et al. The macronuclear genome of Stentor coeruleus reveals tiny introns in a giant cell. Current Biology. 27 (4), 569-575 (2017).
- Slabodnick, M. M., et al. The kinase regulator Mob1 acts as a patterning protein for Stentor morphogenesis. PLoS Biology. 12 (5), 1001861 (2014).
- Lin, A., Makushok, T., Diaz, U., Marshall, W. F. Methods for the study of regeneration in Stentor. Journal of Visualized Experiments. (136), e57759 (2018).
- McDiarmid, T. A., Bernardos, A. C., Rankin, C. H. Habituation is altered in neuropsychiatric disorders-A comprehensive review with recommendations for experimental design and analysis. Neuroscience and Biobehavioral Reviews. 80, 286-305 (2017).

