Summary
Introduzimos um método para quantificar a habituação do Stentor usando um aparelho ligado à placa do microcontrolador que pode fornecer pulsos mecânicos a uma força e frequência especificadas. Também incluímos métodos para montar o aparelho e configurar o experimento de uma forma que minimize as perturbações externas.
Abstract
A aprendizagem é geralmente associada a um sistema nervoso complexo, mas há evidências crescentes de que a vida em todos os níveis, até células individuais, pode exibir comportamentos inteligentes. Em sistemas naturais e artificiais, a aprendizagem é a atualização adaptativa dos parâmetros do sistema com base em novas informações, e a inteligência é uma medida do processo computacional que facilita a aprendizagem. Stentor coeruleus é um organismo unicelular que habita uma lagoa que exibe habituação, uma forma de aprendizagem na qual uma resposta comportamental diminui após um estímulo repetido. O stentor se contrai em resposta à estimulação mecânica, que é uma aparente resposta de fuga de predadores aquáticos. No entanto, repetidas perturbações de baixa força induzem a habituação, demonstrada por uma redução progressiva na probabilidade de contração. Aqui, apresentamos um método para quantificar a habituação do Stentor usando um aparelho ligado à placa do microcontrolador que pode fornecer pulsos mecânicos a uma força e frequência especificadas, incluindo métodos para construir o aparelho e configurar o experimento de uma maneira que minimize as perturbações externas. Em contraste com as abordagens descritas anteriormente para estimular mecanicamente o Stentor, este dispositivo permite que a força de estimulação seja variada sob controle do computador durante o curso de um único experimento, aumentando assim muito a variedade de sequências de entrada que podem ser aplicadas. Compreender a habituação ao nível de uma única célula ajudará a caracterizar paradigmas de aprendizagem que são independentes de circuitos complexos.
Introduction
A aprendizagem é geralmente associada a um sistema nervoso complexo, mas há evidências crescentes de que a vida em todos os níveis, até células individuais, pode exibir comportamentos inteligentes. Em sistemas naturais e artificiais, a aprendizagem é a atualização adaptativa dos parâmetros do sistema com base em novas informações1, e a inteligência é uma medida do processo computacional que facilita a aprendizagem2.
O stentor coeruleus é um organismo unicelular que habita a lagoa que apresenta habituação, uma forma de aprendizagem na qual uma resposta comportamental diminui após um estímulo repetido3. O stentor se contrai em resposta à estimulação mecânica3, que é uma aparente resposta de fuga de predadores aquáticos. No entanto, repetidas perturbações de baixa força induzem a habituação, demonstrada por uma redução progressiva na probabilidade de contração3. O Stentor habituado ainda se contrai após receber estimulação mecânica de alta força4 ou estimulação fótica5. Essas observações, que se alinham com os critérios clássicos de Thompson e Spencer para habituação em animais6, sugerem fortemente que o decréscimo da resposta contrátil original é devido à aprendizagem, e não à fadiga ou ao esgotamento do ATP. Como uma célula de vida livre, o Stentor pode ser estudado sem muita interferência das células circundantes, como seria o caso em um tecido multicelular. Várias características adicionais fazem do Stentor um sistema tratável para estudar a aprendizagem: seu grande tamanho (1 mm), sua resposta de habituação quantificável3, a facilidade de injeção e micromanipulação7, o genoma totalmente sequenciado8 e a disponibilidade de ferramentas de interferência de RNA (RNAi)9. Usando este organismo modelo para explorar a aprendizagem celular sem um cérebro ou sistema nervoso requer um procedimento reprodutível para estimular as células Stentor e medir a resposta.
Aqui, apresentamos um método para quantificar a habituação do Stentor usando um aparelho ligado à placa do microcontrolador que pode fornecer pulsos mecânicos a uma força e frequência especificadas, incluindo métodos para construir o aparelho e configurar o experimento de uma forma que minimize as perturbações externas (Figura 1). Compreender a habituação ao nível de uma única célula ajudará a caracterizar paradigmas de aprendizagem que são independentes de circuitos complexos.

Figura 1: Configuração do experimento de habituação. A placa de Petri contendo Stentor é colocada sobre a régua de metal flexível do dispositivo de habituação. A armadura do dispositivo de habituação então atinge a régua de metal em uma força e frequência especificadas, produzindo uma onda de estímulo em todo o campo das células. A câmera do microscópio USB registra as respostas do Stentor à estimulação. Por favor, clique aqui para ver uma versão maior desta figura.
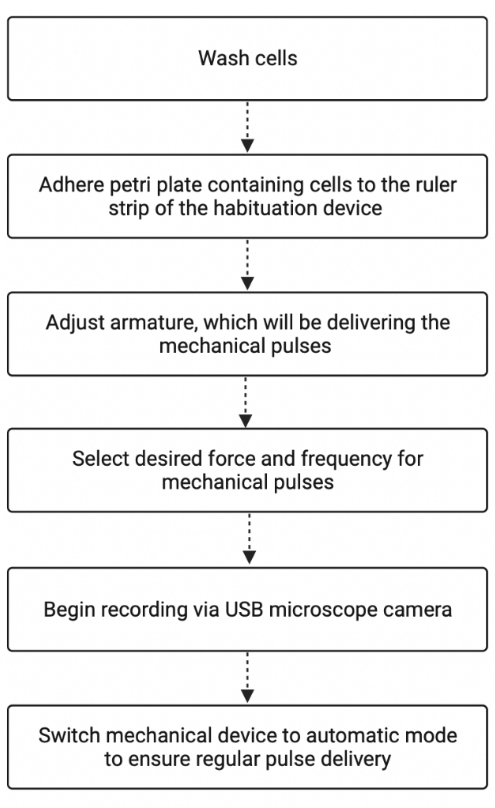
Figura 2: Resumo do fluxo de trabalho do experimento de habituação. A figura mostra as etapas básicas envolvidas no estudo do Stentor usando o dispositivo de habituação. A figura foi criada com BioRender.com. Adaptado de “Fluxograma de Processo”, de BioRender.com (2022). Recuperado de https://app.biorender.com/biorender-templates. Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
As etapas mais críticas do protocolo estão relacionadas a garantir que o Stentor permaneça em condições ideais para que as contrações ocorram. A resposta de contração no ensaio de habituação requer que os Stentors estejam ancorados a uma superfície usando seu pegajoso holdfast, uma vez que raramente se contraem quando estão nadando livremente. No entanto, a superfície inferior da placa de Petri de 35 mm usada para experimentos de habituação não é tipicamente propícia para ancoragem, a menos que seja revestida com poli-ornitina. Além disso, o Stentor não pode ser exposto a qualquer perturbação mecânica por um período mínimo de 2 h antes do início do experimento de habituação porque a escala de tempo de esquecimento do Stentor é de 2-6 h3. Se o Stentor receber estimulação mecânica dentro de 2 h da hora de início do experimento de habituação, existe a possibilidade de que essa estimulação prévia induza um leve nível de habituação antes do experimento, reduzindo assim a probabilidade de contração após o dispositivo de habituação fornecer o primeiro pulso mecânico. Finalmente, durante a fase de análise, é importante contar apenas o número de Stentor que se contraem após um pulso – em vez de quaisquer contrações espontâneas incidentais que ocorram antes da entrega do pulso – para obter uma leitura precisa da fração de células que se contraíram em resposta à estimulação mecânica.
O protocolo pode ser prontamente modificado para estudar diferentes tipos de dinâmica de habituação, alterando a força e a frequência dos pulsos mecânicos entregues pelo dispositivo de habituação. Isso também oferece uma oportunidade para explorar outros tipos de aprendizagem, como a sensibilização, que podem ocorrer no Stentor. O próprio código do programa da placa microcontroladora também pode ser ajustado para fornecer diferentes padrões de torneiras mecânicas ao Stentor.
Um problema potencial para solucionar com esse protocolo é a baixa frequência de ancoragem do Stentor, o que poderia restringir o número de Stentor que pode ser observado no experimento de habituação. A frequência de ancoragem é por vezes reduzida em culturas de Stentor que não foram recentemente alimentadas ou estão contaminadas. Para resolver esse problema, deve-se lavar um novo lote de Stentor para iniciar uma nova cultura e alimentá-los regularmente de acordo com o protocolo descrito em Lin et al.10.
Este protocolo é limitado na medida em que apenas uma única placa de Stentor pode ser testada de cada vez, resultando em medições de rendimento relativamente baixo. Além disso, o software atual não permite a automação da análise de imagens de célula única. A maioria dos dados adquiridos está, portanto, em nível populacional. Modelos futuros do dispositivo de habituação e ferramentas de análise de imagem podem facilitar experimentos de célula única de alto rendimento.
A habituação em Stentor foi previamente estudada usando métodos descritos por Wood3, mas este novo protocolo permite que os experimentos sejam automatizados. A automação não só permite que o pesquisador forneça pulsos mecânicos de força e frequência reprodutíveis, mas também facilita experimentos de habituação a longo prazo, uma vez que o dispositivo pode ser deixado funcionando sem supervisão por dias. Além disso, o uso de um motor de passo em vez do solenoide empregado nos experimentos de Wood3 reduz o risco de desmagnetização ao longo do tempo e também permite que a força do estímulo seja variada durante o curso de um único experimento.
O estudo da habituação celular pode revelar insights clínicos para condições como o transtorno de déficit de atenção/hiperatividade (TDAH) e a síndrome de Tourette, na qual a habituação é prejudicada11. Os mecanismos de habituação do stentor também podem revelar novos paradigmas de aprendizagem não sinápticos independentes de circuitos celulares complexos. Finalmente, insights sobre o aprendizado de células únicas poderiam inspirar métodos para reprogramar células dentro de tecidos multicelulares – outro caminho potencial para combater doenças.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Tatyana Makushok por inúmeras discussões sobre o aprendizado do Stentor . Este trabalho foi financiado pela subvenção da NSF MCB-2012647 e pela subvenção do NIH R35 GM130327, bem como pelo prémio I2CELL da Fundação Fourmentin-Guilbert.
Materials
| 0.01% Poly-ornithine | Millipore Sigma | P4957 | Used to coat Petri plate |
| 35-mm Petri plate | Benz Microscope Optics Center Inc. | L331 | Contains Stentor during experiments |
| 6-well plate | StemCell Technologies | 38016 | Used to wash Stentor |
| Aluminum breadboard, 4" x 24" x 1/2" (x1) | Thorlabs | MB424 | Used to construct habituation device |
| Big easy driver stepper motor driver board (x1) | Sparkfun | ROB-12859 | Used to construct habituation device |
| Construction rail, 1" x 5'' (x2) | Newport | Newport CR-1 | Used to construct habituation device |
| Laptop | Apple Store | https://www.apple.com/macbook-air-m1/ | Connect laptop to USB microscope to visualize experiments |
| Large right-angle bracket (x1) | Thorlabs | AP90RL | Used to construct habituation device |
| Microcontroller board | Arduino | A000066 | Used to control habituation device |
| Nema 17 Stepper Motor Bipolar 59Ncm 2A 84oz.in 48mm 4-Lead | Stepperonline.com | 5-17HS19-2004S1 | Used to construct habituation device |
| Pasteurized spring water | Carolina | 132458 | Media for Stentor experiments |
| Right-angle bracket (x3) | Thorlabs | AP90 | Used to construct habituation device |
| Stemi 2000 stereo microscope | Zeiss | Used to visualize Stentor during wash steps | |
| Stentor coeruleus | Carolina | 131598 | These are the cells used for habituation experiments |
| USB microscope | Celestron | 44308 | Used to visualize and record experiments |
| Webcam recorder | Apple Store | https://apps.apple.com/us/app/webcam-recorder/id1508067444?mt=12 | Install this application to take videos of experiments |
References
- Dussutour, A. Learning in single cell organisms. Biochemical and Biophysical Research Communications. 564, 92-102 (2021).
- Sternberg, R. J. Intelligence. Dialogues in Clinical Neuroscience. 14 (1), 19-27 (2012).
- Wood, D. C. Parametric studies of the response decrement produced by mechanical stimuli in the protozoan, Stentor coeruleus. Journal of Neurobiology. 1 (3), 345-360 (1969).
- Tang, S. K. Y., Marshall, W. F. Cell learning. Current Biology. 28 (20), 1180-1184 (2018).
- Wood, D. C. Stimulus specific habituation in a protozoan. Physiology and Behavior. 11 (3), 349-354 (1973).
- Thompson, R. F., Spencer, W. A. Habituation: A model phenomenon for the study of neuronal substrates of behavior. Psychological Review. 73 (1), 16-43 (1966).
- Slabodnick, M. M., Marshall, W. M. Stentor coeruleus. Current Biology. 24 (17), 783-784 (2014).
- Slabodnick, M. M., et al. The macronuclear genome of Stentor coeruleus reveals tiny introns in a giant cell. Current Biology. 27 (4), 569-575 (2017).
- Slabodnick, M. M., et al. The kinase regulator Mob1 acts as a patterning protein for Stentor morphogenesis. PLoS Biology. 12 (5), 1001861 (2014).
- Lin, A., Makushok, T., Diaz, U., Marshall, W. F. Methods for the study of regeneration in Stentor. Journal of Visualized Experiments. (136), e57759 (2018).
- McDiarmid, T. A., Bernardos, A. C., Rankin, C. H. Habituation is altered in neuropsychiatric disorders-A comprehensive review with recommendations for experimental design and analysis. Neuroscience and Biobehavioral Reviews. 80, 286-305 (2017).

