小鼠脉络丛的显微切割和全安装扫描电子显微镜可视化
Summary
脉络丛(CP)是神经科学中研究不足的组织,在中枢神经系统的健康和疾病中起着关键作用。该协议描述了用于分离CP的显微切割技术,并使用扫描电子显微镜来获得其细胞结构的整体视图。
Abstract
脉络丛(CP)是一种突出到脑室的高度血管化结构,是神经科学中最缺乏研究的组织之一。随着越来越清楚的是,这种微小的结构在中枢神经系统(CNS)的健康和疾病中起着至关重要的作用,因此以允许下游处理的方式正确解剖脑室CP至关重要,从功能到结构分析。这里描述了侧脑室和第四脑室小鼠CP的分离,而无需专门的工具或设备。这种分离技术保留了CP内细胞的活力,功能和结构。由于其高血管化,可以使用双目显微镜可视化漂浮在大脑心室腔内的CP。然而,下游分析所需的经心灌注会使 CP 组织的鉴定复杂化。根据进一步的处理步骤(例如,RNA和蛋白质分析),这可以通过经心灌注溴酚蓝 可视化 CP来解决。分离后,可以使用多种技术(包括RNA,蛋白质或单细胞分析)处理CP,以进一步了解这种特殊大脑结构的功能。在这里,整个安装CP上的扫描电子显微镜(SEM)用于获得结构的整体视图。
Introduction
紧密的屏障将中枢神经系统 (CNS) 与外围隔离开来,包括血脑屏障 (BBB) 和血脑脊液 (CSF) 屏障。这些屏障保护中枢神经系统免受外部侮辱,并确保平衡和受控的微环境1,2,3。虽然BBB随着时间的推移得到了广泛的研究,但位于脉络丛(CP)的血液 – 脑脊液屏障在过去十年中才获得了越来越多的研究兴趣。后一种屏障可以在大脑的四个脑室中找到(图1A,B),其特征在于围绕中央基质的单层脉络丛上皮(CPE)细胞,渗漏的毛细血管,成纤维细胞以及淋巴和骨髓细胞群(图1C)4,5,6.CPE细胞通过紧密的连接牢固地相互连接,从而防止从下面的开窗毛细血管渗漏到脑脊液和大脑中。此外,通过CPE细胞的运输受到许多向内和向外运输系统的调节,这些系统管理有益化合物(例如,营养物质和激素)从血液流入脑脊液以及有害分子(例如,代谢废物,过量的神经递质)在另一个方向的外排1,6。为了能够发挥其主动转运功能,CPE细胞在其细胞质中含有许多线粒体7。此外,CP是脑脊液的主要来源,并通过常驻炎症细胞的存在充当大脑的守门人1。由于其在血液和大脑之间的独特位置,CP也非常适合进行免疫监视8。
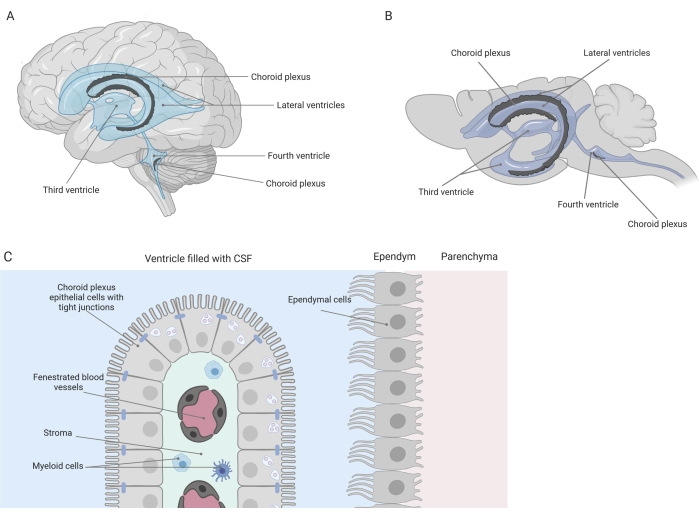
图 1:脉络丛 (CP) 的位置和组成的示意图。 (A,B)CP组织存在于(A)人类和(B)小鼠大脑的两个侧脑室,第三脑室和第四脑室内。(C)CP组织由单层紧密连接的骰骨CP上皮(CPE)细胞组成,围绕开窗毛细血管,松散结缔组织以及淋巴和骨髓细胞,并形成血脑脊液屏障(根据参考文献23改编和修改)。用 Biorender.com 创建的图。请点击此处查看此图的大图。
在过去的十年中,越来越多的证据,包括我们研究小组的几份报告,表明CP在健康和疾病中起着核心作用9,10,11,12,13,14,15,16,17,18.例如,已知老化的血液-脑脊液屏障在细胞核、微绒毛和基底膜1,19 等中显示出形态改变。此外,在阿尔茨海默病的背景下,整体屏障完整性受到损害,所有这些与年龄相关的变化似乎更加明显1,8,20。除了形态变化外,CP的转录组,蛋白质组和分泌组在疾病12,21,22,23期间也发生了变化。因此,CP的先进知识对于更好地了解其在神经系统疾病中的作用并可能开发新的治疗策略至关重要。
一种将脑室CP准确显微解剖的有效方法是允许正确研究这种微小大脑结构的第一步。由于其高度血管化的性质(图2B),可以使用双目显微镜识别漂浮在脑室腔内的CP。然而,下游分析通常需要经心灌注,使CP组织的正确识别和分离复杂化(图2C)。如果进一步的处理步骤允许(例如,在RNA和蛋白质分析的情况下),可以通过溴酚蓝经心灌注 来 观察CP(图2A)。一些出版物已经描述了从大鼠24 和小鼠幼崽大脑25中分离CP。本文描述了一种显微解剖分离技术,用于从成年小鼠中分离CP。重要的是,这种分离技术保留了CP内细胞的活力,功能和结构。本文描述了漂浮在第四脑室和侧脑室中的CP的分离。简而言之,小鼠被终末麻醉,并在必要时经心灌注。但是,应该注意的是,灌注会损害CP内细胞的结构。因此,如果要使用透射电子显微镜(TEM),连续块面扫描电子显微镜(SBF-SEM)或聚焦离子束SEM(FIB-SEM)分析样品,则不应进行灌注。接下来,整个大脑被隔离,镊子被用来对大脑进行射手半切。从这里,可以识别和解剖漂浮在侧脑室中的CP,而来自第四脑室的CP可以从大脑的小脑侧分离出来。
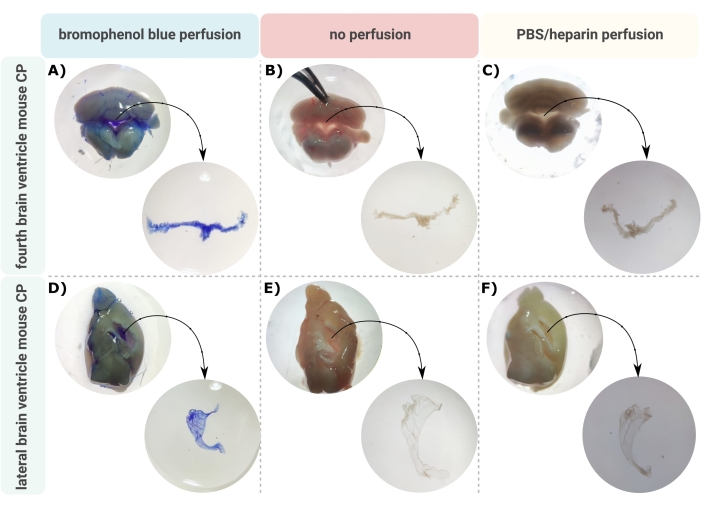
图 2:(A,D) 溴酚蓝灌注、(B,E) 无灌注和 (C,F) PBS/肝素灌注后的 (A-C) 第四和 (D-F) 侧脑室脉络丛 (CP) 的可视化。 图像是用体视显微镜(8x-32x放大倍率)拍摄的。请点击此处查看此图的大图。
一旦脑瘫从脑室中正确解剖出来,就可以应用一整套技术来进一步了解这种结构的功能。例如,可以进行流式细胞术或单细胞RNA测序,以量化和表型分析某些疾病条件下的浸润性炎症细胞26,27。除了细胞组成外,还可以 通过酶联 免疫吸附测定(ELISA)、免疫印迹或使用细胞因子珠阵列28同时分析多种细胞因子来分析CP的分子组成以评估细胞因子和趋化因子的存在。此外,转录组、血管、免疫细胞组织学和分泌组分析可以在显微解剖的 CP 外植体上进行 29。在这里,整个卡口CP上的扫描电子显微镜(SEM)用于获得CP结构的整体视图。SEM使用聚焦电子束扫描表面并创建表面形貌和成分的图像。由于电子的波长远小于光的波长,因此SEM的分辨率在纳米范围内,优于光学显微镜。因此,可以通过SEM 进行 亚细胞水平的形态学研究。 简而言之,将解剖的CP立即转移到含戊二醛的固定剂中进行过夜固定,然后进行渗透和乙酸铀酰染色。然后用天冬氨酸铅染色处理样品,脱水,最终包埋进行成像。
因此,该协议有助于从小鼠脑室中有效分离CP,可以使用各种下游技术进一步分析以研究其结构和功能。
Protocol
Representative Results
Discussion
这里描述了一种将脉络丛(CP)从小鼠大脑的侧脑室和第四脑室中分离出来的方法。CP 的整个安装方法有助于使用一系列技术进行进一步分析,以获得 CP 形态、细胞组成、转录组、蛋白质组和分泌组的完整视图。这种分析对于更好地了解从大脑脑室突出的这种显着结构至关重要。这些知识具有巨大的研究兴趣,因为越来越清楚的是,CP在健康和疾病中起着至关重要的作用9,10,<s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作得到了比利时阿尔茨海默氏症研究基金会(SAO;项目编号:20200032),法兰德斯研究基金会(FWO Vlaanderen;项目编号:1268823N,11D0520N,1195021N)和Baillet Latour基金的支持。我们感谢VIB生物成像核心的培训,支持和进入仪器园区。
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

