Microdissecção e Visualização por Microscopia Eletrônica de Varredura de Montagem Completa do Plexo Coroide de Camundongos
Summary
O plexo coroide (PC), um tecido pouco estudado em neurociência, desempenha um papel fundamental na saúde e doença do sistema nervoso central. Este protocolo descreve uma técnica de microdissecção para isolamento do CP e o uso de microscopia eletrônica de varredura para obter uma visão global de sua estrutura celular.
Abstract
O plexo coroide (PC), uma estrutura altamente vascularizada que se projeta para os ventrículos do cérebro, é um dos tecidos mais pouco estudados na neurociência. Como está ficando cada vez mais claro que essa minúscula estrutura desempenha um papel crucial na saúde e na doença do sistema nervoso central (SNC), é de extrema importância dissecar adequadamente o PC para fora dos ventrículos cerebrais de uma forma que permita o processamento a jusante, desde a análise funcional até a estrutural. Aqui é descrito o isolamento da PC lateral e do quarto ventrículo cerebral de camundongos sem a necessidade de ferramentas ou equipamentos especializados. Essa técnica de isolamento preserva a viabilidade, a função e a estrutura das células dentro do PC. Devido à sua alta vascularização, o PC pode ser visualizado flutuando dentro das cavidades ventriculares do cérebro usando um microscópio binocular. Entretanto, a perfusão transcárdica necessária para análise a jusante pode dificultar a identificação do tecido do PC. Dependendo das etapas de processamento adicionais (por exemplo, análise de RNA e proteínas), isso pode ser resolvido visualizando o CP via perfusão transcárdica com azul de bromofenol. Após o isolamento, o PC pode ser processado usando várias técnicas, incluindo análise de RNA, proteína ou célula única, para obter maior compreensão sobre a função dessa estrutura cerebral especial. Aqui, a microscopia eletrônica de varredura (MEV) em todo o CP de montagem é usada para obter uma visão geral da estrutura.
Introduction
Barreiras apertadas separam o sistema nervoso central (SNC) da periferia, incluindo a barreira hematoencefálica (BHE) e a barreira sangue-líquido cefalorraquidiano (LCR). Essas barreiras protegem o SNC contra insultos externos e garantem um microambiente equilibrado e controlado 1,2,3. Embora a BHE tenha sido extensivamente estudada ao longo do tempo, a barreira sangue-LCR localizada no plexo coroide (CP) só ganhou crescente interesse de pesquisa durante a última década. Esta última barreira pode ser encontrada nos quatro ventrículos cerebrais (Figura 1A, B) e é caracterizada por uma única camada de células epiteliais do plexo coroide (ECP) ao redor de um estroma central, capilares vazados, fibroblastos e uma população de células linfoides e mieloides (Figura 1C)4,5,6. As células CPE estão firmemente interconectadas por tight junctions, evitando assim o vazamento dos capilares sanguíneos fenestrados subjacentes para o LCR e o cérebro. Além disso, o transporte através das células CPE é regulado por uma série de sistemas de transporte para dentro e para fora que gerenciam o influxo de compostos benéficos (por exemplo, nutrientes e hormônios) do sangue para o LCR e o efluxo de moléculas nocivas (por exemplo, resíduos metabólicos, excesso de neurotransmissores) na outra direção 1,6. Para poderem exercer sua função de transporte ativo, as células CPE contêm numerosas mitocôndrias em seu citoplasma7. Além disso, o PC é a principal fonte de LCR e atua como gatekeeper do cérebro pela presença de células inflamatóriasresidentes1. Devido à sua localização única entre o sangue e o cérebro, o PC também está perfeitamente posicionado para realizar vigilância imunológica8.
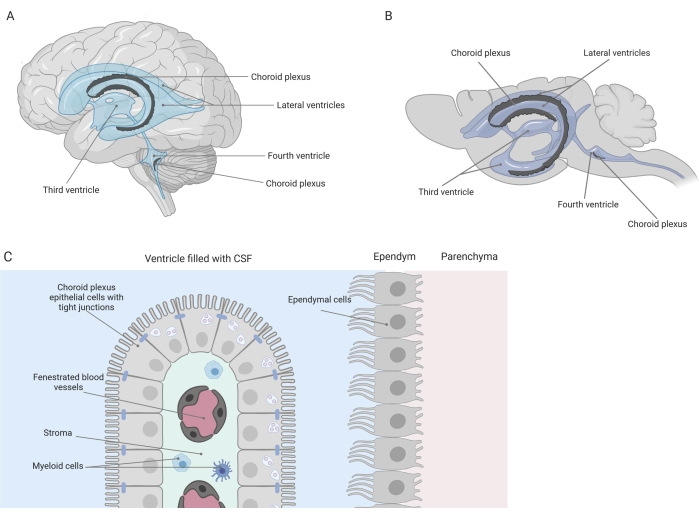
Figura 1: Visão geral esquemática da localização e composição do plexo coroide (PC). (A,B) O tecido CP é encontrado nos dois ventrículos laterais, o terceiro e o quarto ventrículos de (A) cérebro humano e (B) de camundongo. (C) O tecido do PC consiste de uma única camada de células do epitélio cuboidal do CP (EPC) firmemente conectadas ao redor de capilares fenestrados, tecido conjuntivo frouxo e células linfoides e mieloides, e forma a barreira hemato-liquórica (adaptada e modificada da referência23). Figura criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
Na última década, evidências crescentes, incluindo vários relatos de nosso grupo de pesquisa, têm revelado que a PC desempenha um papel central na saúde ena doença9,10,11,12,13,14,15,16,17,18 . Por exemplo, sabe-se que a barreira sangue-LCR do envelhecimento apresenta alterações morfológicas, entre outras, nos núcleos, microvilosidades e membrana basal 1,19. Além disso, no contexto da doença de Alzheimer, a integridade global da barreira está comprometida e todas essas mudanças relacionadas à idade parecem ser ainda mais pronunciadas 1,8,20. Além das alterações morfológicas, o transcriptoma, proteoma e secretoma da PC são alterados durante a doença 12,21,22,23. Assim, o conhecimento avançado da PC é essencial para melhor compreender seu papel nas doenças neurológicas e potencialmente desenvolver novas estratégias terapêuticas.
Um método eficiente para a microdissecção precisa do PC para fora dos ventrículos cerebrais é o primeiro passo inestimável para permitir a investigação adequada desta minúscula estrutura cerebral. Devido à sua natureza altamente vascularizada (Figura 2B), o CP flutuando dentro das cavidades ventriculares do encéfalo pode ser identificado por meio de um microscópio binocular. No entanto, a perfusão transcárdica é frequentemente necessária para análise a jusante, dificultando a identificação e o isolamento adequados do tecido do PC (Figura 2C). Se as etapas adicionais de processamento permitirem (por exemplo, no caso de análise de RNA e proteínas), o CP pode ser visualizado via perfusão transcárdica com azul de bromofenol (Figura 2A). Várias publicações já descrevem o isolamento do PC do cérebro de ratos24 e filhotes de camundongos25. Aqui, uma técnica de isolamento por microdissecção é descrita para isolar o PC de camundongos adultos. É importante ressaltar que essa técnica de isolamento preserva a viabilidade, a função e a estrutura das células dentro do PC. O isolamento do CP flutuando no quarto e nos ventrículos laterais é descrito aqui. Em suma, os camundongos são anestesiados terminalmente e, se necessário, perfundidos transcardialmente. No entanto, deve-se notar que a perfusão pode danificar a estrutura das células dentro do PC. Consequentemente, se a amostra for analisada usando microscopia eletrônica de transmissão (MET), microscopia eletrônica de varredura de face serial block (SBF-SEM) ou MEV por feixe de íons focalizado (MEV-FIB), a perfusão não deve ser realizada. Em seguida, todo o cérebro é isolado, e fórceps são usados para hemissectar sagitalmente o cérebro. A partir daí, os CPs que flutuam nos ventrículos laterais podem ser identificados e dissecados, enquanto os CP do quarto ventrículo podem ser isolados do lado cerebelar do cérebro.
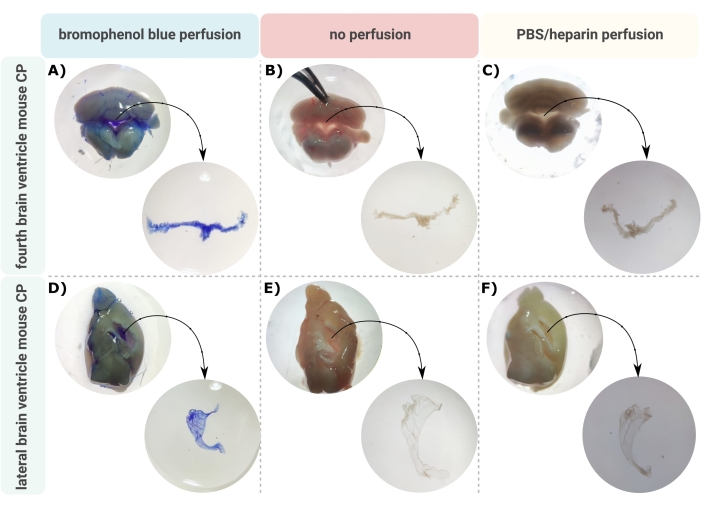
Figura 2: Visualização do plexo coroide (CP) do quarto e (D-F) ventrículo lateral (CP) após (A,D) perfusão com azul de bromofenol, (B,E) sem perfusão e (C,F) perfusão com PBS/heparina. As imagens são obtidas com estereomicroscópio (aumento de 8x-32x). Clique aqui para ver uma versão maior desta figura.
Uma vez que o PC é adequadamente dissecado para fora dos ventrículos cerebrais, todo um repertório de técnicas pode ser aplicado para obter maior compreensão sobre a função dessa estrutura. Por exemplo, citometria de fluxo ou sequenciamento de RNA de célula única podem ser realizados para quantificar e analisar fenotipicamente as células inflamatórias infiltrantes sob determinadas condições de doença26,27. Além da composição celular, a composição molecular do CP pode ser analisada para avaliar a presença de citocinas e quimiocinas via ensaio imunoenzimático (ELISA), immunoblot, ou através da análise simultânea de múltiplas citocinas utilizando o arranjo de esferas de citocinas28. Além disso, análises de transcriptoma, vascular, histologia de células imunes e secretoma podem ser realizadas nos explantes de CPmicrodissecados29. Aqui, a microscopia eletrônica de varredura (MEV) em CP de montagem inteira é usada para obter uma visão geral da estrutura do CP. O MEV usa um feixe de elétrons focalizados para varrer a superfície e criar uma imagem da topografia e composição da superfície. Como o comprimento de onda dos elétrons é muito menor do que o da luz, a resolução do MEV está na faixa nanométrica e é superior à de um microscópio de luz. Consequentemente, estudos morfológicos em nível subcelular podem ser realizados via MEV. Resumidamente, o CP dissecado é imediatamente transferido para um fixador contendo glutaraldeído para uma fixação noturna, seguida de osmicação e coloração com acetato de uranila. As amostras são então tratadas com coloração de aspartato de chumbo, desidratadas e, finalmente, incluídas para aquisição de imagens.
Assim, este protocolo facilita o isolamento eficiente do PC dos ventrículos cerebrais de camundongos, o que pode ser posteriormente analisado usando uma variedade de técnicas a jusante para investigar sua estrutura e função.
Protocol
Representative Results
Discussion
Aqui é descrito um método para isolar o plexo coroide (PC) do ventrículo lateral e do quarto ventrículo de um cérebro de camundongo. Todo esse método de montagem do CP facilita análises posteriores utilizando um repertório de técnicas para obter uma visão completa da morfologia, composição celular, transcriptoma, proteoma e secretoma do CP. Tais análises são cruciais para obter uma melhor compreensão dessa notável estrutura que se projeta dos ventrículos do cérebro. Esse conhecimento é de imenso intere…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pela Fundação Belga de Investigação da Alzheimer (SAO; número do projecto: 20200032), pela Fundação de Investigação da Flandres (FWO Vlaanderen; números do projecto: 1268823N, 11D0520N, 1195021N) e pelo Fundo Baillet Latour. Agradecemos ao VIB BioImaging Core pelo treinamento, suporte e acesso ao parque de instrumentos.
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

