Mikrodissektion och helmonterad svepelektronmikroskopi Visualisering av musplexus
Summary
Choroid plexus (CP), en understuderad vävnad inom neurovetenskap, spelar en nyckelroll i hälsa och sjukdom i centrala nervsystemet. Detta protokoll beskriver en mikrodissektionsteknik för att isolera CP och användningen av svepelektronmikroskopi för att få en övergripande bild av dess cellulära struktur.
Abstract
Choroid plexus (CP), en mycket vaskulariserad struktur som sticker ut i hjärnans ventriklar, är en av de mest understuderade vävnaderna inom neurovetenskap. Eftersom det blir allt tydligare att denna lilla struktur spelar en avgörande roll för hälsa och sjukdom i centrala nervsystemet (CNS), är det av yttersta vikt att korrekt dissekera CP ur hjärnkamrarna på ett sätt som möjliggör nedströms bearbetning, allt från funktionell till strukturell analys. Här beskrivs isolering av den laterala och fjärde hjärnventrikelmusen CP utan behov av specialverktyg eller utrustning. Denna isoleringsteknik bevarar livskraften, funktionen och strukturen hos celler inom CP. På grund av sin höga vaskularisering kan CP visualiseras flytande inuti hjärnans ventrikulära hålrum med hjälp av ett binokulärt mikroskop. Transkardiell perfusion som krävs för nedströmsanalys kan dock komplicera identifieringen av CP-vävnaden. Beroende på de ytterligare bearbetningsstegen (t.ex. RNA- och proteinanalys) kan detta lösas genom att visualisera CP via transkardiell perfusion med bromfenolblått. Efter isolering kan CP bearbetas med hjälp av flera tekniker, inklusive RNA, protein eller encellsanalys, för att få ytterligare förståelse för funktionen hos denna speciella hjärnstruktur. Här används svepelektronmikroskopi (SEM) på helmonterad CP för att få en helhetsbild av strukturen.
Introduction
Täta barriärer skiljer centrala nervsystemet (CNS) från periferin, inklusive blod-hjärnbarriären (BBB) och blod-cerebrospinalvätskebarriären (CSF). Dessa barriärer skyddar CNS mot yttre förolämpningar och säkerställer en balanserad och kontrollerad mikromiljö 1,2,3. Medan BBB har studerats omfattande över tiden har blod-CSF-barriären vid choroid plexus (CP) bara fått ökat forskningsintresse under det senaste decenniet. Denna senare barriär finns i hjärnans fyra ventriklar (figur 1A, B) och kännetecknas av ett enda lager av choroid plexus epitelceller (CPE) som omger ett centralt stroma, läckande kapillärer, fibroblaster och en lymfoid och myeloisk cellpopulation (figur 1C)4,5,6. CPE-cellerna är fast sammankopplade med snäva korsningar, vilket förhindrar läckage från de underliggande fenestrerade blodkapillärerna till CSF och hjärnan. Dessutom regleras transporten över CPE-cellerna av ett antal inåtgående och utgående transportsystem som hanterar inflödet av fördelaktiga föreningar (t.ex. näringsämnen och hormoner) från blodet till CSF och utflödet av skadliga molekyler (t.ex. metaboliskt avfall, överskott av neurotransmittorer) i andra riktningen 1,6. För att kunna utöva sin aktiva transportfunktion innehåller CPE-cellerna många mitokondrier i sin cytoplasma7. Dessutom är CP den viktigaste källan till CSF och fungerar som hjärnans portvakt genom närvaron av bosatta inflammatoriska celler1. På grund av sitt unika läge mellan blodet och hjärnan är CP också perfekt positionerat för att utföra immunövervakning8.
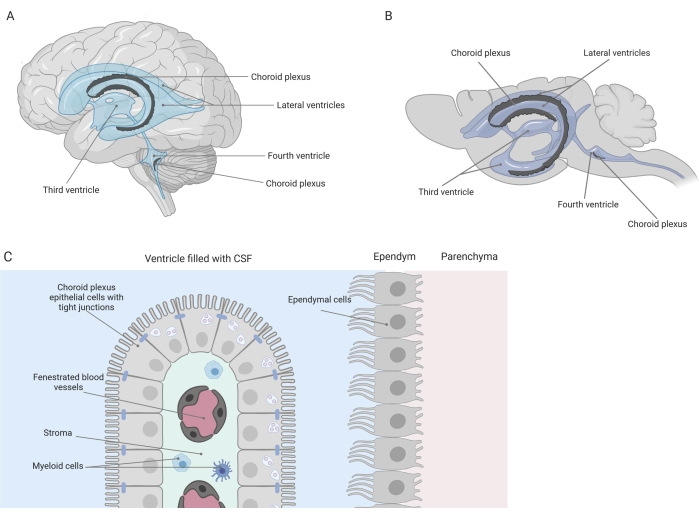
Figur 1: Schematisk översikt över placeringen och sammansättningen av choroid plexus (CP). (A,B) CP-vävnad finns i de två laterala, tredje och fjärde ventriklarna hos (A) mänskliga och (B) mushjärnor. (C) CP-vävnaden består av ett enda lager av tätt anslutna kuboidala CP-epitelceller (CPE) som omger fenestrerade kapillärer, lös bindväv och lymfoida och myeloida celler och bildar blod-cerebrospinalvätskebarriären (anpassad och modifierad från referens23). Figur skapad med Biorender.com. Klicka här för att se en större version av denna figur.
Under det senaste decenniet har ökande bevis, inklusive flera rapporter från vår forskargrupp, visat att CP spelar en central roll i hälsa och sjukdom 9,10,11,12,13,14,15,16,17,18 . Det är till exempel känt att den åldrande blod-CSF-barriären uppvisar morfologiska förändringar i bland annat kärnorna, mikrovillierna och basalmembranet 1,19. Dessutom, i samband med Alzheimers sjukdom, äventyras den övergripande barriärintegriteten och alla dessa åldersrelaterade förändringar verkar vara ännu mer uttalade 1,8,20. Förutom morfologiska förändringar förändras transkriptomet, proteomet och sekretomet i CP under sjukdom 12,21,22,23. Således är avancerad kunskap om CP avgörande för att bättre förstå dess roll i neurologiska sjukdomar och potentiellt utveckla nya terapeutiska strategier.
En effektiv metod för exakt mikrodissektion av CP ur hjärnkamrarna är det första ovärderliga steget för att möjliggöra korrekt undersökning av denna lilla hjärnstruktur. På grund av sin mycket vaskulariserade natur (figur 2B) kan CP som flyter inuti hjärnans ventrikulära hålrum identifieras med hjälp av ett binokulärt mikroskop. Transkardiell perfusion krävs emellertid ofta för nedströmsanalys, vilket komplicerar korrekt identifiering och isolering av CP-vävnaden (figur 2C). Om de ytterligare bearbetningsstegen tillåter (t.ex. vid RNA- och proteinanalys) kan CP visualiseras via transkardiell perfusion med bromfenolblått (figur 2A). Flera publikationer beskriver redan isoleringen av CP från råtta24 och musvalphjärnor25. Här beskrivs en isoleringsteknik för mikrodissektion för att isolera CP från vuxna möss. Det är viktigt att denna isoleringsteknik bevarar livskraften, funktionen och strukturen hos cellerna i CP. Isoleringen av CP som flyter i fjärde och laterala ventriklarna beskrivs här. Kort sagt, mössen är terminalt bedövade och vid behov transcardially perfuserade. Det bör dock noteras att perfusion kan skada cellernas struktur inom CP. Om provet ska analyseras med transmissionselektronmikroskopi (TEM), seriell blockytsvepelektronmikroskopi (SBF-SEM) eller fokuserad jonstråle SEM (FIB-SEM), bör perfusion därför inte utföras. Därefter isoleras hela hjärnan, och pincett används för att sagittalt hemisect hjärnan. Härifrån kan CP som flyter i laterala ventriklarna identifieras och dissekeras, medan CP från den fjärde ventrikeln kan isoleras från hjärnans cerebellära sida.
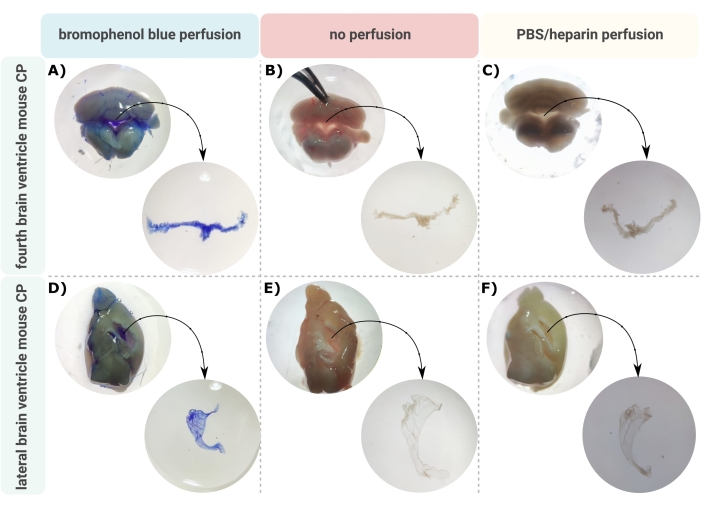
Figur 2: Visualisering av (A-C) fjärde och (D-F) laterala ventrikeln choroid plexus (CP) efter (A,D) bromfenolblå perfusion, (B,E) ingen perfusion och (C,F) perfusion med PBS/heparin. Bilderna är tagna med ett stereomikroskop (8x-32x förstoring). Klicka här för att se en större version av denna figur.
När CP är korrekt dissekerad ur hjärnkamrarna kan en hel repertoar av tekniker tillämpas för att få ytterligare förståelse för funktionen av denna struktur. Till exempel kan flödescytometri eller encells-RNA-sekvensering utföras för att kvantifiera och fenotypiskt analysera de infiltrerande inflammatoriska cellerna under vissa sjukdomstillstånd26,27. Förutom den cellulära sammansättningen kan CP: s molekylära sammansättning analyseras för att bedöma närvaron av cytokiner och kemokiner via enzymkopplad immunosorbentanalys (ELISA), immunoblot eller genom samtidig analys av flera cytokiner med användning av cytokinpärlmatrisen28. Dessutom kan transkriptom-, kärl-, immuncellshistologi- och sekretomanalyser utföras på de mikrodissekerade CP-explanterna29. Här används svepelektronmikroskopi (SEM) på helmonterad CP för att få en helhetsbild av CP-strukturen. SEM använder en stråle av fokuserade elektroner för att skanna över ytan och skapa en bild av ytans topografi och sammansättning. Eftersom elektronernas våglängd är mycket mindre än ljusets är upplösningen av SEM i nanometerområdet och överlägsen den för ett ljusmikroskop. Följaktligen kan morfologiska studier på subcellulär nivå utföras via SEM. Kortfattat överförs den dissekerade CP omedelbart till ett glutaraldehydinnehållande fixeringsmedel för en fixering över natten, följt av osmication och uranylacetatfärgning. Proverna behandlas sedan med blyaspartatfläck, dehydreras och slutligen inbäddas för avbildning.
Således underlättar detta protokoll effektiv isolering av CP från mushjärnventriklarna, vilket kan analyseras ytterligare med hjälp av en mängd olika nedströmstekniker för att undersöka dess struktur och funktion.
Protocol
Representative Results
Discussion
Här beskrivs en metod för att isolera plexus choroid plexus (CP) ur laterala ventrikeln och den fjärde ventrikeln i en mushjärna. Hela denna monteringsmetod för CP underlättar ytterligare analys med hjälp av en repertoar av tekniker för att få en fullständig bild av CP-morfologin, cellulär sammansättning, transkriptom, proteom och sekretom. Sådana analyser är avgörande för att få en bättre förståelse för denna anmärkningsvärda struktur som sticker ut från hjärnans ventriklar. Denna kunskap är av…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av den belgiska stiftelsen för Alzheimerforskning (SAO; projektnummer: 20200032), Research Foundation Flanders (FWO Vlaanderen; projektnummer: 1268823N, 11D0520N, 1195021N) och Baillet Latour Fund. Vi tackar VIB BioImaging Core för utbildning, support och tillgång till instrumentparken.
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

