Mikrodisseksjon og helmontert skanning elektronmikroskopi visualisering av mus choroid plexus
Summary
Choroid plexus (CP), et understudert vev i nevrovitenskap, spiller en nøkkelrolle i helse og sykdom i sentralnervesystemet. Denne protokollen beskriver en mikrodisseksjonsteknikk for å isolere CP og bruk av skanningelektronmikroskopi for å få en samlet oversikt over dens cellulære struktur.
Abstract
Choroid plexus (CP), en svært vaskularisert struktur som stikker ut i hjernens ventrikler, er et av de mest understuderte vevene i nevrovitenskap. Ettersom det blir stadig tydeligere at denne lille strukturen spiller en avgjørende rolle i helse og sykdom i sentralnervesystemet (CNS), er det av største betydning å dissekere CP riktig ut av hjerneventriklene på en måte som tillater nedstrøms behandling, alt fra funksjonell til strukturell analyse. Her beskrives isolering av lateral og fjerde hjerneventrikkelmus CP uten behov for spesialiserte verktøy eller utstyr. Denne isolasjonsteknikken bevarer levedyktigheten, funksjonen og strukturen til celler i CP. På grunn av sin høye vaskularisering kan CP visualiseres flytende inne i hjernens ventrikulære hulrom ved hjelp av et kikkertmikroskop. Imidlertid kan transkardial perfusjon som kreves for nedstrøms analyse komplisere identifiseringen av CP-vevet. Avhengig av de videre behandlingstrinnene (f.eks. RNA og proteinanalyse), kan dette løses ved å visualisere CP via transkardial perfusjon med bromfenolblått. Etter isolasjon kan CP behandles ved hjelp av flere teknikker, inkludert RNA, protein eller enkeltcelleanalyse, for å få ytterligere forståelse av funksjonen til denne spesielle hjernestrukturen. Her brukes skanning elektronmikroskopi (SEM) på hele mount CP for å få en samlet oversikt over strukturen.
Introduction
Tette barrierer skiller sentralnervesystemet (CNS) fra periferien, inkludert blod-hjernebarrieren (BBB) og blod-cerebrospinalvæsken (CSF) barrieren. Disse barrierene beskytter CNS mot eksterne fornærmelser og sikrer et balansert og kontrollert mikromiljø 1,2,3. Mens BBB har blitt grundig studert over tid, har blod-CSF-barrieren som ligger ved choroid plexus (CP) bare fått økende forskningsinteresse i løpet av det siste tiåret. Denne sistnevnte barrieren finnes i hjernens fire ventrikler (figur 1A, B) og er preget av et enkelt lag av choroid plexus epitelceller (CPE) som omgir en sentral stroma, lekkende kapillærer, fibroblaster og en lymfoid og myeloid cellepopulasjon (figur 1C) 4,5,6. CPE-cellene er godt forbundet med stramme kryss, og forhindrer dermed lekkasje fra de underliggende fenestrerte blodkapillærene inn i CSF og hjernen. I tillegg reguleres transport over CPE-cellene av en rekke transportsystemer innover og utover som styrer tilstrømningen av gunstige forbindelser (f.eks. næringsstoffer og hormoner) fra blodet til CSF og utstrømningen av skadelige molekyler (f.eks. metabolsk avfall, overflødige nevrotransmittere) i den andre retningen 1,6. For å kunne utøve sin aktive transportfunksjon inneholder CPE-cellene mange mitokondrier i deres cytoplasma7. Videre er CP den viktigste kilden til CSF og fungerer som gatekeeper av hjernen ved tilstedeværelse av bosatt inflammatoriske celler1. På grunn av sin unike beliggenhet mellom blodet og hjernen, er CP også perfekt posisjonert for å utføre immunovervåking8.
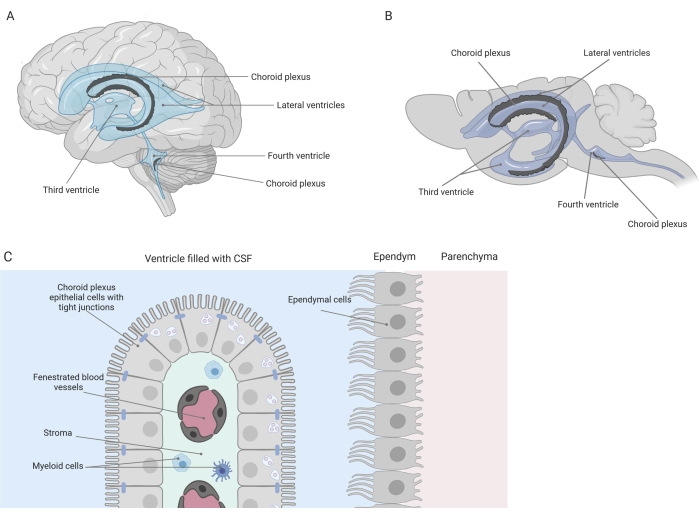
Figur 1 Skjematisk oversikt over lokalisasjon og sammensetning av choroid plexus (CP). (A,B) CP-vev finnes i de to laterale, tredje og fjerde ventriklene til (A) menneskelige og (B) musehjerner. (C) CP-vevet består av et enkelt lag av tett koblede kuboidale CP-epitelceller (CPE) som omgir fenestrerte kapillærer, løst bindevev og lymfoide og myeloide celler, og danner blod-cerebrospinalvæskebarrieren (tilpasset og modifisert fra referanse23). Figur opprettet med Biorender.com. Klikk her for å se en større versjon av denne figuren.
I løpet av det siste tiåret har økende bevis, inkludert flere rapporter fra vår forskningsgruppe, avslørt at CP spiller en sentral rolle i helse og sykdom 9,10,11,12,13,14,15,16,17,18 . For eksempel er det kjent at den aldrende blod-CSF-barrieren viser morfologiske endringer i blant annet kjernene, mikrovilli og kjellermembranen 1,19. I tillegg, i sammenheng med Alzheimers sykdom, er den generelle barriereintegriteten kompromittert, og alle disse aldersrelaterte endringene ser ut til å være enda mer uttalt 1,8,20. I tillegg til morfologiske endringer endres transkriptomet, proteomet og sekretomet til CP under sykdom 12,21,22,23. Dermed er avansert kunnskap om CP avgjørende for å bedre forstå sin rolle i nevrologiske sykdommer og potensielt utvikle nye terapeutiske strategier.
En effektiv metode for nøyaktig mikrodisseksjon av CP ut av hjerneventriklene er det første uvurderlige skrittet for å tillate riktig undersøkelse av denne lille hjernestrukturen. På grunn av sin sterkt vaskulariserte natur (figur 2B) kan CP som flyter inne i hjernens ventrikulære hulrom identifiseres ved hjelp av et kikkertmikroskop. Imidlertid er transkardial perfusjon ofte nødvendig for nedstrømsanalyse, noe som kompliserer riktig identifisering og isolering av CP-vevet (figur 2C). Hvis de videre behandlingstrinnene tillater det (f.eks. ved RNA- og proteinanalyse), kan CP visualiseres via transkardial perfusjon med bromfenolblått (figur 2A). Flere publikasjoner beskriver allerede isoleringen av CP fra rotte24 og musevalpehjerner25. Her beskrives en mikrodisseksjonsisolasjonsteknikk for å isolere CP fra voksne mus. Det er viktig at denne isolasjonsteknikken bevarer levedyktigheten, funksjonen og strukturen til cellene i CP. Isoleringen av CP flytende i fjerde og laterale ventrikler er beskrevet her. Kort sagt, musene er terminalt bedøvet og om nødvendig transkardialt perfusert. Det skal imidlertid bemerkes at perfusjon kan skade strukturen til cellene i CP. Følgelig, hvis prøven skal analyseres ved hjelp av transmisjonselektronmikroskopi (TEM), seriell blokk ansiktsskanning elektronmikroskopi (SBF-SEM), eller fokusert ionstråle SEM (FIB-SEM), bør perfusjon ikke utføres. Deretter isoleres hele hjernen, og tang brukes til å sagittalt hemisect hjernen. Herfra kan CP-ene som flyter i laterale ventrikler identifiseres og dissekeres, mens CP fra fjerde ventrikkel kan isoleres fra hjernesiden.
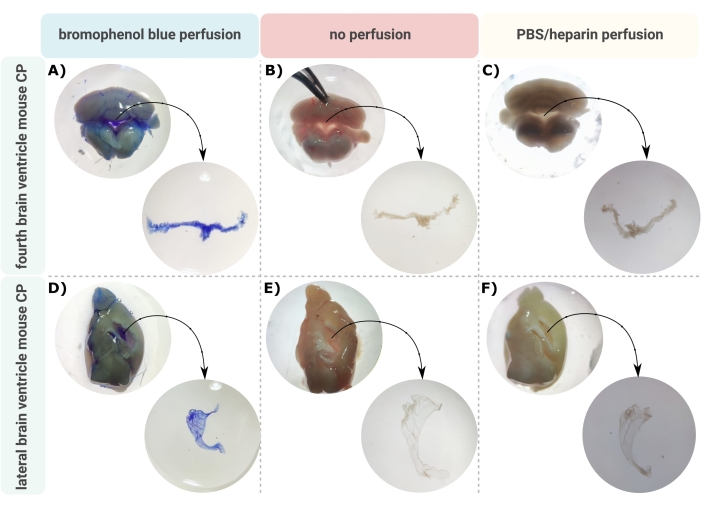
Figur 2 Visualisering av (A-C) fjerde og (D-F) laterale ventrikkel choroid plexus (CP) etter (A,D) bromfenolblå perfusjon, (B,E) ingen perfusjon og (C,F) perfusjon med PBS/heparin. Bildene er tatt med stereomikroskop (8x-32x forstørrelse). Klikk her for å se en større versjon av denne figuren.
Når CP er riktig dissekert ut av hjerneventriklene, kan et helt repertoar av teknikker brukes for å få ytterligere forståelse av funksjonen til denne strukturen. For eksempel kan flowcytometri eller enkeltcelle RNA-sekvensering utføres for å kvantifisere og fenotypisk analysere de infiltrerende inflammatoriske cellene under visse sykdomstilstander26,27. I tillegg til den cellulære sammensetningen kan den molekylære sammensetningen av CP analyseres for å vurdere tilstedeværelsen av cytokiner og kjemokiner via enzymbundet immunosorbentanalyse (ELISA), immunoblot, eller gjennom samtidig analyse av flere cytokiner ved bruk av cytokinperlematrisen28. Videre kan transkriptom-, vaskulær-, immuncellehistologi- og sekretomanalyser utføres på de mikrodissekerte CP-eksplantene29. Her brukes skanning elektronmikroskopi (SEM) på hele mount CP for å få en samlet oversikt over CP-strukturen. SEM bruker en stråle av fokuserte elektroner til å skanne over overflaten og skape et bilde av overflatens topografi og sammensetning. Siden bølgelengden til elektroner er mye mindre enn lyset, er oppløsningen av SEM i nanometerområdet og overlegen til et lysmikroskop. Følgelig kan morfologiske studier på subcellulært nivå utføres via SEM. Kort fortalt overføres den dissekerte CP umiddelbart til et glutaraldehydholdig fikseringsmiddel for en fiksering over natten, etterfulgt av osmikyring og uranylacetatfarging. Prøvene blir deretter behandlet med bly aspartat flekk, dehydrert, og til slutt innebygd for avbildning.
Dermed letter denne protokollen effektiv isolering av CP fra musens hjerneventrikler, som kan analyseres videre ved hjelp av en rekke nedstrøms teknikker for å undersøke dens struktur og funksjon.
Protocol
Representative Results
Discussion
Her beskrives en metode for å isolere choroid plexus (CP) ut av lateral ventrikkel og fjerde ventrikkel i en musehjerne. Hele denne monteringsmetoden til CP muliggjør videre analyse ved hjelp av et repertoar av teknikker for å få en fullstendig oversikt over CP-morfologi, cellulær sammensetning, transkriptom, proteom og sekretom. Slike analyser er avgjørende for å få en bedre forståelse av denne bemerkelsesverdige strukturen som stikker ut fra hjernens ventrikler. Denne kunnskapen er av enorm forskningsinteresse…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av Belgian Foundation of Alzheimer’s Research (SAO; prosjektnummer: 20200032), Research Foundation Flanders (FWO Vlaanderen; prosjektnummer: 1268823N, 11D0520N, 1195021N) og Baillet Latour Fund. Vi takker VIB BioImaging Core for opplæring, support og tilgang til instrumentparken.
Materials
| 26G x 1/2 needle | Henke Sass Wolf | 4710004512 | |
| Aluminium specimen mounts | EM Sciences | 75220 | |
| Cacodylate buffer | EM Sciences | 11652 | |
| Carbon steel surgial blades | Swann-Morton | 0210 | size: 0.45 mm x 12 mm |
| Carbon adhesive tabs -12 mm | EM Sciences | 77825-12 | |
| Critical point dryer | Bal-Tec | CPD030 | |
| Crossbeam 540 | Zeiss | SEM system | |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Glutaraldehyde | EM Sciences | 16220 | |
| Heparin | Sigma-Aldrich | H-3125 | |
| Ismatec Reglo ICC Digital Peristaltic pump 2-channel | Metrohm Belgium N.V | CPA-7800160 | |
| Osmium Tetroxide | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Phosphate buffered saline (PBS) | Lonza | BE17-516F | |
| Platinum | Quorum | Q150T ES | PBS without Ca++ Mg++ or phenol red; sterile filtered |
| Sodium pentobarbital | Kela NV | 514 | |
| Specimen Basket Stainless Steel | EM Sciences | 70190-01 | |
| Stemi DV4 Stereo microscope | Zeiss | ||
| Surgical scissors | Fine Science Tools GmbH | 91460-11 |
References
- Vandenbroucke, R. E. A hidden epithelial barrier in the brain with a central role in regulating brain homeostasis. Implications for aging. Annals of the American Thoracic Society. 13, 407-410 (2016).
- Engelhardt, B., Sorokin, L. The blood-brain and the blood-cerebrospinal fluid barriers: function and dysfunction. Seminars in Immunopathology. 31 (4), 497-511 (2009).
- Engelhardt, B., Wolburg-Buchholz, K., Wolburg, H. Involvement of the choroid plexus in central nervous system inflammation. Microscopy Research and Technique. 52 (1), 112-129 (2001).
- Engelhardt, B., Vajkoczy, P., Weller, R. O. The movers and shapers in immune privilege of the CNS. Nature Immunology. 18 (2), 123-131 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins. FEBS Letters. 588 (8), 1259-1270 (2014).
- Strazielle, N., Ghersi-Egea, J. F. Physiology of blood-brain interfaces in relation to brain disposition of small compounds and macromolecules. Molecular Pharmaceutics. 10 (5), 1473-1491 (2013).
- Redzic, Z. B., Segal, M. B. The structure of the choroid plexus and the physiology of the choroid plexus epithelium. Advanced Drug Delivery Reviews. 56 (12), 1695-1716 (2004).
- Kratzer, I., Ek, J., Stolp, H. The molecular anatomy and functions of the choroid plexus in healthy and diseased brain. Biochimica et Biophysica Acta-Biomembranes. 1862 (11), 183430 (2020).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Clinical implications of leukocyte infiltration at the choroid plexus in (neuro)inflammatory disorders. Drug Discovery Today. 20 (8), 928-941 (2015).
- Brkic, M., et al. Amyloid βoligomers disrupt blood-CSF barrier integrity by activating matrix metalloproteinases. Journal of Neuroscience. 35 (37), 12766-12778 (2015).
- Vandenbroucke, R. E., et al. Matrix metalloprotease 8-dependent extracellular matrix cleavage at the blood-CSF barrier contributes to lethality during systemic inflammatory diseases. Journal of Neuroscience. 32 (29), 9805-9816 (2012).
- Marques, F., et al. The choroid plexus response to a repeated peripheral inflammatory stimulus. BMC Neuroscience. 10, 135 (2009).
- Marques, F., et al. The choroid plexus in health and in disease: dialogues into and out of the brain. Neurobiology of Disease. 107, 32-40 (2017).
- Lun, M. P., Monuki, E. S., Lehtinen, M. K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nature Reviews Neuroscience. 16 (8), 445-457 (2015).
- Spector, R., Keep, R. F., Snodgrass, S. R., Smith, Q. R., Johanson, C. E. A balanced view of choroid plexus structure and function: Focus on adult humans. Experimental Neurology. 267, 78-86 (2015).
- Lehtinen, M. K., et al. The choroid plexus and cerebrospinal fluid: emerging roles in development, disease, and therapy. Journal of Neuroscience. 33 (45), 17553-17559 (2013).
- Balusu, S., Brkic, M., Libert, C., Vandenbroucke, R. E. The choroid plexus-cerebrospinal fluid interface in Alzheimer’s disease: more than just a barrier. Neural Regeneration Research. 11 (4), 534-537 (2016).
- Demeestere, D., Libert, C., Vandenbroucke, R. E. Therapeutic implications of the choroid plexus-cerebrospinal fluid interface in neuropsychiatric disorders. Brain, Behavior, and Immunity. 50, 1-13 (2015).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta-Molecular Basis of Disease. 1862 (3), 442-451 (2016).
- Serot, J. M., Zmudka, J., Jouanny, P. A possible role for CSF turnover and choroid plexus in the pathogenesis of late onset Alzheimer’s disease. Journal of Alzheimer’s Disease. 30 (1), 17-26 (2012).
- Marques, F., et al. Altered iron metabolism is part of the choroid plexus response to peripheral inflammation. Endocrinology. 150 (6), 2822-2828 (2009).
- Thouvenot, E., et al. The proteomic analysis of mouse choroid plexus secretome reveals a high protein secretion capacity of choroidal epithelial cells. Proteomics. 6 (22), 5941-5952 (2006).
- Vandendriessche, C., et al. Importance of extracellular vesicle secretion at the blood-cerebrospinal fluid interface in the pathogenesis of Alzheimer’s disease. Acta Neuropathologica Communications. 9 (1), 143 (2021).
- Bowyer, J. F., et al. A visual description of the dissection of the cerebral surface vasculature and associated meninges and the choroid plexus from rat brain. Journal of Visualized Experiments. (69), e4285 (2012).
- Inoue, T., Narita, K., Nonami, Y., Nakamura, H., Takeda, S. Observation of the ciliary movement of choroid plexus epithelial cells ex vivo. Journal of Visualized Experiments. (101), e52991 (2015).
- Dani, N., et al. A cellular and spatial map of the choroid plexus across brain ventricles and ages. Cell. 184 (11), 3056-3074 (2021).
- Carloni, S., et al. Identification of a choroid plexus vascular barrier closing during intestinal inflammation. Science. 374 (6566), 439-448 (2021).
- Van Hoecke, L., et al. Involvement of the choroid plexus in the pathogenesis of Niemann-Pick disease type. C. Frontiers in Cell Neuroscience. 15, 757482 (2021).
- Shipley, F. B., et al. Tracking calcium dynamics and immune surveillance at the choroid plexus blood-cerebrospinal fluid interface. Neuron. 108 (4), 623-639 (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. Journal of Visualized Experiments. (150), e59480 (2019).
- JoVE. Scanning Electron Microscopy (SEM). JoVE Science Education Database. , (2022).
- Pauwels, M., et al. Choroid plexus derived extracelular vesicles exhibit brain targeting characteristics). Biomaterials. 290, 121830 (2022).

