Avaliação in vitro e in vivo de compostos biologicamente ativos fotocontrolados - potenciais candidatos a fármacos para a fotofarmacologia do câncer
Summary
Este protocolo apresenta um conjunto de experimentos adotados para a avaliação de peptídeos anticâncer fotocomutáveis, que podem ser utilizados na triagem pré-clínica destes compostos. Isso inclui a avaliação da citotoxicidade em culturas de células 2D e 3D, a avaliação da eficiência de fotoisomerização ex vivo (tecido modelo) e a eficácia in vivo .
Abstract
Compostos biologicamente ativos fotocontrolados são uma classe emergente de candidatos a drogas “inteligentes”. Eles fornecem segurança adicional na quimioterapia sistêmica devido à sua ativação espaço-temporal precisa, direcionando uma luz benigna não ionizável para um local específico dentro do corpo do paciente. Este trabalho apresenta um conjunto de métodos para avaliar a potência in vitro e a eficiência ex vivo da fotoativação de compostos biologicamente ativos fotocontrolados, bem como a eficácia in vivo nos estágios iniciais do desenvolvimento de fármacos. A metodologia é aplicada a peptídeos citotóxicos anticâncer, ou seja, os análogos contendo diarileteno de um antibiótico conhecido, a gramicidina S. Os experimentos são realizados usando culturas de células 2D (células aderentes) e 3D (esferoides) de uma linhagem de células cancerosas (Lewis lung carcinoma, LLC), substitutos de tecidos vivos (carne de porco picada) e um modelo de câncer aloenxerto (LLC subcutâneo) em camundongos imunocompetentes. A seleção dos compostos mais eficazes e a estimativa de janelas fototerapêuticas realísticas são realizadas através de microscopia de fluorescência automatizada. A eficiência de fotoativação em diferentes regimes de iluminação é determinada em diferentes profundidades em um tecido modelo, e a dose ótima de luz é aplicada no experimento terapêutico final in vivo .
Introduction
Compostos biologicamente ativos fotocontrolados têm emergido nas últimas décadas como um componente promissor de quimioterapias seguras para doenças humanas e especificamente para erradicar tumores sólidosmalignos1. Estes compostos contêm fragmentos reversivelmente fotoisorizáveis (fotointerruptores moleculares) e podem alternar entre fotoisômeros inativos e ativos após irradiação com luz de diferentes comprimentos de onda.
Em comparação com seus análogos não fotocontroláveis, os medicamentos fotocontrolados podem ser mais seguros porque podem ser introduzidos sistemicamente no corpo do paciente em formas menos ativas e essencialmente não tóxicas, e são ativados pela luz apenas quando necessário, como em tumores, úlceras e feridas. Embora múltiplas demonstrações empolgantes desses protótipos de fármacos moleculares possam ser encontradas em trabalhos acadêmicos recentes2,3,4,5,6,7, o campo da fotofarmacologia clínica – uma aplicação de combinações aprovadas, fármaco/dispositivo médico/doença – não existe. A fotofarmacologia ainda está em fase de descoberta de fármacos, e estudos pré-clínicos sistemáticos são desconhecidos.
Apenas muito recentemente demonstramos a vantagem de segurança in vivo para alguns peptídeos anticâncer fotocontrolados, a saber, os análogos do antibiótico peptídeo gramicidina S8. Esses derivados fotocontrolados contêm um fotointerruptor de diarileteno (DAE), que sofre transformações fotoinduzidas reversíveis entre as chamadas fotoformas “anel-aberto” gerado pela luz vermelha e “anel-fechado” gerado pelos raios UV (ilustrado na Figura 1 para um dos derivados, o composto LMB002).
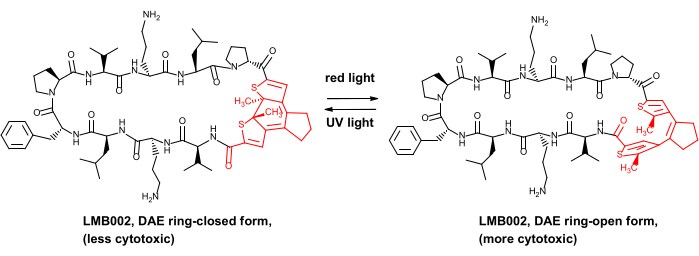
Figura 1: Peptídeo citotóxico fotocontrolado LMB002 e sua fotoisomerização. O fragmento de diarileteno é mostrado em vermelho. Abreviação: DAE = diarylethene. Clique aqui para ver uma versão maior desta figura.
A busca de acertos e a otimização hit-to-lead geralmente requerem a triagem in vitro e in vivo de bibliotecas de compostos apropriadas 9,10. Aqui, demonstramos uma metodologia adequada para a triagem sistemática de alta produtividade da citotoxicidade de compostos fotocontrolados. Também determinamos a eficiência da fotoisomerização, estimamos a dose de luz nos tecidos modelo e avaliamos a eficácia in vivo dos candidatos com melhor desempenho. A abordagem está de acordo com as considerações de bioética e cuidados com os animais.
Neste trabalho, métodos pré-clínicos tradicionais são modificados para evitar a fotoisomerização não controlada dos compostos testados. O objetivo geral da aplicação desses métodos modificados aqui é desenvolver uma estratégia geral que seja direta e rápida e produza dados estatisticamente significativos para comparar de forma confiável as atividades in vitro e racionalizar os testes de eficácia in vivo de compostos fotocomutáveis para identificação e desenvolvimento de chumbo.
A estratégia consiste em três etapas consecutivas. A primeira etapa envolve a determinação de CI 50 (viabilidade celular aparente de50 %) em diluições seriadas para fotoformas ativas e inativas de compostos biologicamente ativos fotocontrolados selecionados usando culturas de células bidimensionais (2D, monocamada) e tridimensionais (3D, esferoide) e microscopia de fluorescência automatizada confocal de alto rendimento. Janelas fototerapêuticas são comparadas em relação à diferença de CI50 entre as duas fotoformas, e os candidatos com melhor desempenho são selecionados. Não há vantagem específica na avaliação da toxicidade por microscopia automatizada e outras plataformas de triagem de citotoxicidade (ensaios)11; Modelos tumorais celulares maiscomplexos12 poderiam ser facilmente implementados nessa fase.
Para os compostos selecionados na etapa 1, o segundo passo é estimar realisticamente sua eficiência de fotocomutação dentro dos tecidos em função da profundidade da superfície do tecido irradiado, quantificando a eficiência de fotocomutação das fotoformas menos ativas em um substituto de tecido usando cromatografia líquida de alta eficiência (HPLC) detectada por UV de extratos de amostras irradiadas. In vivo , a eficiência da fototroca poderia ser estudada, mas propomos usar um substituto de tecido simples – carne de porco picada. Testamos a validade dessa abordagem. Medimos a conversão de nossos compostos fotocomutáveis in vivo em um modelo de câncer de camundongos e observamos aproximadamente a mesma fotoconversão em uma profundidade medida em experimentos anteriores com camundongos8. Qualquer tecido artificial alternativo adequado13, tecido/órgão bioimpresso 3D14, materiais de biópsia ou outro material animal isento poderia ser usado. No entanto, essa configuração é um bom compromisso, pois é econômica, rápida e ética.
O terceiro passo é a determinação da eficácia anticâncer in vivo em um modelo de câncer murino. Os compostos que demonstram características superiores nos experimentos in vitro e fotocomutação eficiente a uma profundidade de pelo menos 1-1,5 cm nos tecidos modelo são selecionados para este experimento.
Este protocolo pode ser aplicado a compostos que possuam diferentes tipos de fotointerruptores, desde que suas fotoformas (ou seus estados fotoestacionários, PSS) sejam estáveis por um tempo razoável (alguns dias ou mais). Para ilustração, um LMB002 derivado do DAE descrito anteriormente é usado15. Os fotofórmios LMB002 são termicamente estáveis e podem ser armazenados a -20 °C por pelo menos um ano sem degradação substancial. As células do carcinoma pulmonar de Lewis (LLC) são escolhidas para esta demonstração in vitro e in vivo, mas nenhuma restrição é imposta ao tipo celular. As células LLC são aderentes, prontamente cultiváveis em 3D e usadas para gerar tumoróides (como descrito na referência16). In vivo As células LLC são usadas para modelar processos metastáticos e podem facilmente gerar tumores sólidos em camundongos imunocompetentes após injeção subcutânea. Essa metodologia in vivo pode ser aplicada universalmente a outros modelos de câncer17,18. A implementação detalhada desta estratégia é descrita a seguir.
Protocol
Representative Results
Discussion
Compostos fotocontrolados são inéditos no desenvolvimento de fármacos; entretanto, nenhum método foi estabelecido para sua avaliação pré-clínica e clínica. O análogo mais próximo da monoterapia, a terapia fotodinâmica (TFD), é a modalidade de tratamento para uso clínico adotada por muitos países contra o câncer e está em desenvolvimento para outras indicações19,20. Assim como a fotofarmacologia, a TFD também se baseia no uso da luz para ativar a substância bioativa (oxigênio singlete). Portanto, alguns métodos experimentais utilizados para estudos pré-clínicos e clínicos na TFD podem ser adotados para a fotofarmacologia. Por exemplo, fontes de luz, abordagens de fornecimento de luz e dispositivos médicos são bem desenvolvidos e aprovados para TFD; Eles podem ser usados diretamente para a avaliação de drogas fotocontroladas. Entretanto, a TFD e a fotofarmacologia têm muitas distinções entre si4, o que justifica a necessidade de estabelecer métodos específicos para esta última.
Primeiro, a substância não ativada na TFD (oxigênio) está sempre presente nos tecidos vivos em concentrações não tóxicas. Por outro lado, compostos biologicamente ativos fotocontrolados não ativados podem ter atividade residual e toxicidade indesejada. Portanto, os fármacos fotofarmacológicos ideais devem ter atividade biológica minimizada em sua forma administrada e devem ser altamente ativos em sua forma gerada pela luz, a “janela fototerapêutica”21 deve ser a maior possível. Encontrar o acerto e realizar a otimização hit-to-lead requer a identificação de compostos adequados e a triagem de bibliotecas relativamente grandes, já em estágios iniciais de desenvolvimento de medicamentos. Aqui, nós propusemos uma microscopia fluorescente confocal automatizada de alto rendimento para identificar compostos de fotocomutação eficientes.
O método escolhido de avaliação da citotoxicidade permite fácil implementação do requisito mais crítico – manutenção do PSS ou estabilidade do fotoisômero visível-sensível à luz. Isso porque, ao ser implementada, a exposição à luz é minimizada. Assim, ao selecionar métodos alternativos, os automatizados devem ser preferidos. Essa abordagem é confiável e informativa. O uso de culturas de células 3D (esferoides) nesta fase fornece uma compreensão holística da resposta da célula ao tratamento em um microambiente tecidual mais realista. Além disso, informações valiosas sobre o mecanismo de ação dos compostos podem ser obtidas usando a microscopia como método direto. A microscopia confocal fluorescente com protocolo de coloração adequado permite a avaliação visual da morfologia das células e esferoides; Detalhes importantes sobre a morte celular e alterações no interior das células também podem ser detectados.
Em segundo lugar, a aplicação de luz requer uma escolha cuidadosa da dosagem de luz. Na TFD, a superdosagem de luz é extremamente prejudicial aos tecidos22. A terapia fotofarmacológica pode ser vantajosa sob irradiação excessiva de luz. O limite superior da substância ativada é definido pela dose administrada da substância não ativada e sua farmacocinética. No entanto, a dosagem de luz ainda é um problema na fotofarmacologia. Deve-se tomar cuidado para garantir que a densidade de potência irradiante e o tempo de exposição não sejam inferiores ao necessário para a terapia. Em princípio, a geração da substância ativada pode ser monitorada in vivo. No entanto, por razões bioéticas, propusemos um experimento com um tecido modelo (carne picada fresca) misturado com o composto não ativado15. Este experimento é simples e pode ser modificado para usar diferentes fontes de luz. Também pode ser adaptado para a estimativa fotofísica da dosagem de luz e a medição de influências térmicas. Aqui, novamente, usando tecidos modelo, a exposição à luz é possível minimizar, comparada, por exemplo, com a determinação mais precisa da eficiência de fotocomutação nas condições in vivo , uma alternativa que pode sempre ser interessante de considerar.
Finalmente, os compostos que demonstram características superiores nas telas de toxicidade in vitro e são eficientemente fototrocados a pelo menos 1-1,5 cm de profundidade no tecido modelo podem ser selecionados para estudos in vivo caros, trabalhosos e demorados. Neste protocolo, utilizamos a mesma linhagem celular (LLC) da avaliação in vitro para gerar o modelo de câncer aloenxerto. A dinâmica de crescimento tumoral, a mortalidade e a contagem de metástases são os parâmetros mais adequados para avaliar a eficácia antineoplásica. Em comparação com a quimioterapia convencional, um fator adicional é aplicado no tratamento fotofarmacológico – a luz. Para tanto, são necessários dois grupos de animais controle: um que recebe apenas o veículo e outro que recebe o veículo e a irradiação. Esta configuração permite a avaliação do impacto da luz sobre os parâmetros medidos. Em nosso experimento, os animais dos dois grupos experimentais receberam o composto não ativado, e os tumores dos camundongos de um grupo foram irradiados. O regime de irradiação foi idêntico para os grupos controle e tratamento. A comparação com a quimioterapia de referência não é necessária nesta fase, pois o principal objetivo do experimento é demonstrar o efeito combinado da aplicação de luz e composto. Os compostos de melhor desempenho que exibem esse efeito podem então ser selecionados para um estudo mais aprofundado sobre sua toxicidade in vivo e comparação com benchmarks para a tomada de decisões importantes sobre seu desenvolvimento. Tecnicamente, o experimento in vivo que descrevemos pode ser facilmente adaptado a estudos farmacocinéticos ou farmacodinâmicos, por exemplo, de um composto que já está selecionado como líder do medicamento.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores agradecem o financiamento da UE pelo programa H2020-MSCA-RISE através dos projetos PELICO (#690973) e ALISE (#101007256). Este trabalho foi apoiado pelo DFG-GRK 2039 (SA, TS e ASU), pelo programa NACIP da Sociedade Helmholtz (SA e ASU) e pelo VIP+ do BMBF (OB e ASU). Agradecemos ao Dr. Serhii Koniev, Instituto de Tecnologia de Karlsruhe, que sintetizou o composto LMB002, purificou-o e gentilmente forneceu o composto para o estudo. Os autores também agradecem a Chupryna Maksym, que filmou e compilou o vídeo na Ucrânia, e a todos os corajosos defensores da Ucrânia que tornaram possível o trabalho experimental, a escrita e a filmagem desta publicação.
Materials
| Agilent 1100 Series capillary LC system | ALSI-Chrom (Agilent distributor) | – | |
| ATCC CRL-1642, LL/2 (LLC1) Lewis lung carcinoma cell line | ECACC | 90020104 | |
| C57BL/6NCrl mice, female, inbred | Charles River | Strain code: 027 | |
| CelCulture, CO2 incubator | Esco Micro | CCL-170B | |
| Corning Matrigel Basement membrane matrix | Merck | CLS354234 | |
| Corning, 384- well spheroid microplates | Merck | CLS3830 | |
| Fetal bovine serum | Merck | F7524 | |
| Gibco, DPBS | Thermo Fisher Scientific | 21600044 | |
| Gramicidin S | Lumobiotics | Custom synthesis | |
| HyClone, DMEM/high glucose | Cytiva | SH30003.04 | |
| IN Cell Analyzer 6500HS, imaging system | Cytiva | 29240358 | |
| Invitrogen, Calcein AM | Thermo Fisher Scientific | C1430 | |
| Isoflurane anesthesia machine | ASA | S/N ASA 1305 | |
| L-glutamine, 200 mM solution | Merck | G7513 | |
| LIKA-surgeon, diode surgery laser | Fotonika plus | – | |
| LMB002 | Lumobiotics | Custom synthesis | |
| Penicillin–Streptomycin, solution stabilized | Merck | P4333 | |
| PhenoPlate, 96-well plates | PerkinElmer | 6055302 | |
| Photometer PCE-LED 20 | PCE Instruments | PCE-LED 20 | |
| Thermo Scientific, Hoechst 33342 | Thermo Fisher Scientific | 62249 | |
| Thermo Scientific, Propidium iodide | Thermo Fisher Scientific | J66764-MC | |
| Trypan blue, 0.4% solution | Merck | T8154 | |
| Trypsin–EDTA, 10 x solution | Merck | T4174 | |
| UltraCruz Cell culture flasks with vented caps, 75 cm2 | Santa Cruz Biotechnology | sc-200263 | |
| UltraCruz, bottle top filters, PES, 0.22 μm | Santa Cruz Biotechnology | sc-360882 | |
| Vydac 218TP, C18 HPLC column (4.6 mm × 250 mm, 5 µm) | Altmann Analytik (Avantor distributor) | GR5103827 |
References
- Fuchter, M. J. On the promise of photopharmacology using photoswitches: a medicinal chemist’s perspective. Journal of Medicinal Chemistry. 63 (20), 11436-11447 (2020).
- Volarić, J., Szymanski, W., Simeth, N. A., Feringa, B. L. Molecular photoswitches in aqueous environments. Chemical Society Reviews. 50, 12377-12449 (2021).
- Paoletti, P., Ellis-Davies, G. C. R., Mourot, A. Optical control of neuronal ion channels and receptors. Nature Reviews Neuroscience. 20, 514-532 (2019).
- Hüll, K., Morstein, J., Trauner, D. In Vivo Photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Ma, X., et al. In vivo photopharmacology with a caged mu opioid receptor agonist drives rapid changes in behavior. Nature Methods. 20, 682-685 (2023).
- Sarabando, S. N., Palmeira, A., Sousa, M. E., Faustino, M. A. F., Monteiro, C. J. P. Photomodulation Approaches to Overcome Antimicrobial Resistance. Pharmaceuticals. 16 (5), 682 (2023).
- Kolarski, D., Szymanski, W., Feringa, B. L., Hirota, T., Hatori, M., Panda, S. Chronophotopharmacology: Methodology for high spatiotemporal control over the circadian rhythm with light. Neuromethods. 186, (2022).
- Babii, O., et al. Peptide drugs for photopharmacology: how much of a safety advantage can be gained by photocontrol. Future Drug Discovery. 2 (1), FDD28 (2020).
- Davis, A. M., Keeling, D. J., Steele, J., Tomkinson, N. P., Tinker, A. C. Components of successful lead generation. Current Topics in Medicinal Chemistry. 5 (4), 421-439 (2005).
- Balani, S. K., Miwa, G. T., Gan, L., Wu, J., Lee, F. W. Strategy of utilizing in vitro and in vivo adme tools for lead optimization and drug candidate selection. Current Topics in Medicinal Chemistry. 5 (11), 1033-1038 (2005).
- Kleijn, A., et al. A Systematic comparison identifies an ATP-based viability assay as most suitable read-out for drug screening in glioma stem-like cells. Stem Cells International. 2016, (2016).
- Rodrigues, J., Heinrich, M. A., Teixeira, L. M., Prakash, J. 3D in vitro model revolution: unveiling tumor-stroma interactions. Trends in Cancer. 7 (3), 249-264 (2021).
- Sittinger, M., et al. Tissue engineering and autologous transplant formation: practical approaches with resorbable biomaterials and new cell culture techniques. Biomaterials. 17 (3), 237-242 (1996).
- Matai, I., Kaur, G., Seyedsalehi, A., McClinton, A., Laurencin, C. T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. 226, 119536 (2020).
- Babii, O., et al. Direct photocontrol of peptidomimetics: an alternative to oxygen-dependent photodynamic cancer therapy. Angewandte Chemie International Edition. 55 (18), 5493-5496 (2016).
- De Ridder, K., et al. Novel 3D lung tumor spheroids for oncoimmunological assays. Advanced NanoBiomed Research. 2 (4), 2100124 (2022).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Van Straten, D., Mashayekhi, V., De Bruijn, H. S., Oliveira, S., Robinson, D. J. Oncologic photodynamic therapy: basic principles, current clinical status and future directions. Cancers. 9 (2), 19 (2017).
- Li, X., Kwon, N., Guo, T., Liu, Z., Yoon, J. Innovative strategies for hypoxic-tumor photodynamic therapy. Angewandte Chemie International Edition. 57 (36), 11522-11531 (2018).
- Hull, K., Morstein, J., Trauner, D. In vivo photopharmacology. Chemical Reviews. 118 (21), 10710-10747 (2018).
- Babii, O., et al. Structure-activity relationships of photoswitchable diarylethene-based β-hairpin peptides as membranolytic antimicrobial and anticancer agents. Journal of Medicinal Chemistry. 61 (23), 10793-10813 (2018).
- Heckl, C., Aumiller, M., Rühm, A., Sroka, R., Stepp, H. Fluorescence and treatment light monitoring for interstitial photodynamic therapy. Photochemistry and Photobiology. 96 (2), 388-396 (2020).

