Production et utilisation de l’hydrogène dans un réacteur à membrane
Summary
Les réacteurs à membrane permettent l’hydrogénation dans des conditions ambiantes sans apport direct deH2 . Nous pouvons suivre la production et l’utilisation de l’hydrogène dans ces systèmes en utilisant la spectrométrie de masse atmosphérique (atm-MS) et la spectrométrie de masse par chromatographie en phase gazeuse (GC-MS).
Abstract
L’hydrogénation industrielle consomme ~11 Mt de gazH2 d’origine fossile par an. Notre groupe a inventé un réacteur à membrane pour contourner la nécessité d’utiliser le gazH2 pour la chimie de l’hydrogénation. Le réacteur à membrane s’approvisionne en hydrogène à partir de l’eau et entraîne des réactions en utilisant de l’électricité renouvelable. Dans ce réacteur, un mince morceau de sépare un compartiment électrochimique de production d’hydrogène d’un compartiment d’hydrogénation chimique. Le dans le réacteur à membrane agit comme (i) une membrane sélective de l’hydrogène, (ii) une cathode, et (iii) un catalyseur pour l’hydrogénation. Ici, nous rapportons l’utilisation de la spectrométrie de masse atmosphérique (atm-MS) et de la spectrométrie de masse par chromatographie en phase gazeuse (GC-MS) pour démontrer qu’un biais électrochimique appliqué à travers une membrane permet une hydrogénation efficace sans entrée directe deH2 dans un réacteur à membrane. Avec atm-MS, nous avons mesuré une perméation en hydrogène de 73%, ce qui a permis l’hydrogénation de la propiophénone en propylbenzène avec une sélectivité de 100%, mesurée par GC-MS. Contrairement à l’hydrogénation électrochimique conventionnelle, qui est limitée à de faibles concentrations de matière première dissoute dans un électrolyte protique, la séparation physique de la production d’hydrogène de l’utilisation dans le réacteur à membrane permet l’hydrogénation dans n’importe quel solvant ou à n’importe quelle concentration. L’utilisation de concentrations élevées et d’une large gamme de solvants est particulièrement importante pour l’évolutivité du réacteur et sa commercialisation future.
Introduction
Les réactions d’hydrogénation thermochimiques sont utilisées dans ~20% de toute la synthèse chimique1. Ces réactions nécessitent de grandes quantités de gazH2 , qui sont généralement dérivés de combustibles fossiles, des températures comprises entre 150 °C et 600 °C et des pressions allant jusqu’à 200 atm2. L’hydrogénation électrochimique est un moyen attrayant de contourner ces exigences et de provoquer des réactions d’hydrogénation à l’aide d’eau et d’électricité renouvelable3. Pour l’hydrogénation électrochimique conventionnelle, une matière première insaturée est dissoute dans un électrolyte protique dans une cellule électrochimique. Lorsqu’un potentiel est appliqué à la cellule, l’oxydation de l’eau se produit à l’anode, tandis que l’hydrogénation se produit à la cathode. Dans cette configuration de réaction, l’oxydation électrochimique de l’eau et l’hydrogénation chimique se produisent dans le même environnement de réaction. Le substrat organique est dissous dans un électrolyte protique pour permettre à la fois la séparation électrochimique de l’eau et l’hydrogénation de la matière première. La proximité de ces réactions peut entraîner la formation de sous-produits et l’encrassement des électrodes lorsque le réactif est sensible à une attaque nucléophile ou si la concentration de réactif est trop élevée (>0,25 M)4.
Ces défis ont incité notre groupe à explorer d’autres moyens de provoquer électrochimiquement des réactions d’hydrogénation 5,6,7. Cette recherche a abouti à l’utilisation d’une membrane, qui est classiquement utilisée dans la séparation de l’hydrogène gazeux8. Nous l’utilisons comme électrode pour l’électrolyse de l’eau du côté du réacteur électrochimique. Cette nouvelle application d’une membrane de palladium permet la séparation physique du site d’oxydation électrochimique de l’eau du site d’hydrogénation chimique. La configuration du réacteur qui en résulte comporte deux compartiments : 1) un compartiment électrochimique pour la production d’hydrogène ; et 2) un compartiment chimique pour l’hydrogénation (figure 1). Les protons sont générés dans le compartiment électrochimique en appliquant un potentiel à travers l’anode Pt et la membrane, qui sert également de cathode. Ces protons migrent ensuite vers la membrane, où ils sont réduits en atomes d’hydrogène adsorbés en surface. Le compartiment électrochimique peut être subdivisé pour inclure une membrane échangeuse de cations optionnelle pour faciliter cette migration des protons. Les atomes d’hydrogène adsorbés en surface pénètrent à travers les sites octaédriques interstitiels du réseau fcc9 et émergent sur la face opposée de la membrane dans le compartiment d’hydrogénation, où ils réagissent avec les liaisons insaturées d’une matière première donnée pour former des produits hydrogénés 7,10,11,12,13,14,15,16. Le dans le réacteur à membrane agit donc comme (i) une membrane sélective de l’hydrogène, (ii) une cathode, et (iii) un catalyseur pour l’hydrogénation.
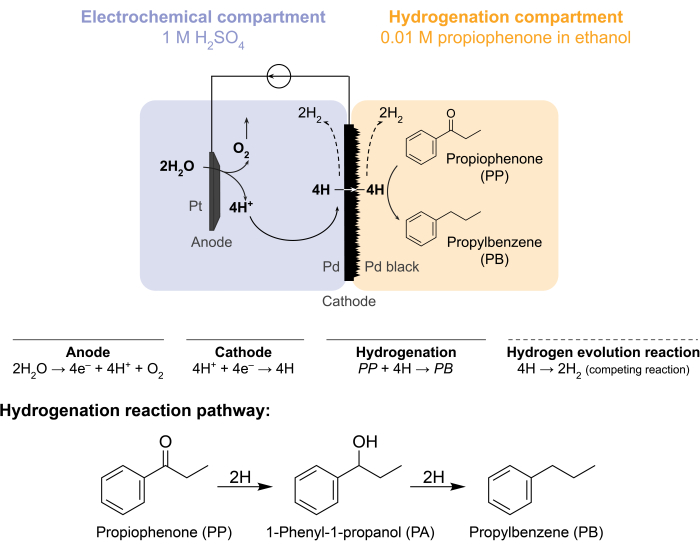
Figure 1 : Hydrogénation dans un réacteur à membrane. L’oxydation de l’eau à l’anode produit des protons, qui sont réduits sur la cathode de palladium. H pénètre à travers la membrane et réagit avec la propiophénone pour former du propylbenzène. L’évolution de l’hydrogène est une réaction concurrente qui peut se produire de chaque côté de la membrane de palladium. Pour la spectrométrie de masse atmosphérique, aucune matière première chimique n’est utilisée, ce qui oblige H à quitter le réacteur sous forme de gazH2 dans les compartiments électrochimiques ou d’hydrogénation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le réacteur à membrane est assemblé en prenant en sandwich une membrane entre les compartiments anode et cathode d’une cellule H électrochimique12. Des joints toriques résistants aux produits chimiques sont utilisés pour fixer la membrane en place et assurer une étanchéité sans fuite. Le compartiment électrochimique du réacteur à membrane contient une solution aqueuse riche en hydrogène. Dans cette étude, nous utilisons 1 MH2SO4et une anode qui consiste en un fil Pt enveloppé dans un morceau de maille de platine de 5cm2. L’anode est immergée dans la solution électrolytique par un trou dans le haut du compartiment électrochimique. Le compartiment d’hydrogénation chimique contient un solvant et une matière première d’hydrogénation 7,10,11,12,16,17. Le trou au sommet du compartiment des cellules H est utilisé pour l’échantillonnage. Les expériences présentées ici utilisent 0,01 M de propiophénone dans l’éthanol comme alimentation d’hydrogénation. Cependant, le matériau de départ (et la concentration) peut être modifié pour répondre aux besoins expérimentaux. Par exemple, une matière première qui contient une longue chaîne hydrocarbonée et un groupe fonctionnel alcyne peut être dissoute dans du pentane pour améliorer la solubilité11. Le courant appliqué pour la réaction peut être compris entre 5 mA/cm2 et 300 mA/cm2. Toutes les réactions sont effectuées sous température et pression ambiantes.
La spectrométrie de masse atmosphérique (atm-MS) est utilisée pour mesurer le pourcentage d’hydrogène dans le compartiment électrochimique qui pénètre dans le compartiment d’hydrogénation11,12. Cette mesure est importante pour comprendre les apports d’énergie requis pour le réacteur à membrane, car elle révèle l’utilisation maximale possible de l’hydrogène (c.-à-d. la quantité d’hydrogène produite qui peut réellement être utilisée pour les réactions d’hydrogénation). La perméation d’hydrogène à travers la membrane est calculée en mesurant la quantité de H2 qui évolue à partir des compartiments électrochimique et hydrogénation11,12. Une valeur de perméation de 100% signifie que tout l’hydrogène produit dans le compartiment électrochimique est transporté à travers la membrane jusqu’au compartiment d’hydrogénation, puis se combine ensuite pour former de l’hydrogène gazeux. Une valeur de perméation de <100% signifie que l’hydrogène se développe dans le compartiment électrochimique avant de pénétrer à travers la membrane. CommeH2 est produit à partir du compartiment électrochimique ou hydrogénation, il pénètre dans l’instrument et est ionisé en H2+. Le quadripôle sélectionne des fragments de m/z = +2, et la charge correspondante est mesurée par le détecteur. Le tracé obtenu par cette technique est la charge ionique dans le temps. La charge ionique est d’abord mesurée pour le compartiment d’hydrogénation, et lorsque le signal se stabilise, les canaux sont modifiés pour mesurer le compartiment électrochimique. La perméation à l’hydrogène est calculée en divisant la charge ionique moyenne dans le compartiment d’hydrogénation par la charge ionique totale mesurée dans le réacteur (équation 1)11,12. Pour calculer la perméation en hydrogène,H2 des compartiments hydrogénation et électrochimique est mesuré séparément à l’aide de l’atm-MS.
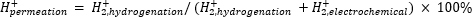 (Éq. 1)
(Éq. 1)
La spectrométrie de masse par chromatographie en phase gazeuse (GC-MS) est utilisée pour surveiller la progression de la réaction d’hydrogénation12,14,15,16. Pour recueillir des données pour l’exemple, le compartiment d’hydrogénation du réacteur est rempli de propiophénone 0,01 M dans l’éthanol. En appliquant un potentiel à travers l’anode Pt et la cathode, de l’hydrogène réactif est fourni au compartiment d’hydrogénation. Les atomes d’hydrogène réactifs hydrogénent ensuite la matière première insaturée, et les produits sont quantifiés à l’aide de la GC-MS, où l’échantillon est fragmenté et ionisé. En analysant la masse de ces fragments, la composition de la solution d’hydrogénation peut être déterminée et les vitesses de réaction peuvent être calculées12,14,15,16.
Protocol
Representative Results
Discussion
La membrane permet la perméation à l’hydrogène et l’hydrogénation chimique. La préparation de cette membrane est donc importante pour l’efficacité du réacteur à membrane. La taille de la membrane, la cristallographie et la surface sont ajustées pour améliorer les résultats expérimentaux. Bien que le métal puisse faire évoluer de l’hydrogène à n’importe quelle épaisseur, les membranes sont laminées à 25 μm. Cette standardisation de l’épaisseur de la membrane garantit que le temps nécessai…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions le Conseil de recherches en sciences naturelles et en génie du Canada (RGPIN-2018-06748), la Fondation canadienne pour l’innovation (229288), l’Institut canadien de recherches avancées (BSE-BERL-162173) et les Chaires de recherche du Canada pour leur soutien financier. Cette recherche a été entreprise en partie grâce au financement du Fonds d’excellence en recherche Apogée Canada, du Programme des matériaux quantiques et des technologies futures. Nous remercions Ben Herring du Shared Instrument Facility de l’UBC pour son aide dans le développement de l’instrument et de la méthode GC-MS. Nous remercions la Dre Monika Stolar pour sa contribution à l’élaboration et à l’édition de ce manuscrit. Enfin, nous remercions l’ensemble du groupe Berlinguette de l’Université de la Colombie-Britannique pour son soutien continu et sa collaboration dans l’étude du réacteur à membrane.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

