Hydrogenproduksjon og -utnyttelse i en membranreaktor
Summary
Membranreaktorer muliggjør hydrogenering i omgivelsesforhold uten direkteH2-inngang . Vi kan spore hydrogenproduksjon og utnyttelse i disse systemene ved hjelp av atmosfærisk massespektrometri (atm-MS) og gasskromatografi massespektrometri (GC-MS).
Abstract
Industriell hydrogenering forbruker ~ 11 Mt fossil avledet H2 gass årlig. Vår gruppe oppfant en membranreaktor for å omgå behovet for å bruke H2 gass for hydrogeneringskjemi. Membranreaktoren henter hydrogen fra vann og driver reaksjoner ved hjelp av fornybar elektrisitet. I denne reaktoren separerer et tynt stykke Pd et elektrokjemisk hydrogenproduksjonsrom fra et kjemisk hydrogeneringsrom. Pd i membranreaktoren fungerer som (i) en hydrogenselektiv membran, (ii) en katode og (iii) en katalysator for hydrogenering. Her rapporterer vi bruk av atmosfærisk massespektrometri (atm-MS) og gasskromatografi massespektrometri (GC-MS) for å demonstrere at en anvendt elektrokjemisk skjevhet over en Pd-membran muliggjør effektiv hydrogenering uten direkteH2-inngang i en membranreaktor. Med atm-MS målte vi en hydrogenpermeasjon på 73%, noe som muliggjorde hydrogenering av propiofenon til propylbenzen med 100% selektivitet, målt ved GC-MS. I motsetning til konvensjonell elektrokjemisk hydrogenering, som er begrenset til lave konsentrasjoner av utgangsmateriale oppløst i en protisk elektrolytt, muliggjør den fysiske separasjonen av hydrogenproduksjon fra utnyttelse i membranreaktoren hydrogenering i ethvert løsningsmiddel eller i hvilken som helst konsentrasjon. Bruk av høye konsentrasjoner og et bredt spekter av løsemidler er spesielt viktig for reaktorskalerbarhet og fremtidig kommersialisering.
Introduction
Termokjemiske hydrogeneringsreaksjoner brukes i ~ 20% av all kjemisk syntese1. Disse reaksjonene krever store mengder H 2 gass, som vanligvis kommer fra fossile brensler, temperaturer mellom 150 ° C og 600 ° C, og trykk opp til 200 atm2. Elektrokjemisk hydrogenering er en tiltalende måte å omgå disse kravene og å drive hydrogeneringsreaksjoner ved bruk av vann og fornybar elektrisitet3. For konvensjonell elektrokjemisk hydrogenering oppløses et umettet råstoff i en protisk elektrolytt i en elektrokjemisk celle. Når et potensial påføres cellen, oppstår vannoksidasjon ved anoden, mens hydrogenering skjer ved katoden. I dette reaksjonsoppsettet forekommer både elektrokjemisk vannoksidasjon og kjemisk hydrogenering i samme reaksjonsmiljø. Det organiske substratet oppløses i en protisk elektrolytt for å muliggjøre både elektrokjemisk vannsplitting og hydrogenering av råstoffet. Nærheten til disse reaksjonene kan føre til biproduktdannelse og elektrodebegroing når reaktanten er utsatt for nukleofilt angrep eller hvis reaktantkonsentrasjonen er for høy (>0,25 M)4.
Disse utfordringene førte til at vår gruppe utforsket alternative måter å elektrokjemisk drive hydrogeneringsreaksjoner 5,6,7. Dette søket resulterte i bruk av en Pd-membran, som konvensjonelt brukes i hydrogengassseparasjon8. Vi bruker den som en elektrode for vannelektrolyse på den elektrokjemiske reaktorsiden. Denne nye anvendelsen av en palladiummembran muliggjør fysisk separasjon av stedet for elektrokjemisk vannoksidasjon fra stedet for kjemisk hydrogenering. Den resulterende reaktorkonfigurasjonen har to rom: 1) et elektrokjemisk rom for hydrogenproduksjon; og 2) et kjemisk rom for hydrogenering (figur 1). Protoner genereres i det elektrokjemiske rommet ved å påføre et potensial over Pt-anoden og Pd-membranen, som også fungerer som katoden. Disse protonene migrerer deretter til Pd-membranen, hvor de reduseres til overflateadsorberte hydrogenatomer. Det elektrokjemiske rommet kan deles inn for å inkludere en valgfri kationbyttermembran for å lette denne protonmigrasjonen. De overflateadsorberte hydrogenatomene gjennomsyrer de interstitielle oktaediske stedene til Pd fcc-gitteret9 og dukker opp på motsatt side av membranen i hydrogeneringsrommet, hvor de reagerer med de umettede bindingene til et gitt råmateriale for å danne hydrogenerte produkter 7,10,11,12,13,14,15,16. Pd i membranreaktoren fungerer derfor som (i) en hydrogenselektiv membran, (ii) en katode og (iii) en katalysator for hydrogenering.
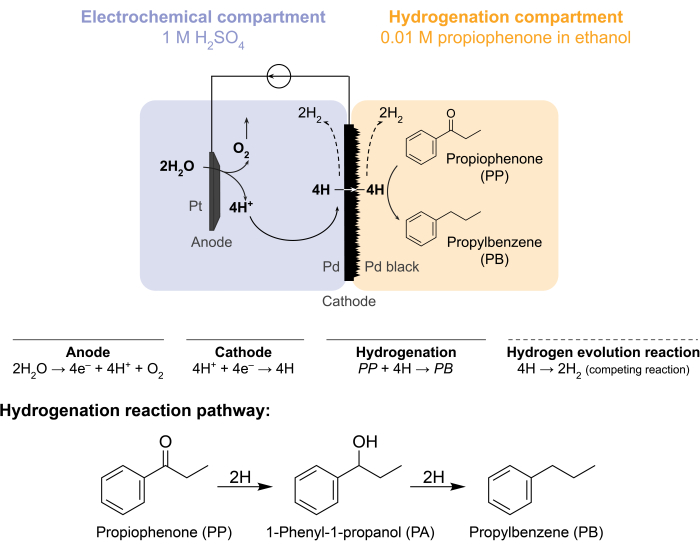
Figur 1: Hydrogenering i en membranreaktor. Vannoksidasjon ved anoden produserer protoner, som reduseres på palladiumkatoden. H gjennomsyrer Pd-membranen og reagerer med propiofenon for å danne propylbenzen. Hydrogenevolusjon er en konkurrerende reaksjon som kan forekomme på begge sider av palladiummembranen. For atmosfærisk massespektrometri brukes ikke noe kjemisk råstoff, noe som krever at H forlater reaktoren i form avH2-gass i verken de elektrokjemiske eller hydrogeneringsrommene. Klikk her for å se en større versjon av denne figuren.
Membranreaktoren settes sammen ved å klemme en Pd-membran mellom anode- og katoderommene i en elektrokjemisk H-celle12. Kjemikaliebestandige O-ringer brukes til å feste membranen på plass og sikre en lekkasjefri forsegling. Det elektrokjemiske rommet i membranreaktoren inneholder en hydrogenrik vandig løsning. I denne studien bruker vi 1 MH2 SO4 og en anode som består av en Pt-ledning innhyllet i et 5 cm2 stykke platinanett. Anoden er nedsenket i elektrolyttløsningen gjennom et hull i toppen av det elektrokjemiske rommet. Det kjemiske hydrogeneringsrommet inneholder et løsningsmiddel og hydrogeneringsråstoff 7,10,11,12,16,17. Hullet på toppen av H-cellerommet brukes til prøvetaking. Forsøkene vist her bruker 0,01 M propiofenon i etanol som hydrogeneringsfôr. Imidlertid kan utgangsmaterialet (og konsentrasjonen) varieres for å passe til de eksperimentelle behovene. For eksempel kan et utgangsmateriale som inneholder en lang hydrokarbonkjede og en alkynfunksjonell gruppe oppløses i pentan for å forbedre løseligheten11. Den påførte strøm for reaksjonen kan være mellom 5 mA / cm 2 og 300 mA / cm2. Alle reaksjoner utføres under omgivelsestemperatur og trykk.
Atmosfærisk massespektrometri (atm-MS) brukes til å måle prosentandelen hydrogen i det elektrokjemiske rommet som gjennomsyrer hydrogeneringsrommet11,12. Denne måling er viktig for å forstå energiinngangene som kreves for membranreaktoren, fordi den avslører maksimal mulig hydrogenutnyttelse (dvs. hvor mye av hydrogenet som produseres, kan faktisk brukes til hydrogeneringsreaksjoner). Hydrogenpermeasjon gjennom Pd-membranen beregnes ved å måle mengden H2 som utvikler seg fra både de elektrokjemiske og hydrogeneringsrommene11,12. En permeasjonsverdi på 100% betyr at alt hydrogen produsert i det elektrokjemiske rommet transporteres gjennom Pd-membranen til hydrogeneringsrommet og deretter kombineres for å danne hydrogengass. En permeasjonsverdi på <100% betyr at hydrogenutvikling skjer i det elektrokjemiske rommet før det gjennomsyres gjennom membranen. Da H2 produseres fra enten det elektrokjemiske eller hydrogeneringsrommet, kommer det inn i instrumentet og ioniseres til H2+. Kvadrupolen velger fragmenter av m / z = +2, og den tilsvarende ladningen måles av detektoren. Plottet oppnådd ved denne teknikken er den ioniske ladningen over tid. Den ioniske ladningen måles først for hydrogeneringsrommet, og når signalet stabiliserer seg, endres kanalene for å måle det elektrokjemiske rommet. Hydrogenpermeasjon beregnes ved å dele den gjennomsnittlige ionladningen i hydrogeneringsrommet med den totale ionladningen målt i reaktoren (ligning 1)11,12. For å beregne hydrogenpermeasjon måles H2 fra hydrogenering og elektrokjemiske rom separat ved bruk av atm-MS.
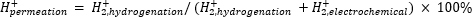 (Eq. 1)
(Eq. 1)
Gasskromatografi massespektrometri (GC-MS) brukes til å overvåke fremdriften av hydrogeneringsreaksjonen12,14,15,16. For å samle inn data for eksempelet er hydrogeneringsrommet til reaktoren fylt med 0, 01 M propiofenon i etanol. Ved å påføre et potensial over Pt-anoden og Pd-katoden, tilføres reaktivt hydrogen til hydrogeneringsrommet. De reaktive hydrogenatomene hydrogenerer deretter det umettede råstoffet, og produktene kvantifiseres ved hjelp av GC-MS, hvor prøven fragmenteres og ioniseres. Ved å analysere massen av disse fragmentene kan sammensetningen av hydrogeneringsløsningen bestemmes, og reaksjonshastighetene kan beregnes12,14,15,16.
Protocol
Representative Results
Discussion
Pd-membranen muliggjør hydrogenpermeasjon og kjemisk hydrogenering. Fremstillingen av denne membranen er derfor viktig for effekten av membranreaktoren. Pd-membranstørrelsen, krystallografien og overflaten er innstilt for å forbedre de eksperimentelle resultatene. Selv om Pd-metall kan utvikle hydrogen i hvilken som helst tykkelse, rulles Pd-membranene til 25 μm. Denne standardiseringen av membrantykkelse sikrer at tiden det tar for hydrogen å trenge gjennom membranen er konstant for alle forsøkene. Dessuten, jo ty…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi er takknemlige for Canadian Natural Sciences and Engineering Research Council (RGPIN-2018-06748), Canadian Foundation for Innovation (229288), Canadian Institute for Advanced Research (BSE-BERL-162173) og Canada Research Chairs for økonomisk støtte. Denne forskningen ble gjennomført delvis takket være finansiering fra Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Vi takker Ben Herring ved UBC Shared Instrument Facility for hjelp med GC-MS instrument- og metodeutvikling. Vi takker Dr. Monika Stolar for bidrag til utvikling og redigering av dette manuskriptet. Til slutt takker vi hele Berlinguette-gruppen ved University of British Columbia for deres fortsatte støtte og samarbeid i studiet av membranreaktoren.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
References
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

