- 00:00Overview
- 01:22Principles of HPLC
- 05:05Preparation of the Mobile Phase
- 06:08Preparation of Component and Standard Solutions
- 07:25HPLC Setup
- 09:25Diet Soda Samples
- 10:16Results
- 11:27Applications
- 12:44Summary
Cromatografía de líquidos de alto rendimiento (HPLC)
English
Share
Overview
Fuente: Dr. Pablo Bower – Universidad de Purdue
Cromatografía líquida de alto rendimiento (HPLC) es un importante método analítico utilizado para separar y cuantificar los componentes de muestras líquidas. En esta técnica, una solución (primera fase) se bombea a través de una columna que contiene un embalaje de pequeñas partículas porosas con una segunda fase a la superficie. Las diferentes solubilidades de los componentes de la muestra en las dos fases causan los componentes para moverse a través de la columna con diferentes velocidades promedio, creando así una separación de estos componentes. La solución bombeada es llamada la fase móvil, mientras que la fase en la columna se llama la fase estacionaria.
Hay varios modos de cromatografía de líquidos, dependiendo del tipo de fase estacionaria o móvil empleado. Este experimento utiliza cromatografía de fase inversa, donde la fase estacionaria es apolar y la fase móvil es polar. La fase estacionaria a emplear es C18 grupos de hidrocarburos adheridos a partículas de sílice de 3 μm, mientras que la fase móvil es un buffer acuoso con un modificador orgánico polar (acetonitrilo) añadido para variar su fuerza de elución. De esta forma, la silicona puede utilizarse para obtener muestras que son solubles en agua, proporcionando una amplia gama de aplicaciones. En este experimento, se separan las mezclas de tres componentes frecuentes en refrescos de dieta (es decir, cafeína, benzoato y aspartame). Se utilizan siete soluciones preparadas que contengan cantidades conocidas de las tres especies, y luego se registran sus cromatogramas.
Principles
Durante un experimento HPLC, una bomba de alta presión toma la fase móvil de un depósito a través de un inyector. Entonces viaja a través de una columna de fase inversa C18-embalado para la separación de componentes. Por último, la fase móvil se mueve en una célula del detector, donde se mide la absorbancia a 220 nm y termina en una botella de residuos. La cantidad de tiempo que tarda un componente viajar desde el puerto del inyector al detector se llama el tiempo de retención.
Un cromatógrafo líquido es utilizado en este experimento, donde se realiza la separación en una columna de fase inversa. Las dimensiones de la columna son 3 mm (diámetro interno) x 100 mm y la sílice (tamaño de partícula de 3 μm) del embalaje es funcionalizado con C18 octadecylsilane (ODS). Una válvula de inyección rotatoria de 6 puertos Rheodyne se utiliza para almacenar inicialmente la muestra en un pequeño bucle y presenta la muestra a la fase móvil en rotación de la válvula.
La detección es por espectroscopia de absorción en una longitud de onda de 220 nm. Este experimento se puede ejecutar a 254 nm, si un detector no es variable. Los datos del detector tiene una salida de voltaje analógica, que se mide con un multímetro digital (DMM), y leído por un ordenador con un programa de adquisición de datos. El cromatograma resultante tiene un pico para cada componente en la muestra. Para este experimento, los tres componentes responsables dentro de 5 minutos.
Este experimento utiliza una fase móvil y la bomba, que se llama fase móvil isocrática. Para las muestras que son muy difíciles de separar, se puede utilizar un gradiente fase móvil. Esto es cuando la fase móvil inicial es principalmente acuosa, y con el tiempo, una fase móvil segunda orgánica poco a poco se agrega a la fase móvil en general. Este método plantea la polaridad de esta fase con el tiempo, que reduce los tiempos de retención de los componentes y funciona de forma similar a un gradiente de temperatura en un cromatógrafo de gases. Hay algunos casos donde la columna se calienta (generalmente a 40 ° C), que quita cualquier retención errores asociados con un cambio de temperatura.
En HPLC de fase inversa, la fase estacionaria de la columna del embalaje es generalmente un C4, C8 o C18 de embalaje. Las columnas de C4 son principalmente de proteínas de gran peso molecular, mientras que las columnas C18 para péptidos y ejemplos básicos con pesos moleculares más bajos.
Detección por espectroscopia de absorción es mayoritariamente el método de detección de elección, como los espectros de absorción de los componentes están todos disponibles. Algunos sistemas utilizan medidas electroquímicas, como la conductividad o la Amperometría, como métodos de detección.
Para este experimento, la fase móvil es principalmente 20% acetonitrilo y 80% purificada agua desionizada (DI). Una pequeña cantidad de ácido acético se agrega al bajar el pH de la fase móvil, que mantiene el silanol en la fase de embalaje inmóvil en un estado undissociated. Esto reduce el pico de la adsorción de relave, dando picos más estrechos. Luego, se ajusta el pH con hidróxido de sodio 40% para elevar el pH y ayudar a disminuir los tiempos de retención de los componentes.
Cada grupo utiliza un conjunto de 7 frascos que contienen diferentes concentraciones de las soluciones estándar (tabla 1). Los 3 primeros se utilizan para identificar cada pico, y los últimos 4 son para crear un gráfico de calibración para cada componente. Normas 1-3 también se utilizan para el cuadro de calibración.
| Número | Cafeína (mL) | Benzoato (mL) | Aspartamo (mL) |
| 1 | 4 | 0 | 0 |
| 2 | 0 | 4 | 0 |
| 3 | 0 | 0 | 4 |
| 4 | 1 | 1 | 1 |
| 5 | 2 | 2 | 2 |
| 6 | 3 | 3 | 3 |
| 7 | 5 | 5 | 5 |
Tabla 1. Volúmenes de existencias estándares utilizados para preparar los estándares de trabajo proporcionado 7 (volumen total de cada estándar es de 50 mL).
Procedure
Results
The HPLC chromatograms are able to quantify each of the 3 components for all the samples based upon the calibration curves of the standards (Figure 3).
From this set of experiments, it was determined that a 12-oz can of these diet sodas contained the following amounts of each component:
Diet Coke: 50.5 mg caffeine; 217.6 mg aspartame; 83.6 mg benzoate.
Coke Zero: 43.1 mg caffeine; 124.9 mg aspartame; 85.3 mg benzoate.
Diet Pepsi: 34.1 mg caffeine; 184.7 mg aspartame; 79.5 mg benzoate.
Not surprisingly, all 3 had roughly the same amount of benzoate, as it is just a preservative. The Coke products had a bit more caffeine, and the Coke Zero had much less aspartame than the other two sodas, as it also includes citric acid for some flavoring.
The following numbers are the actual amounts of caffeine and aspartame in a 12-oz can of the 3 diet sodas (The caffeine content was obtained from the Coca-Cola and Pepsi websites. The aspartame content was obtained from both LiveStrong.com and DiabetesSelfManagement.com.):
Diet Coke: 46 mg caffeine; 187.5 mg aspartame
Coke Zero: 34 mg caffeine; 87.0 mg aspartame
Diet Pepsi: 35 mg caffeine; 177.0 mg aspartame
Sample Calculations (Table 2):
Concentration of caffeine in STD#1: The component solution for caffeine had 0.400 g of caffeine diluted to 500 mL = 0.500 L → 0.800 g/L = 0.800 mg/mL.
STD#1 had 1 mL of this solution diluted to 50.0 mL
0.800 mg/mL * (1.0 mL / 50.0 mL) = 0.016 mg/mL = 16.0 mg/L.
STD#2 had 2 mL of this solution diluted to 50.0 mL
0.800 mg/mL * (2.0 mL / 50.0 mL) = 0.032 mg/mL = 32.0 mg/L.
The results from the three calibration graphs (Figure 4) yielded the following equations:
Caffeine Peak Area = 0.1583*[Caffeine mg/L] – 0.574
Aspartame Peak Area = 0.02696*[Aspartame mg/L] – 0.405
Benzoate Peak Area = 0.1363*[Benzoate mg/L] – 1.192
Diet Coke: Caffeine Peak Area = 10.68 = 0.1583*[Caffeine mg/L] – 0.574
[Caffeine mg/L] = (10.68 + 0.574)/ (0.1583) = 71.1 mg/L in the injected sample.
Since the sample was diluted by a factor of 2, the Diet Coke had 141.2 mg/L caffeine.
The amount per 12-oz can = (141.2 mg/L)(0.3549 mL/12-oz can) = 50.5 mg caffeine/can.
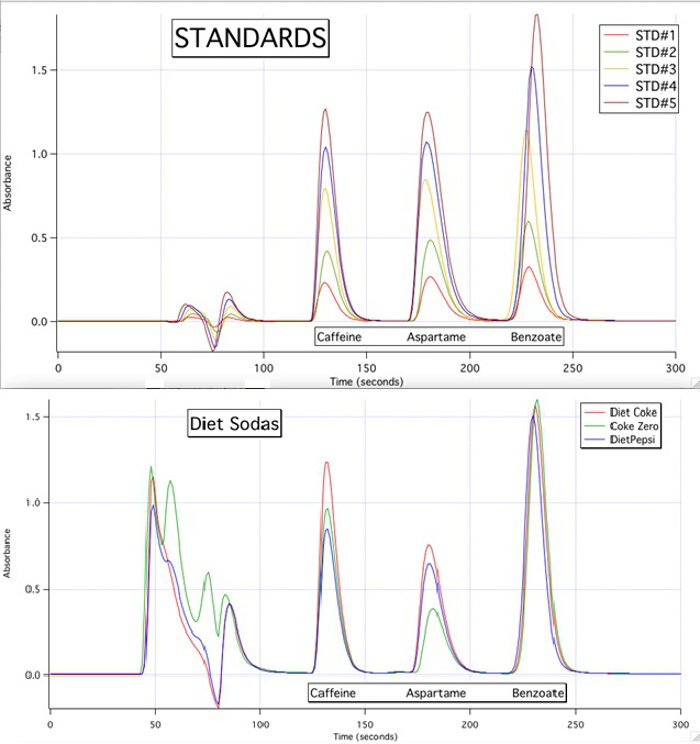
Figure 3. The HPLC chromatograms of the 5 standards and the 3 samples.
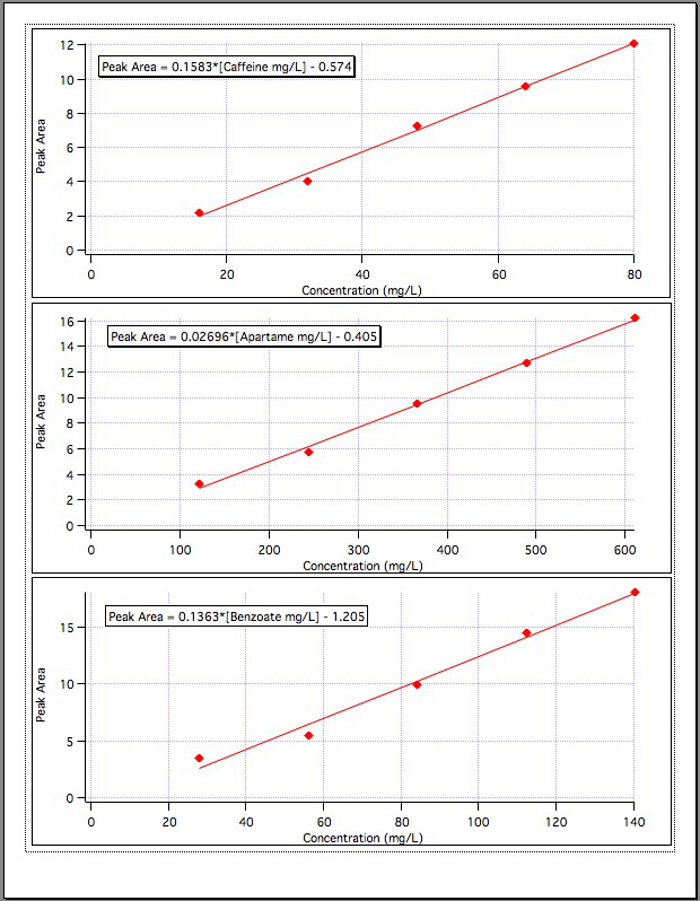
Figure 4. The calibration curves for each of the 3 components.
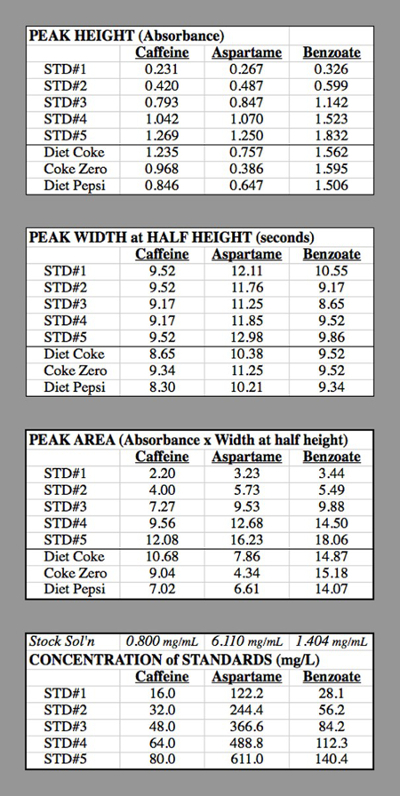
Table 2. The data tables for the HPLC trials used for generating the calibration curves.
Applications and Summary
HPLC is a widely-used technique in the separation and detection for many applications. It is ideal for non-volatile compounds, as gas chromatography (GC) requires that the samples are in their gas phase. Non-volatile compounds include sugars, vitamins, drugs, and metabolites. Also, it is non-destructive, which allows each component to be collected for further analysis (such as mass spectrometry). The mobile phases are practically unlimited, which allows changes to the polarity of pH to achieve better resolution. The use of gradient mobile phases allows for these changes during the actual trials.
There has been concern over the possible health issues that may be associated with the artificial sweetener aspartame. Current product labeling does not show the amount of these components inside of the diet beverages. This method allows for quantifying these amounts, along with the caffeine and benzoate.
Other applications include determining the amounts of pesticides in water; determining the amount of acetaminophen or ibuprofen in pain reliever tablets; determining whether there are performance-enhancing drugs present in the bloodstream of athletes; or simply determining the presence of drugs in a crime lab. While the concentrations of these samples, and often the identity of the components, can be readily determined, the one limitation is that several samples could have close to identical retention times, resulting in co-eluting.
Transcript
High-performance liquid chromatography, or HPLC, is a highly versatile technique that separates components of a liquid mixture based on their different interactions with a stationary phase.
HPLC is an adaptation of column chromatography. In column chromatography, a column is packed with micro-scale beads called the stationary phase. The stationary phase beads are functionalized with chemical groups that induce an interaction between the bead and the components of a mixture located in the liquid, or mobile phase. As the mixture flows through the column, the components interact with the stationary phase differently.
In HPLC, column chromatography is performed at a higher flow rate, and therefore higher pressure, than classical column chromatography. This enables the use of smaller stationary phase beads with a greater surface area to volume ratio, which greatly increases the interaction of the stationary phase and components in the mobile phase.
This video will introduce the basics of the operation of HPLC by demonstrating the separation of components of various diet sodas.
There are two types of HPLC used in the laboratory: analytical, and preparative. In analytical HPLC, the instrument is used to identify components of a small volume, and the analyzed sample is then discarded as waste. In preparative HPLC, the instrument is used to purify a mixture and a desired amount of each component is collected in fractions.
The HPLC instrumentation consists of a series of simple components. First, the mobile phase, held in solvent reservoirs, is pumped through the system by one or more pumps at a constant flow rate. The sample is injected into the mobile phase stream by the sample injector. The sample, diluted by the mobile phase, is then delivered to the HPLC column, where the components of the sample are separated. The components are then analyzed by the detector, and either saved in fractions for later use, or transferred to a waste bottle.
The HPLC column is the key component to the system. It is composed of a metal or plastic cylinder, packed with micro-scale beads of stationary phase, or chromatography resin. The sample mixture flows through the packed particle bed at a constant flow rate and each component interacts with the stationary phase as it flows by.
The compounds interact with the stationary phase differently, and therefore travels down the length of the column to the detector at a different rate. The time required for a component to exit the column, or elute, is called the retention time. The result is a plot of retention time vs. intensity, or a chromatogram. The retention time is used to identify the component. The peak size, specifically the area under the peak, is used to quantify the amount of the compound in the initial solution.
The choice of stationary phase depends on the properties of the components in the sample mixture. The most commonly used stationary phase is silica beads, as they are an inert nonpolar material that forms micro-scale beads, and achieves sufficient packing density. The most common type of HPLC is reversed-phase chromatography, which utilizes a hydrophobic stationary phase, typically silica beads with C18 chains bonded to the beads’ surface. The components are eluted in order of decreasing polarity.
The mobile phase used in reversed-phase chromatography is typically a mixture of water and an organic solvent, such as acetonitrile. Depending on the sample, the mobile phase can remain a constant ratio of water and organic solvent, known as isocratic mode. However, this can lead to broad peaks, in the case of high water content, or overlapping peaks—in the case of high organic content.
The mobile phase ratio can also be changed linearly or stepwise during the separation, to create a mobile phase gradient. A gradient elution can prevent peak broadening of the less polar components, thereby improving the separation and shortening the elution time.
Now that the basics of HPLC have been outlined, the HPLC technique will be demonstrated in the laboratory. In this experiment, HPLC will be used to separate and quantify three common components of diet soda.
First, to prepare the mobile phase, add 400 mL of acetonitrile to 1.5 L of purified deionized water. Then carefully add 2.4 mL of glacial acetic acid. Dilute the solution to a total volume of 2 L. The resulting solution should have a pH between 2.8 and 3.2.
Adjust the pH to 4.2 by adding 40% NaOH, drop-wise to the stirring solution, with the use of a calibrated pH meter.
Filter the mobile phase through a 0.47-μm membrane filter under vacuum to degas the solution and remove solids that could plug the column. It is important to degas the solution, as bubbles can cause voids in the stationary phase, or work their way to the detector cell and cause instability in measurements.
Prepare three component solutions of caffeine, benzoate, and aspartame, which are three typical components of diet sodas. These component solutions are then used to prepare the standard solutions that will be utilized to determine the unknowns. Prepare 500 mL of the caffeine and benzoate solutions.
Prepare 100 mL of the aspartame component solution. Store the solution in the refrigerator when not in use to avoid decomposition.
Next, prepare 7 standard solutions, each with different concentrations of caffeine, benzoate, and aspartame. Pipet the proper amount of each component into a volumetric flask, and dilute to the 50-mL mark with mobile phase.
The first 3 solutions each contain one component, to enable peak identification. The other 4 solutions contain a range of concentrations of all 3 components, in order to correlate peak height to concentration.
Pour each standard solution into a labeled vial in a sample rack. Store the sample rack with samples and the remaining solutions in the refrigerator.
First, set up the mobile phase and waste containers. Ensure that the waste lines are fed into a waste container, and are not recycling back into the mobile phase. Ensure that the inlet mobile phase line is fed into the mobile phase container.
Verify that the flow rate of the mobile phase is set to 0.5 mL/min. This flow rate will enable all components to elute within 5 min, but is slow enough to ensure resolution of individual peaks.
Next, verify the minimum and maximum pressures on the solvent delivery system. These settings shut the pump off in case of a leak or clog, respectively.
Press “zero” on the detectors front panel, to set the blank. Rinse a 100-μL syringe with deionized water, then with several volumes of 1 of the 7 working standards. Then fill the syringe with that solution. Begin with the 3 single-component samples in order to identify the peak of each component.
Next, manually inject the solution, by placing the injector handle in the load position. Slowly inject the 100 μL of solution through the septum port.
Verify that the data collection program is set to collect data for 300 s, which allows for enough time for all 3 peaks to elute through the detector. When ready to begin the trial, rotate the injector handle to the inject position, in order to inject the sample into the mobile phase. Immediately, click “Start Trial” on the data collection program. When the scan is complete, repeat the process for each of the 7 standard solutions. For each of the first 3 standards, only one of the 3 peaks appears. Note the location of the peak, which is used to identify the component.
Select 3 diet soda samples, and allow them to sit out in open containers overnight to remove the carbonation.
After overnight degassing, draw approximately 3 mL of each diet soda into a plastic syringe. Next, attach a filter tip to the syringe and push the soda through the filter into a glass vial, in order to remove any solid particulates.
Dilute 2 mL of each sample with 2 mL of the mobile phase to decrease the soda concentration by half.
Draw 100 μL of one of the soda samples into a syringe, and inject it into the sample loop. Run the trial with identical parameters to the standard solutions. Repeat for each soda sample.
First, correlate the peak areas of the standard samples to the known concentrations. To do so, determine the peak areas on the chromatographs for each standard sample using the triangular method. Calculate the peak height times with the width at half of the height, and use this value as the peak area.
Using the peak area and known concentrations create a calibration curve for each component, and determine the least-squares fit for each calibration curve.
Calculate the concentration of each component in the diet sodas from the peak areas. Remember that the sodas were all diluted by a factor of 2 prior to injection into the HPLC. Based on these results, calculate the mg of each component in a 12-oz can of soda.
Unsurprisingly, all 3 sodas tested contained roughly the same amount of the preservative benzoate. However, the Coke products contained more caffeine. The calculated values for all components correlated well to reported values by the manufacturers.
HPLC is a highly versatile instrument, which is used in a wide range of analyses.
HPLC is often used to purify peptide molecules. In this example, transmembrane peptide complexes were prepared, and then stabilized by oxidative crosslinking the proteins with disulfide bonds.
The proteins were then dissolved in formic acid, and purified using reversed phase HPLC. The sample was then eluted using a linear gradient of two solvents, and the purity confirmed with mass spectrometry.
HPLC can also be used to identify organic compounds synthesized in the lab. In the Miller-Urey experiment, the abiotic synthesis of organic compounds on primordial earth was studied. Primordial gases, such as methane and ammonia, were introduced to a flask containing water, simulating early oceans. Electrical discharge was then applied, imitating lightning on primordial earth.
The water was then analyzed using HPLC coupled with mass spectrometry, and compared to known amino acid standards. 23 amino acids were synthesized and identified in this experiment.
You’ve just watched JoVE’s introduction to HPLC. You should now understand the basics of running the instrument, and analyzing the resultant data.
Thanks for watching!
