Sub-nanometer Resolution Imaging met amplitude-modulatie Atomic Force Microscopy in Liquid
Summary
We presenteren een methode voor het bereiken van sub-nanometer resolutie beelden met amplitude-modulatie (tapping mode) atomic force microscopy in vloeistof. De methode wordt gedemonstreerd op de commerciële atomic force microscopen. We leggen de grondgedachte achter onze keuzes van de parameters en suggereren strategieën voor het oplossen van optimalisatie.
Abstract
Atomic force microscopy (AFM) has become a well-established technique for nanoscale imaging of samples in air and in liquid. Recent studies have shown that when operated in amplitude-modulation (tapping) mode, atomic or molecular-level resolution images can be achieved over a wide range of soft and hard samples in liquid. In these situations, small oscillation amplitudes (SAM-AFM) enhance the resolution by exploiting the solvated liquid at the surface of the sample. Although the technique has been successfully applied across fields as diverse as materials science, biology and biophysics and surface chemistry, obtaining high-resolution images in liquid can still remain challenging for novice users. This is partly due to the large number of variables to control and optimize such as the choice of cantilever, the sample preparation, and the correct manipulation of the imaging parameters. Here, we present a protocol for achieving high-resolution images of hard and soft samples in fluid using SAM-AFM on a commercial instrument. Our goal is to provide a step-by-step practical guide to achieving high-resolution images, including the cleaning and preparation of the apparatus and the sample, the choice of cantilever and optimization of the imaging parameters. For each step, we explain the scientific rationale behind our choices to facilitate the adaptation of the methodology to every user’s specific system.
Introduction
Sinds de uitvinding, dertig jaar geleden, atomic force microscopy (AFM) 1 heeft zich gevestigd als een techniek van de keuze voor het onderzoeken van monsters op nanoschaal, met name wanneer gemiddeld meer dan macroscopische oppervlakken is niet mogelijk en lokale informatie nodig is. In een typische AFM meting wordt de doorbuiging van een flexibele cantilever de interacties kracht kwantificeren tussen een klein aantal moleculen en een UltraSharp tip aan het uiteinde van de cantilever. Afhankelijk van het type interacties en de tijdschaal beschouwd, kan een grote hoeveelheid informatie worden verkregen, zoals de visco-elastische eigenschappen van zachte biologische membranen 2,3, de sterkte van een enkelvoudige chemische binding of moleculaire 4,5, de atomaire details van een oppervlakte 6-8, de magnetische 9, capacitieve 10, 11 geleidend, 12,13 thermische en chemische 14 eigenschappen van de monsters <sup> 15. Een deel van het succes van AFM is de mogelijkheid om aan een breed scala van materialen 16 en in meerdere omgevingen zoals vacuüm 17, 11,18 gas of vloeistof 19,20, omdat het niet afhankelijk van een bepaalde kracht tussen probe en monster .
In de praktijk, echter, werken de AFM in andere dan omgevingsomstandigheden kan een uitdaging en vele gepubliceerde resultaten nog steeds in lucht verkregen. Een bijkomend probleem is het feit dat het meestal noodzakelijk de AFM dynamische modus (trillende tip) om zowel tip en sample veilig te stellen door grote wrijvingskrachten werken. Hoewel meer uitdagende, dynamische werking kan in principe zorgen voor meer informatie over de geanalyseerde monster, en zonder verlies van de ruimtelijke resolutie. In de afgelopen tien jaar is het gebied van dynamische AFM in vloeibare belangrijke ontwikkelingen gezien, van de opkomst van video-rate AFM 21-23, om meerdere frequenties metingen <sup> 24,25 en sub-nanometer beeldvorming van hydratatie structuren op interfaces 26-31. AFM operatie terwijl ondergedompeld in vloeistof wordt nu routinematig gebruikt in de biologie en biofysica 32-36, polymeer onderzoek 37, elektrochemie 38-40 en solid-vloeistof grensvlakken karakterisering 41-44. De aanwezigheid van vloeistof rond de trillende cantilever verandert aanzienlijk de dynamiek 45 en de interactie tussen de tip en het sample 29,42. Bij goed gebruik, kan de vloeistof worden benut beeldresolutie 26,29 verbeteren, met een typische verbetering van bijna een orde van grootte in vergelijking met de beste resolutie bereikt omgevingsomstandigheden 46.
In AFM, de hoogst haalbare ruimtelijke resolutie voor een bepaalde meting hangt af van zowel de kwaliteit van de AFM zelf en de aard van de tHij interactie gesondeerd 20,47,48. Op dit moment zijn de meeste high-end, in de handel verkrijgbaar AFMs huidige geluidsniveaus die dicht bij die van thermische limiet 12 zijn zo bepalend voor de resolutie is meestal de tip-sample interactie. Het is in feite de ruimtelijke gradiënt van deze interactie dat de resolutie bepaalt: metingen gebaseerd op de korte afstand, snel rottend interactie produceren hogere resolutie resultaten dan wanneer langere afstand interacties in het spel. In vloeistof kan solvatatie krachten beeldresolutie verbeteren, omdat ze de neiging te verdwijnen over slechts enkele moleculaire diameters van de vloeistof (meestal <1 nm) bij het verplaatsen van het oppervlak van het monster 49. Deze komen voort uit de interactie tussen de vloeibare moleculen en het oppervlak van het monster. Een vloeistof met een sterke affiniteit voor het oppervlak de neiging om meer geordende en minder mobiel dan bulkvloeistof aan het grensvlak met het monster 29,42,50. Als gevolg,het zal meer energie te nemen voor een trillende AFM tip om grensvlak vloeistof moleculen verdringen dan vloeibare bulk 42, waardoor de meting zeer gevoelig voor lokale variaties in het grensvlak vloeistof eigenschappen op nanoschaal -de solvatatie landschap.
Om solvatatie krachten te benutten, moeten verscheidene praktische aspecten in overweging te nemen. Ten eerste, de trillingsamplitude van de punt moet vergelijkbaar met het bereik van de solvatatie krachten zijn, typisch <1 nm. Ten tweede, de vloeistof die moet welomschreven solvatatie landschap aan het oppervlak van het monster te vormen. Macroscopisch is dit gelijk aan die een "bevochtiging" vloeistof voor het proefmonster. Bijvoorbeeld, in het water is het makkelijker om resolutie over hydrofiele mica dan op hydrofobe grafiet 42,51 moleculair niveau te bereiken. Ten slotte moet de veerconstante van de cantilever ondersteunen het uiteinde geschikte 52,53 geselecteerd. Bij het werken in deze convoorwaarden, de AFM niet alleen moleculair niveau afbeeldingen van de interface, maar het vloeit ook informatie over de plaatselijke sample-vloeistofaffiniteit die kan worden gebruikt om chemische informatie over het oppervlak van het monster 54 te verkrijgen.
De meest voorkomende dynamische modi voor AFM in vloeistof amplitude-modulatie (AM, ook 'tapping mode'), AFM en de frequentie-modulatie (FM) AFM. In het eerste geval 55, de tip-raster scant het monster terwijl de trillingsamplitude door een terugkoppellus die continu opnieuw past de tip-sample afstand constant wordt gehouden. Een topografisch beeld van het monster wordt verkregen door de terugkoppellus toegepaste correctie. FM-AFM 28,41,56, is de oscillatiefrequentie van de cantilever / tip die constant wordt gehouden terwijl de tip scant het monster. Beide technieken bieden vergelijkbare topografische resolutie in vloeibare 36,57. Kwantificering van de tip-sample interactie heeft de neiging om meer te zijn Straightforward en nauwkeurig in FM-AFM, maar AM-AFM is eenvoudiger te implementeren, meer robuuste, en maakt het werken met zachtere uitkragingen, iets nuttigs voor het bestuderen van gemakkelijk vervormbare of delicate samples. Significant, AM-AFM is wijdverspreid onder AFM gebruikers, deels om historische redenen, maar ook vanwege het feit dat het technisch gemakkelijker te geleiden.
Hoewel de amplitude constant door de terugkoppeling tijdens de AM-AFM beeldvorming wordt gehouden, wordt de fase-lag tussen de tip oscillatie en de drijvende oscillatie toegestaan om vrij te veranderen. De fase-vertraging kan nuttige informatie verschaffen over de tip-sample interacties, is gerelateerd aan de energie afgevoerd tijdens oscillatie van de tip op het grensvlak met het monster 58. Vandaar fase-beeldvorming kan gelijktijdig worden verworven topografische beeldvorming en vaak complementair aandacht voor de heterogeniteit van een monsteroppervlak. Fase beeldvorming is gebruikt voor diverse mapping interacties, waaronder direct in kaart brengen van de hechting energie 42, visco-elastische eigenschappen 58 en de hydratatie landschap van een interface 44.
Praktisch, verkrijgen van hoge resolutie beelden in vloeistof blijft niet-triviale vanwege het grote aantal parameters te controleren, en het ontbreken van een eenvoudige, systematische protocol dat werkt in elke situatie. Beeldkwaliteit is meestal afhankelijk van de cantilever geometrie en elasticiteit, de punt chemie, de oscillatieamplitude, en het monster stijfheid oa 55. AFM metingen ook per definitie perturbatieve het systeem. Hierdoor veranderen imaging variabelen en omgevingsomstandigheden zonder overdenking kan leiden tot moeilijkheden bij reproduceerbaarheid en / of misrepresentative observaties en valse resultaten.
Hier presenteren we ons protocol voor het bereiken van een hoge resolutie beelden van harde en zachte samples in oplossing, met behulp van commerciële instrumenten gebruikt in amplitude-modulatie. Ons doel is om een praktische procedure bieden voor het optimaliseren van de belangrijkste parameters kans om de resolutie te beïnvloeden over verschillende monsters, uit te leggen in elk geval de redenen voor onze keuzes van de fysische principes die ten grondslag liggen aan de beeldvorming proces. We detail een stap-voor-stap benadering van het substraat reiniging en voorbereiding van de keuze van cantilever, aanpassing van de beeldvormingsparameters en de meest voorkomende problemen oplossen. Uitleg over de wetenschappelijke gedachte achter onze keuzes en procedures voor hoge-resolutie zou moeten helpen het maken van rationele keuzes bij de aanpassing van de methodologie, en dienen als uitgangspunt voor de beeldvorming nieuwe systemen.
In deze tekst gebruiken we AM te verwijzen naar de amplitudemodulatie werkingsmodus van een AFM. We verwijzen naar de parameter feedback constant gehouden tijdens ofwel de cantilever doorbuiging (contact modus) of oscillatie amplitude (AM-modus) als de gewenste waarde. In de AM-modus, wordt de cantilever extern gedrevenhetzij door een akoestische trilling of door een gepulste laser gericht aan de basis van de cantilever. De aansturingsamplitude is de intensiteit van de externe oscillerende signaal. De absolute waarde van de amplitude schijf om een bepaald trillingsamplitude van de cantilever te bereiken hangt af van vele parameters, zoals de wijze van besturen (akoestisch, fotothermische of magnetisch), cantilever fixatie en parameters (stijfheid, geometrie) en laseruitlijning. De exacte waarde van de aandrijving amplitude derhalve niet relevant maar wordt aangepast elk experiment teneinde een geschikte (en kwantificeerbare) trillingsamplitude van de cantilever verschaffen. Wanneer de aangedreven cantilever ver van het monster en geen demping van de trillingen vindt plaats via tip-sample interacties, wordt de trillingsamplitude zogenaamde vrije oscillatieamplitude. Aangezien de trillende tip nadert het oppervlak van het monster, de amplitude begint te dalen. Als de feedback is ingeschakeld, zal de z-piëzo constantly opnieuw aan te passen de uitbreiding ervan, zodat de geselecteerde setpoint amplitude kiel, constant. De gewenste waarde is normaal gesproken altijd kleiner dan de vrije amplitude. Het is gebruikelijk om naar de gewenste waarde, de verhouding van de gewenste amplitude (imaging amplitude) via vrije amplitude. Hoe kleiner de gewenste verhouding, hoe harder de beeldvormende voorwaarden.
Protocol
Representative Results
Discussion
Aangenomen dat de beeldvormende vloeistof en de cantilever stijfheid passende wijze zijn geselecteerd, de meest kritische stappen voor bereiken van succesvolle hoge resolutie is de aanpassing van de amplitude beeldvorming, en de algehele zuiverheid van het systeem onderzocht.
Amplitudes vergelijkbaar met de dikte van het grensvlak vloeistofgebiedje (typisch minder dan 2 nm) sondes hoofdzakelijk variatie in de eigenschappen van het grensvlak 42 oplosmiddel. Als de oscillatie amplitude te groot is, zal de trillende tip dwars lange afstand, niet-lineaire krachtvelden 52 dat de stabiliteit van cantilever beweging voorkomen, en onvermijdelijk sloeg het monster, ongeacht de beeldvormingsomstandigheden 29, wat resulteert in verslechtering van de resolutie. Naast het verlies in resolutie, hogere harmonischen beginnen te verschijnen in de top beweging en het systeem ingewikkelder model 55. Een defect imaging amplitude te klenly de interface wordt geprobed (gewoonlijk specifieke lagen van het grensvlak vloeistof) en stabiele beeldvorming kan alleen worden bereikt met stijve cantilevers (> 10 N / m in water 53) voor een goede signaal-ruisverhouding, met het risico schadelijke zachte samples over grote hoogteverschillen. De behoefte aan stijve uitkragingen is om de thermische ruis die belangrijker dat het signaal gemeten Bij het werken met kleine amplitudes, de lange afstand interacties tussen de tip en het monster zijn nog steeds aanwezig, maar zijn grotendeels constant en hebben geen invloed op kan worden overwonnen hoge-resolutie contrast in de beelden verkregen.
Netheid van de imaging-omgeving is van het grootste belang als het gaat om hoge-resolutie AFM. Ongewenste stoffen in het systeem interfereren met zowel de beeldvorming en de kracht spectroscopie. Er zijn twee hoofdcategorieën van verontreinigingen die de neiging hebben de experimenten beïnvloeden: (i) verontreinigingen direct zichtbaar bij beeldvorming ( <strong> Figuur 4B, 4C) en (ii) algemene onverklaarbare ontbreken van een hoge resolutie. Geval (i) neigt slechts in sterk geïdealiseerde systemen zoals de water-mica interface waar geadsorbeerde moleculaire aggregaten die interfereren met de tip-sample interacties duidelijk afsteken tegen atomair vlakke mica oppervlak (Figuur 4A) optreedt. Voordat u de tip en het monster, is het de moeite waard het verwerven van spectroscopische bochten met een grote uitslag, effectief herhaaldelijk op harde de tip tegen het monster. Dit zou normaal gesproken beschadigen van een nieuwe tip, maar kan af en toe een vuile tip schoon te maken of induceren stabiel hydratatie geschikte plaatsen voor de beeldvorming. Dit punt zal echter onvermijdelijk stomp en derhalve alleen geschikt voor vlakke monster zelfs als de beeldvorming ten goede komt. In geval van een vermoeden van besmetting dan stijf monsters, kan het proberen waard om de afbeelding met de tweede eigenmode van de cantilever voordat de ietwat destructieve procedure zoals hierboven beschreven zijn. Dit vereist gewoon swjeuk de drijvende frequentie naar de tweede eigenmode en bijstelling van de amplitude / setpoint (zie de discussie over het oplossen van problemen hieronder). De effectieve stijfheid van de cantilever aanzienlijk toeneemt bij gebruik bij de tweede eigenmode en eventuele zwak geadsorbeerd verontreiniging kan rijden met de punt, terwijl beeldvorming worden geduwd. Deze strategie is geen vervanging voor de behoefte aan een schone monster en tip, maar biedt wat meer mogelijkheden om goede foto's te verwerven wanneer een tip / monster is duidelijk niet ideaal.
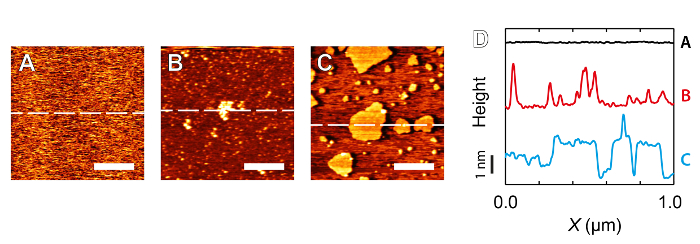
Figuur 4: Voorbeelden van verontreiniging waargenomen wanneer beeldvorming micamica die hoge-resolutie beeldvorming te remmen. A: Mica afgebeeld in 5 mM RbCl – geen verontreinigende deeltjes zichtbaar zijn. B: Verontreiniging in de vorm van aggregaten van de orde van tientallen nm over, terwijl de beeldvorming in nominaal ultrapuur water. C: Zelf geassembleerde structuren gevormd door contaminant deeltjes vermoedelijk amfifiele in de natuur. Imaging werd opnieuw uitgevoerd in nominaal ultrapuur water. D: Verticaal offset secties die overeenkomen met de stippellijnen in A, B en C illustreren de afwijking van atomair vlakke ondergrond mica's. Schaalbalken in A, B en C komen overeen met 300 nm. Klik hier om een grotere versie van deze figuur te bekijken.
Geval (ii) komt vaker en vooral gekenmerkt door de frustrerende feit dat sub-nanometer functies kunnen simpelweg niet worden opgelost, ongeacht de beeldvormingsomstandigheden. De ondertekening van dit soort situaties is meestal zichtbaar kracht spectroscopie meting die de neiging hebben om een aantal tegenstrijdigheden te laten zien. Deze kunnen onder meer slecht reproduceerbaar bochten en amplitude vs afstand bochten die significant afwijken van een typische sigmoïdale vorm 42. Als verontreinigingen, ionische of anderszins, zijn dispersed homogeen door de vloeistof, kunnen ze niet worden weergegeven in topografische beeldvorming, maar kon de hydratatie structuur van het monster 69, wat cruciaal is voor het handhaven van een regelmatige tip-sample interactie 29 en het verkrijgen van hoge resolutie 70 verstoren. Er kunnen ook directe effecten van de verontreinigingen op het monster, met name in zachte biologische experimenten. Zo is het bekend dat de aanwezigheid van alcoholen (van de reinigingsprocedure) gel-fase lipide bilagen kan fluidify 71-73, waardoor subnanometerniveau resolutie mogelijk. Indien hoge resolutie niet mogelijk is, moet erop worden eerst in het reinigingsproces, met name gericht op alle apparatuur die in contact met de beeldvormende oplossing komt. Zelfs ogenschijnlijk stabiele verbindingen zoals epoxyhars solvaat in het fluïdum enigszins of zelfs volledig uitgehard.
Hoge-resolutie beeldvorming met AM-AFM is veeleisend, vereist geduld envaak meerdere processen voor het bereiken van de best mogelijke beeldvormende omstandigheden. Kleine experimentele problemen kunnen gemakkelijk belangrijker geworden genoeg om te voorkomen dat een hoge resolutie en het oplossen van problemen vaardigheden zijn essentieel. Hierna geven we een aantal van de meest voorkomende problemen die we met onze voorgestelde oplossing tegengekomen.
cantilever tuning
De meeste commerciële AFMs gebruiken akoestische excitatie om de cantilever drijven. In dat geval afstemmen van de cantilever, zoals beschreven in stap 5.4, nabij zijn resonantiefrequentie bepaalt vaak voldoende prestaties voor gebruik in lucht. In vloeibare milieus, de vloeistof de neiging om enkele koppeling tussen verschillende mechanische onderdelen van de AFM zoals cantilever chip en de houder veroorzaken. Dit kan invloed hebben op de schijnbare resonantie van de cantilever, vaak geïllustreerd door een cantilever frequentiespectrum dat veel scherpe pieken en dalen gewoonlijk omschreven als "bos pieken" vertoont. Daardoor is het vaak moeilijk de corre vindenct rijden frequentie. Deze pieken bestaan ook in gasomgevingen, maar vanwege de hoge waarde van de kwaliteitsfactor van cantilever, de amplitude van resonanties aanzienlijk groter 74,75. In vloeibare selecteren van de juiste piek tot de cantilever rijden kan niet gemakkelijk zijn en kan trial and error nodig. In de praktijk frequentiepiek met steilste variatie in amplitude in de "bos pieken" rond de resonantiefrequentie is meestal de beste gok ondanks dat niet noodzakelijkerwijs precies op resonantie en geeft vaak een aandrijffrequentie voldoende hoge resolutie beeldvorming te verkrijgen.
beeldvervorming
Imaging drift is vaak een probleem bij het zoeken naar een hoge resolutie en maakt de afbeeldingen er vervormd (meestal uitgerekt). Zijn oorsprong is over het algemeen thermisch, hetzij omdat de scanner / AFM niet het evenwicht bedrijfstemperatuur heeft bereikt of omdat een deel van de monstervloeistof snel verdampende (bijvoorbeeld, weergave in alcoholen ). In alle gevallen is de afwijking verwaarloosbaar bij thermisch evenwicht. Het is daarom nuttig om de temperatuur van het monster indien mogelijk lossen. Anders is het de moeite waard het verlaten van de AFM om een blanco monster (groot formaat scan bij lage scansnelheid) gedurende enkele uren scannen voordat het uitvoeren van het experiment. Als verdamping is geen probleem, wordt deze procedure best gedaan na stap 6 van de procedure, zorg ervoor dat eerst de tip te trekken op korte afstand (bijvoorbeeld 20 pm) van het oppervlak. Af en toe zal de drift zelfs na uitgebreide thermalisatie blijven. Dit geeft meestal dat de cantilever of de chip gedeeltelijk het monster te slepen terwijl imaging, iets dat kan gebeuren op zachte samenhangende monsters, zoals dunne films of als de tip / cantilever / chip is niet geschikt geplaatst. Op chips die host meer dan één cantilever / tip, is het vaak nuttig om de cantilever die niet in gebruik zijn, in plaats van hen te laten slepen over het oppervlak te breken.
ionsterkte
ntent "> Aangezien de beeldvorming wordt gedomineerd door het grensvlak vloeistof, is het soms nuttig om zout voor hoge resolutie afbeelding van het geladen oppervlak in water toegevoegd. De rol van het zout is tweeledig. Ten eerste wijzigt de hydratatie landschap van de oppervlakte afgebeeld op adsorptie, die vaak het contrast verbetert. Ten tweede helpt het scherm sterke elektrostatische interacties tussen de tip en monster (bijvoorbeeld op mica). over het algemeen grotere ionen zoals kalium, rubidium en cesium mogelijk betere beelden door hun specifieke hydratatie eigenschappen 76, en het feit dat ze vaak adsorberen hoofdzakelijk in een unieke hydratatietoestand 77.Bad cantilever / tip
Als het vermoeden bestaat dat de cantilever is een bron van besmetting (zie de symptomen hierboven beschreven), moet het eerst worden geïnspecteerd onder een optische microscoop. Indien opgeslagen in een gel doos, kan de cantilever pick-up sporen van gel polymeren of siliconenolie 59 die kunnen voorkomenIn extreme gevallen, zoals donkere vlekken, op de rug van de cantilever (zoals in figuur 5A). Fotothermische oscillatie van de cantilever kan dit vlekken veroorzaken, maar ze zijn vanwege afbraak / oververhitting van de cantilever bekleding van het groot laser. Verontreiniging neigt verschijnt op willekeurige cantilever. Een langere (12 hr) reiniging met isopropanol en vervolgens met ultrazuiver water kan ongewenste deeltjes uit de cantilever te verwijderen.
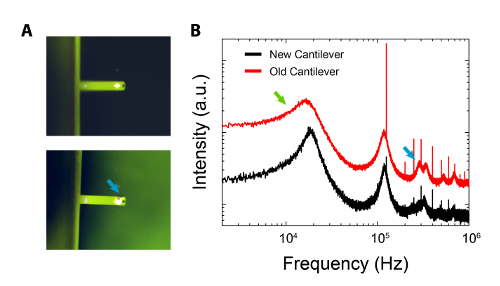
Figuur 5: Vergelijking tussen een nieuwe cantilever en een van dezelfde soort die uitgebreid is gebruikt voor harde oppervlakken en achtergelaten in een geldoos gedurende langere tijd. A: Top; optisch beeld van gloednieuwe cantilever dat is schoongemaakt (zie procedure). Bodem; optisch beeld aantonen van de verschijning van zichtbare verontreiniging (blauwe pijl) van de gel doos. B: Vergelijking van de respectieve thermische spectra uitkragingen '.Verbreding van de oude cantilever eerste resonantie piek is duidelijk (groene pijl) en een aantal hogere orde modi worden versterkt (blauwe pijl). Spectra werden verticaal afwijkend en gepresenteerd op een log-log schaal voor de duidelijkheid. Klik hier om een grotere versie van deze figuur te bekijken.
Als de gewenste sub-nanometer resolutie niet is bereikt, ondanks aanvaardbare beelden met lage resolutie, is het mogelijk dat de AFM tip is geworden chemisch gewijzigd tijdens de opslagomgeving. Dit kan worden behandeld door blootstelling van de cantilever chip een ultraviolet oxidator voor 120 seconden, waarbij het creëren van hydrofiele oppervlaktegroepen helpt op het uiteinde 60. Zorg dient echter te worden genomen, zoals de exacte tijd die nodig is kan variëren afhankelijk van de tip geometrie en UV macht, en overmatige blootstelling kan leiden tot afstomping van de tip en de lagere resolutie.
Thermische ruis </ P>
Hoge-resolutie beeldvorming vereist een grote gevoeligheid voor variaties in de kracht en de afstanden (meestal sub-pN krachten en sub-Ångström afstanden 78). Voor zachtere cantilevers, kunnen de thermo-mechanische beweging van de cantilever vanwege zijn intrinsieke Brownse beweging (thermische trillingen) een probleem. In eerste benadering, met een cantilever stijfheid k, is het onmogelijk te bepalen kenmerkt kleiner dan 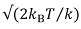 De amplitude van de thermische ruis, waarbij k B Boltzmann constante en T de temperatuur. Praktisch gebruik cantilever met hogere resonantiefrequenties verspreidt het geluid over een groter frequentiegebied, en vermindert de algemene geluidsniveau in de meetbandbreedte 79.
De amplitude van de thermische ruis, waarbij k B Boltzmann constante en T de temperatuur. Praktisch gebruik cantilever met hogere resonantiefrequenties verspreidt het geluid over een groter frequentiegebied, en vermindert de algemene geluidsniveau in de meetbandbreedte 79.
Hogere eigenmode imaging
Soms kan het nuttig zijn om de cantilever draait met het tweede eigenmodusdoor de toename effectieve stijfheid (zie bespreking contaminatie). Praktisch, dit is gewoon gedaan door het besturen van de cantilever in tweede eigenmodus (de tweede resonantie piek bij een hogere frequentie, zie figuur 1A). Bij het afstemmen van de cantilever, selecteert u de tweede eigenmode in plaats van de belangrijkste resonantie en ga verder met stap 5.4. Merk op dat de InvOLS afwijkt als de cantilever op de tweede eigenmode wordt aangedreven; typisch ~ 1/3 van de InvOLS gemeten in stap 5.2 een rechthoekige cantilever.
De belangrijkste beperking van deze techniek is dat het een stabiel solvatatie landschap aan het oppervlak van het monster. Het monster moet robuust genoeg om te verstoren het grensvlak vloeistof zonder het induceren van significante vervorming van het monster zelf. Dit kan een uitdaging op zeer zacht en onstabiele monsters zulke grote biomoleculen zijn. Bovendien, kleine amplitude AFM zoals hier beschreven kan mechanische informatie over de p niet te verkrijgenigenschappen van een monster, zoals de cantilever tip besteedt het grootste deel van zijn tijd in het grensvlak vloeistof. Hierbij kan het gunstig zijn om andere benaderingen quantitative Nanomechanical Mapping 80 gebruik of het gebruik van hogere harmonischen vrijdragende beweging. Hogere harmonica's zijn over het algemeen versterkt wanneer beeldvorming in vloeistof (met een lage kwaliteit-factoren) 29,81 – 83 en kan tegelijkertijd zorgen voor topografie en stijfheid van de monsters 25,81 – 84, maar ze zijn over het algemeen nadelig voor hoge resolutie. Andere beperkingen inherent zijn aan alle scanning probe microscopie technieken nog steeds gelden hier met name het feit dat de resultaten onvermijdelijk informaties van het meetpunt bevatten. Het gebruik van kleine amplitudes is niet ideaal voor monsters met grote hoogteverschillen; de terugkoppellus onvermijdelijk reageren trager bij hoogteverschillen groter dan de beeldvormende amplitude, dus riskeren monster en tip schade. Het gebruik of zachtere cantilever verhelpt dit probleem tot op zekere hoogte.
Het belangrijkste voordeel van de hier gepresenteerde methode is het feit dat zij de hoogst mogelijke beeldresolutie AFM in vloeistof, maar kan worden uitgevoerd op commerciële AFM, mits het geluidsniveau van de machine laag genoeg. De vergelijkbare resolutie over commerciële instrumenten wordt meestal bereikt in contact modus, of zo nu en dan in FM-AFM met stijve uitkragingen. Werken in AM-modus en met relatief zachte cantilevers maakt een ruimere keuze van de monsters en is eenvoudiger te implementeren dan FM-AFM meeste systemen. De aanpak is gebaseerd op het benutten van de solvatatie krachten op het raakvlak tussen een vaste en vloeibare bestaande om de resolutie te verbeteren en krijgen lokale chemische informatie. Deze kan in principe worden gebruikt omgevingsomstandigheden, enkel op basis van de waterlagen (typisch enkele nanometers dik) opbouw op de meeste oppervlakken vanwege vochtigheid van de lucht. De beginselen die ten grondslag liggen aan dehoge-resolutie strategie ongewijzigd maar de meeste van de tip in de lucht, met slechts een capillair brug tussen de punt apex en het monster 85. High-resolution is aangetoond op stijf monsters in deze voorwaarden 86,87. De beeldvormende omstandigheden echter anders dan die ondergedompeld vloeistof door een hogere Q-factor oscillatie de cantilever is. Praktisch, vonden we het moeilijk bereiken stabiele werking via zacht of onregelmatige monsters, vermoedelijk als gevolg van tijdelijke veranderingen in de capillaire brug en verhoogde Q-factoren voor een bepaalde cantilever stijfheid.
De hierin beschreven protocol biedt een methode voor het bereiken van moleculair niveau resolutie beelden van de monsters in de vloeistof met de meeste moderne commerciële AM-AFMs. Wij zorgen voor de wetenschappelijke rationale achter onze keuze voor imaging parameters en benadrukken de rol van solvatatie krachten. We bespreken ook gemeenschappelijke problemen en in het bijzonder besmetting. De specifieke tip-sample interacties can variëren sterk afhankelijk van de inhoud van de imaging-oplossing, de cantilever geometrie en materialen, en het monster chemie. Een praktische kennis van de aard van de dominante krachten tijdens het scannen aanwezig is daarom essentieel om dit protocol aan te passen aan nieuwe en betrouwbare resultaten. Wanneer geoptimaliseerd, de experimentele benadering is krachtig te winnen in-situ lokale moleculair niveau inzicht van de monsters in oplossing.
Disclosures
The authors have nothing to disclose.
Acknowledgements
De financiering van de Engineering and Physical Sciences Research Council (subsidies 1.452.230 en EP / M023915 / 1), de biotechnologie en biologische Science Research Council (verlenen BB / M024830 / 1) en de Europese Raad (FP7 CIG 631.186) worden bedankt.
Materials
| Multimode IIIA AFM | Brucker | NA | One of the machine used |
| Cypher ES AFM | Asylum Resarch | NA | One of the machine used |
| AFM cantilever/tip | Nanoworld | Arrow UHF-AUD | best for high frequency |
| AFM cantilever/tip | Olympus | RC800-PSA | versatile and cheap |
| ultrapure water | Milipore | NA | lab filtering systems can induce contamination |
| Dimethyl sulfoxide | Sigma-Aaldrich | 200-664-3 | standard chemical, no further purification |
| Monovalent salts | Sigma-Aaldrich | standard chemical, no further purification | |
| Lipids | Avanti polar lipids | lipid bilayers formed using stadard protocols | |
| Crystals | MTI | polished crystals | |
| Scotch tape | 3M | Scotch Magic Tape | Translucent tape works best. Transparent sticks too strongly |
References
- Binnig, G., Quate, C. F. Atomic Force Microscope. Phys. Rev. Lett. 56 (9), 930-933 (1986).
- Rico, F., Su, C., Scheuring, S. Mechanical mapping of single membrane proteins at submolecular resolution. Nano Lett. 11 (9), 3983-3986 (2011).
- Payam, A. F., Ramos, J. R., Garcia, R. Molecular and nanoscale compositional contrast of soft matter in liquid: interplay between elastic and dissipative interactions. ACS Nano. 6 (6), 4663-4670 (2012).
- Grandbois, M. How Strong Is a Covalent Bond. Science. 283 (5408), 1727-1730 (1999).
- Oesterhelt, F. Unfolding Pathways of Individual Bacteriorhodopsins. Science. 288 (5463), 143-146 (2000).
- McLean, R. S., Doyle, M., Sauer, B. B. High-Resolution Imaging of Ionic Domains and Crystal Morphology in Ionomers Using AFM Techniques. Macromolecules. 33 (17), 6541-6550 (2000).
- Scheuring, S., Reiss-Husson, F., Engel, A., Rigaud, J. L., Ranck, J. L. High-resolution AFM topographs of Rubrivivax gelatinosus light-harvesting complex LH2. EMBO J. 20 (12), 3029-3035 (2001).
- Novoselov, K. S., et al. Two-dimensional atomic crystals. Proc. Natl. Acad. Sci. U. S. A. 102 (30), 10451-10453 (2005).
- Freeman, M. R., Choi, B. C. Advances in magnetic microscopy. Science. 294 (5546), 1484-1488 (2001).
- Bockrath, M., et al. Scanned Conductance Microscopy of Carbon Nanotubes and λ-DNA. Nano Lett. 2 (3), 187-190 (2002).
- Oliver, R. A. Advances in AFM for the electrical characterization of semiconductors. Reports Prog. Phys. 71 (7), 076501 (2008).
- Butt, H. -. J., Jaschke, M. Calculation of thermal noise in atomic force microscopy. Nanotechnology. 6 (1), 1-7 (1995).
- Majumdar, A., Carrejo, J. P., Lai, J. Thermal imaging using the atomic force microscope. Appl. Phys. Lett. 62 (20), 2501 (1993).
- Vezenov, D. V., Noy, A., Ashby, P. Chemical force microscopy: probing chemical origin of interfacial forces and adhesion. J. Adhes. Sci. Technol. 19 (3-5), 313-364 (2005).
- Gerber, C., Lang, H. P. How the doors to the nanoworld were opened. Nat. Nanotechnol. 1 (1), 3-5 (2006).
- Bharat, B. . Encyclopedia of Nanotechnology. , (2012).
- Giessibl, F. J. Subatomic Features on the Silicon (111)-(7×7) Surface Observed by Atomic Force Microscopy. Science. 289 (5478), 422-425 (2000).
- Haugstad, G. . Atomic Force Microscopy. , (2012).
- Moreno-Herrero, F., Colchero, J., Gòmez-Herrero, J., Barò, A. M. Atomic force microscopy contact, tapping, and jumping modes for imaging biological samples in liquids. Phys. Rev. E. Stat. Nonlin. Soft Matter Phys. 69 (3), 031915 (2004).
- Gan, Y. Atomic and subnanometer resolution in ambient conditions by atomic force microscopy. Surf. Sci. Rep. 64 (3), 99-121 (2009).
- Kodera, N., Yamamoto, D., Ishikawa, R., Ando, T. Video imaging of walking myosin V by high-speed atomic force microscopy. Nature. 468 (7320), 72-76 (2010).
- Picco, L. M., et al. High-speed AFM of human chromosomes in liquid. Nanotechnology. 19 (38), 384018 (2008).
- Fantner, G. E., et al. Components for high speed atomic force microscopy. Ultramicroscopy. 106 (8-9), 881-887 (2006).
- Garcia, R., Herruzo, E. T. The emergence of multifrequency force microscopy. Nat. Nanotechnol. 7 (4), 217-226 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat. Nanotechnol. 6 (12), 809-814 (2011).
- Fukuma, T., Higgins, M. J., Jarvis, S. P. Direct imaging of individual intrinsic hydration layers on lipid bilayers at Angstrom resolution. Biophys. J. 92 (10), 3603-3609 (2007).
- Higgins, M. J., et al. Structured water layers adjacent to biological membranes. Biophys. J. 91 (7), 2532-2542 (2006).
- Kobayashi, K., Oyabu, N., et al. Visualization of hydration layers on muscovite mica in aqueous solution by frequency-modulation atomic force microscopy. J. Chem. Phys. 138 (18), 184704 (2013).
- Voïtchovsky, K. Anharmonicity, solvation forces, and resolution in atomic force microscopy at the solid-liquid interface. Phys. Rev. E. Stat. Nonlin. Soft Matter Phys. 88 (2), 022407 (2013).
- Müller, D. J., Dufrêne, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat. Nanotechnol. 3 (5), 261-269 (2008).
- Alessandrini, A., Seeger, H. M., Di Cerbo, A., Caramaschi, T., Facci, P. What do we really measure in AFM punch-through experiments on supported lipid bilayers. Soft Matter. 7 (15), 7054 (2011).
- Schmidt, S., Biegel, E., Müller, V. The ins and outs of Na(+) bioenergetics in Acetobacterium woodii. Biochim. Biophys. Acta. 1787 (6), 691-696 (2009).
- Bippes, C. A., Muller, D. J. High-resolution atomic force microscopy and spectroscopy of native membrane proteins. Reports Prog. Phys. 74 (8), 086601 (2011).
- Chada, N., et al. Glass is a Viable Substrate for Precision Force Microscopy of Membrane Proteins. Sci. Rep. 5, 12550 (2015).
- Möller, C., Allen, M., Elings, V., Engel, A., Müller, D. J. Tapping-mode atomic force microscopy produces faithful high-resolution images of protein surfaces. Biophys. J. 77 (2), 1150-1158 (1999).
- Antoranz Contera, S., Voïtchovsky, K., Ryan, J. F. Controlled ionic condensation at the surface of a native extremophile membrane. Nanoscale. 2 (2), 222-229 (2010).
- Kumaki, J. Observation of polymer chain structures in two-dimensional films by atomic force microscopy. Polym. J. 48 (1), 3-14 (2015).
- Voïtchovsky, K., et al. In Situ Mapping of the Molecular Arrangement of Amphiphilic Dye Molecules at the TiO Surface of Dye-Sensitized Solar Cells. ACS Appl. Mater. Interfaces. 7 (20), 10834-10842 (2015).
- Segura, J. J., et al. Adsorbed and near surface structure of ionic liquids at a solid interface. Phys. Chem. Chem. Phys. 15 (9), 3320-3328 (2013).
- Hayes, R., Warr, G. G., Atkin, R. Structure and Nanostructure in Ionic Liquids. Chem. Rev. 115 (13), 150601082109009 (2015).
- Fukuma, T., Kobayashi, K., Matsushige, K., Yamada, H. True atomic resolution in liquid by frequency-modulation atomic force microscopy. Appl. Phys. Lett. 87 (3), 034101 (2005).
- Voïtchovsky, K., Kuna, J. J., Contera, S. A., Tosatti, E., Stellacci, F. Direct mapping of the solid-liquid adhesion energy with subnanometre resolution. Nat. Nanotechnol. 5 (6), 401-405 (2010).
- Siretanu, I., et al. Direct observation of ionic structure at solid-liquid interfaces: a deep look into the Stern Layer. Sci. Rep. 4, 4956 (2014).
- Ricci, M., Spijker, P., Voïtchovsky, K. Water-induced correlation between single ions imaged at the solid-liquid interface. Nat. Commun. 5, 4400 (2014).
- Kiracofe, D., Raman, A. On eigenmodes, stiffness, and sensitivity of atomic force microscope cantilevers in air versus liquids. J. Appl. Phys. 107 (3), 033506 (2010).
- San Paulo, A., Garcìa, R. High-resolution imaging of antibodies by tapping-mode atomic force microscopy: attractive and repulsive tip-sample interaction regimes. Biophys. J. 78 (3), 1599-1605 (2000).
- Garcìa, R., San Paulo, A. Attractive and repulsive tip-sample interaction regimes in tapping-mode atomic force microscopy. Phys. Rev. B. 60 (7), 4961-4967 (1999).
- Butt, H. J. Electrostatic interaction in atomic force microscopy. Biophys. J. 60 (4), 777-785 (1991).
- Israelachvili, J. N. Intermolecular and Surface Forces. Intermol. Surf. Forces. , (2011).
- Yu, C. -. J., et al. Order in molecular liquids near solid-liquid interfaces. Appl. Surf. Sci. 182 (3-4), 231-235 (2001).
- Ortiz-Young, D., Chiu, H. -. C., Kim, S., Voïtchovsky, K., Riedo, E. The interplay between apparent viscosity and wettability in nanoconfined water. Nat. Commun. 4, 2482 (2013).
- Patil, S. V., Hoffmann, P. M. Small-Amplitude Atomic Force Microscopy. Adv. Eng. Mater. 7 (8), 707-712 (2005).
- Fukuma, T., Jarvis, S. P. Development of liquid-environment frequency modulation atomic force microscope with low noise deflection sensor for cantilevers of various dimensions. Rev. Sci. Instrum. 77 (4), 043701 (2006).
- Burkhardt, M., et al. Concept of a molecular charge storage dielectric layer for organic thin-film memory transistors. Adv. Mater. 22 (23), 2525-2528 (2010).
- Garcìa, R. . Amplitude Modulation Atomic Force Microscopy. , (2010).
- Uchihashi, T., et al. Quantitative force measurements in liquid using frequency modulation atomic force microscopy. Appl. Phys. Lett. 85 (16), 3575 (2004).
- Yamada, H., et al. Molecular Resolution Imaging of Protein Molecules in Liquid Using Frequency Modulation Atomic Force Microscopy. Appl. Phys. Express. 2 (9), 095007 (2009).
- Stark, M., et al. From Images to Interactions: High-Resolution Phase Imaging in Tapping-Mode Atomic Force Microscopy. Biophys. J. 80 (6), 3009-3018 (2001).
- Lo, Y. -. S., et al. Organic and Inorganic Contamination on Commercial AFM Cantilevers. Langmuir. 15 (19), 6522-6526 (1999).
- Akrami, S. M. R., Nakayachi, H., Watanabe-Nakayama, T., Asakawa, H., Fukuma, T. Significant improvements in stability and reproducibility of atomic-scale atomic force microscopy in liquid. Nanotechnology. 25 (45), 455701 (2014).
- Meyer, G., Amer, N. M. Novel optical approach to atomic force microscopy. Appl. Phys. Lett. 53 (12), 1045 (1988).
- Alexander, S., et al. An atomic-resolution atomic-force microscope implemented using an optical lever. J. Appl. Phys. 65 (1), 164 (1989).
- Green, C. P., et al. Normal and torsional spring constants of atomic force microscope cantilevers. Rev. Sci. Instrum. 75 (6), 1988 (2004).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Rev. Sci. Instrum. 64 (2), 403 (1993).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev. Sci. Instrum. 64 (7), 1868 (1993).
- Sader, J. E., Larson, I., Mulvaney, P., White, L. R. Method for the calibration of atomic force microscope cantilevers. Rev. Sci. Instrum. 66 (7), 3789 (1995).
- Ricci, M., Quinlan, R., Voitchovsky, K. No Title. Soft Matter. , (2016).
- Ricci, M., Spijker, P., Stellacci, F., Molinari, J. -. F., Voïtchovsky, K. Direct visualization of single ions in the Stern layer of calcite. Langmuir. 29 (7), 2207-2216 (2013).
- Kilpatrick, J. I., Loh, S. -. H., Jarvis, S. P. Directly probing the effects of ions on hydration forces at interfaces. J. Am. Chem. Soc. 135 (7), 2628-2634 (2013).
- Fukuma, T., et al. Mechanism of atomic force microscopy imaging of three-dimensional hydration structures at a solid-liquid interface. Phys. Rev. B. 92 (15), 155412 (2015).
- Maula, T., Westerlund, B., Slotte, J. P. Differential ability of cholesterol-enriched and gel phase domains to resist benzyl alcohol-induced fluidization in multilamellar lipid vesicles. Biochim. Biophys. Acta. 1788 (11), 2454-2461 (2009).
- Schroeder, F., Morrison, W. J., Gorka, C., Wood, W. G. Transbilayer effects of ethanol on fluidity of brain membrane leaflets. Biochim. Biophys. Acta – Biomembr. 946 (1), 85-94 (1988).
- Tierney, K. J., Block, D. E., Longo, M. L. Elasticity and phase behavior of DPPC membrane modulated by cholesterol, ergosterol, and ethanol. Biophys. J. 89 (4), 2481-2493 (2005).
- Basak, S., Raman, A. Dynamics of tapping mode atomic force microscopy in liquids: Theory and experiments. Appl. Phys. Lett. 91 (6), 064107 (2007).
- Eslami, B., Solares, S. D. Experimental approach for selecting the excitation frequency for maximum compositional contrast in viscous environments for piezo-driven bimodal atomic force microscopy. J. Appl. Phys. 119 (8), 084901 (2016).
- Collins, K. D., Neilson, G. W., Enderby, J. E. Ions in water: characterizing the forces that control chemical processes and biological structure. Biophys. Chem. 128 (2-3), 95-104 (2007).
- Lee, S. S., Fenter, P., Park, C., Sturchio, N. C., Nagy, K. L. Hydrated cation speciation at the muscovite (001)-water interface. Langmuir. 26 (22), 16647-16651 (2010).
- Liang, S., et al. Thermal noise reduction of mechanical oscillators by actively controlled external dissipative forces. Ultramicroscopy. 84 (1-2), 119-125 (2000).
- Hodges, A. R., Bussmann, K. M., Hoh, J. H. Improved atomic force microscope cantilever performance by ion beam modification. Rev. Sci. Instrum. 72 (10), 3880 (2001).
- Adamcik, J., Berquand, A., Mezzenga, R. Single-step direct measurement of amyloid fibrils stiffness by peak force quantitative nanomechanical atomic force microscopy. Appl. Phys. Lett. 98 (19), 193701 (2011).
- Preiner, J., Tang, J., Pastushenko, V., Hinterdorfer, P. Higher harmonic atomic force microscopy: imaging of biological membranes in liquid. Phys. Rev. Lett. 99 (4), 046102 (2007).
- Dulebo, A., et al. Second harmonic atomic force microscopy imaging of live and fixed mammalian cells. Ultramicroscopy. 109 (8), 1056-1060 (2009).
- Xu, X., Melcher, J., Basak, S., Reifenberger, R., Raman, A. Compositional contrast of biological materials in liquids using the momentary excitation of higher eigenmodes in dynamic atomic force microscopy. Phys. Rev. Lett. 102 (6), 060801 (2009).
- Turner, R. D., Kirkham, J., Devine, D., Thomson, N. H. Second harmonic atomic force microscopy of living Staphylococcus aureus bacteria. Appl. Phys. Lett. 94 (4), 043901 (2009).
- Barcons, V., Verdaguer, A., Font, J., Chiesa, M., Santos, S. Nanoscale Capillary Interactions in Dynamic Atomic Force Microscopy. J. Phys. Chem. C. 116 (14), 7757-7766 (2012).
- Wastl, D. S., Weymouth, A. J., Giessibl, F. J. Atomically resolved graphitic surfaces in air by atomic force microscopy. ACS Nano. 8 (5), 5233-5239 (2014).
- Wastl, D. S., Judmann, M., Weymouth, A. J., Giessibl, F. J. Atomic Resolution of Calcium and Oxygen Sublattices of Calcite in Ambient Conditions by Atomic Force Microscopy Using qPlus Sensors with Sapphire Tips. ACS Nano. 9 (4), 3858-3865 (2015).

