הדמיה ברזולוציה משנה ננומטר עם מיקרוסקופית כוח אטומי משרעת אפנון בנוזל
Summary
אנו מציגים שיטה להשגת תמונות ברזולוציה מהשנה ננומטר עם אפנון משרעת (קשה במצב) במיקרוסקופ כוח אטומי בנוזל. השיטה מודגמת על מיקרוסקופי כוח אטומיים מסחריים. אנחנו מסבירים את הרציונל מאחורי הבחירות שלנו פרמטרים ולהציע אסטרטגיות אופטימיזציה רזולוציה.
Abstract
Atomic force microscopy (AFM) has become a well-established technique for nanoscale imaging of samples in air and in liquid. Recent studies have shown that when operated in amplitude-modulation (tapping) mode, atomic or molecular-level resolution images can be achieved over a wide range of soft and hard samples in liquid. In these situations, small oscillation amplitudes (SAM-AFM) enhance the resolution by exploiting the solvated liquid at the surface of the sample. Although the technique has been successfully applied across fields as diverse as materials science, biology and biophysics and surface chemistry, obtaining high-resolution images in liquid can still remain challenging for novice users. This is partly due to the large number of variables to control and optimize such as the choice of cantilever, the sample preparation, and the correct manipulation of the imaging parameters. Here, we present a protocol for achieving high-resolution images of hard and soft samples in fluid using SAM-AFM on a commercial instrument. Our goal is to provide a step-by-step practical guide to achieving high-resolution images, including the cleaning and preparation of the apparatus and the sample, the choice of cantilever and optimization of the imaging parameters. For each step, we explain the scientific rationale behind our choices to facilitate the adaptation of the methodology to every user’s specific system.
Introduction
מאז ההמצאה שלה, לפני שלושה עשורים, מיקרוסקופ כוח אטומי (AFM) 1 בסס את עוצמה בתור טכניקה שבה נקט חוקר דגימות ב הננומטרי, במיוחד כאשר ממוצעים על פני שטחי משטח מקרוסקופי לא ניתן ומידע מקומי נדרש. במדידת AFM טיפוסית, הסטייה של שלוחה גמישה משמשת לכמת את כוח האינטראקציה בין מספר קטן של מולקולות טיפ UltraSharp הרכוב בסוף השלוחה. בהתאם לסוג של אינטראקציות ואת לוחות הזמנים הנחשבים, מגוון רחב של סוגי מידע ניתן לגזור, כולל את מאפייני viscoelastic של ממברנות ביולוגיות רכות 2,3, כוחו של כימיקל בודד או אג"ח מולקולרי 4,5, הפרטים האטומיסטית של משטח 6 – 8, 9 המגנטים, קיבולים 10, ניצוח 11, 12,13 תרמי 14 תכונות כימיות של דגימות <sup> 15. חלק מההצלחה של AFM הוא יכולתו לעבוד על מגוון רחב של חומרים 16 ו בסביבות מרובות כגון ואקום 17, גז 11,18 או 19,20 נוזלי, כי זה אינו מסתמך על כוח ספציפי בין החללית לבין מדגם .
בפועל, עם זאת, בהפעלת AFM בתנאים אחרים מאשר הסביבה יכולה להיות תוצאות שפורסמו מאתגר ורבים עדיין מתקבלות באוויר. הוסיף קושי נובע מהעובדה שזה בדרך כלל יש צורך להפעיל את AFM במצב דינמי (טיפ רוטט) על מנת לשמר הן קצה מדגם ידי הימנעות כוחות חיכוך גדולים. אמנם יותר מאתגר, תפעול דינמי יכול עקרונית לספק מידע נוסף על המדגם נתח, וללא פסד של רזולוציה מרחבית. בעשור האחרון, בתחום AFM הדינמי בנוזל רואה התפתחויות חשובות, מאז הופעתו של AFM וידאו שער 21 – 23, על מדידות multifrequency <sup> 24,25 ו ננומטר תת הדמיה של מבנים הידרציה בממשקים 26 – 31. המבצע AFM בעודי שקוע בנוזל עכשיו משמש באופן שגרתי בביולוגיה וביופיסיקה 32 – 36, פולימר המחקר 37, אלקטרוכימיה 38 – 40 ו אפיון ממשקי-נוזלי מוצק 41 – 44. הנוכחות של נוזל מסביב השלוחה הרוטטת משנה הדינמיקה שלה באופן משמעותי 45 כמו גם את האינטראקציה בין העצה לבין המדגם 29,42. כאשר נעשה שימוש כראוי, הנוזל ניתן לנצל כדי לשפר את רזולוציית הדמיה 26,29, עם שיפור אופייני כמעט בסדר גודל לעומת ההחלטה הטובה ביותר מושגת בתנאי הסביבה 46.
ב AFM, ברזולוציה מרחבית הכי הגבוהה שניתן למדידה מסוימת תלויה הוא על איכות AFM עצם ואת אופי tאינטראקציה הוא נחקר 20,47,48. נכון לעכשיו, רוב high-end, רמות הרעש הנוכחיות AFMs הזמין מסחרי כי הם קרובים לזה של גבול תרמית 12 כך הגורם הקובע עבור רזולוציה היא בדרך כלל האינטראקציה טיפ-המדגם. זה ביעילות השיפוע המרחבי של אינטראקציה זו הקובעת את ההחלטה: מדידות מבוססות על טווח קצר, מתפורר אינטראקציה במהירות לייצר תוצאות ברזולוציה גבוהות יותר מאשר כאשר אינטראקציות לטווח ארוך נמצאות לשחק. בנוזל, כוחות solvation יכולים לשפר את רזולוצית הדמיה משום שהם נוטים להיעלם מעל כמה קטרים מולקולריים רק של הנוזל (בדרך כלל <1 ננומטר) כאשר מתרחקים מפני השטח של המדגם 49. כוחות אלה נובעים האינטראקציה בין מולקולות הנוזל ואת השטח של המדגם. נוזל עם זיקה חזקה עבור השטח יהיה נוטה להיות הורה יותר ופחות נייד מאשר נוזלים בצובר על הממשק עם המדגם 29,42,50. כתוצאה מכך,זה ייקח יותר אנרגיה עבור טיפ AFM רוטט לעקור מולקולות נוזל interfacial מ -42 נוזלים בצובר, טיוח המדידה רגישה מאוד וריאציות מקומיות מאפייני נוזל interfacial הננומטרי -The נוף solvation.
כדי לנצל כוחות solvation, כמה היבטים מעשיים צריכים להילקח בחשבון. ראשית, משרעת התנודה של הקצה צריכה להיות דומה בטווח של כוחות solvation, בדרך כלל <1 ננומטר. שנית, הנוזל המשמש חייב ליצור נוף solvation מוגדר היטב על פני השטח של המדגם. Macroscopically, זו שקולה המחייב נוזל "הרטבה" למדגם נחשב. לדוגמה, במים קל יותר להשיג רזולוציה ברמה המולקולרית על נציץ הידרופילי מאשר על 42,51 גרפיט הידרופובי. לבסוף, קבוע הקפיץ של שלוחת תומכי הקצה יש לבחור כראוי 52,53. כשעובדים ב con אלהditions, ה- AFM לא רק לספק תמונות ברמה המולקולרית של הממשק, אבל זה גם נובע מידע על זיקת מדגם הנוזלית המקומית אשר יכול לשמש כדי לקבל מידע כימי על פני השטח של המדגם 54.
מצבי הדינמי הנפוץ ביותר של פעולה עבור AFM בנוזל הם אפנון משרעת (AM, גם 'קשה במצב') AFM ותדירות האפנון (FM) AFM. במקרה הראשון 55, קצה הסריקה-סורק המדגם בעוד משרעת הרטט שלה נשמרה קבועה על ידי לולאת משוב רציף מחדש מתאימה את מרחק טיפ-מדגם. תמונה טופוגרפית של המדגם המתקבל התיקון מיושם על ידי לולאת המשוב. ב FM-AFM 28,41,56, שזו תדירות התנודה של השלוחה / טיפ כי נשמר קבוע בעוד טיפ סורק את המדגם. טכניקות שניהם מספקות רזולוציה טופוגרפית דומה 36,57 נוזלי. כימות של האינטראקציה טיפ-המדגם נוטה להיות יותר straightforward ומדויק FM-AFM, אבל AM-AFM הוא קל יותר ליישם, חזקים יותר, ומאפשר עבודה עם cantilevers רך, משהו שימושי לחקר דגימות ובר-עיוות או עדין בקלות. באופן משמעותי, AM-AFM נפוץ יותר בקרב משתמשי AFM, חלקית בגלל סיבות הסטוריות, אלא גם בשל העובדה כי קל יותר טכני לשלוט.
למרות משרעת נשמר קבוע על ידי לולאת המשוב במהלך הדמית AM-AFM, השלב בפיגור בין תנודת הקצה ועל תנודת הנהיגה מותר לשנות באופן חופשי. השלב בפיגור יכול לספק מידע שימושי על אינטראקציות טיפ-מדגם, קישורו האנרגיה התפוגגה במהלך התנודה של הקצה על הממשק עם המדגם 58. לפיכך בשלב הדמיה ניתן לרכוש בו זמנית הדמיה טופוגרפית, והוא בדרך כלל משלימים המדגישים את ההטרוגניות של שטח מדגם. בשלב הדמיה נוצלה למיפוי אינטראקציות שונה, לרבות diמיפוי rect של אנרגיה הידבקות 42, נכסים viscoelastic 58 והנוף הידרציה של ממשק 44.
למעשה, קבלת תמונות ברזולוציה גבוהה בנוזל נשאר לא טריוויאלית עקב מספר רב של פרמטרים לשלוט, והיעדר פרוטוקול פשוט ושיטתי, אשר עובד בכל מצב. איכות תמונה בדרך כלל תלויה בגיאומטרית השלוחה ואלסטיות, כימית הקצה, משרעת התנודה, ואת קשיחות המדגם, בין היתר 55. מדידות AFM גם, מעצם הגדרתה, perturbative למערכת. כתוצאה מכך, שינוי משתנה הדמיה ותנאים סביבתיים ללא שיקולים ראויים יכול להוביל לקושי שחזור ו / או תצפיות מסולפות ומטעה ותוצאות מזויפות.
כאן, אנו מציגים פרוטוקול שלנו להשגת תמונות ברזולוציה גבוהה של דגימות קשות ורכות בתמיסה, באמצעות מכשירים מסחריים פעלו amplitude אפנון. המטרה שלנו היא להציע נוהל מעשי עבור אופטימיזציה של הפרמטרים העיקריים העשויים להשפיע על ההחלטה על מדגמים שונים, להסביר בכל מקרה את הרציונל הבחירות שלנו מן העקרונות הפיסיקליים שבבסיס תהליך ההדמיה. נפרט גישה צעד אחר צעד, מן ניקוי המצע והכנה, לבחירה של שלוחה, התאמת הפרמטרים הדמיה ופתרון בעיות בעיות נפוצות. סבר הרציונל המדעי מאחורי הבחירות והנהלים שלנו ברזולוציה גבוהה צריכה לעזור קבלת החלטות רציונלים כאשר התאמת המתודולוגיה, ולשמש כנקודת התחלה עבור מערכות רומן הדמיה.
לאורך הטקסט הזה אנו משתמשים AM להתייחס במצב פעולה משרעת אפנון של AFM. אנו מתייחסים לפרמטר משוב נשמר קבוע במהלך או סטיה שלוחה (מצב הקשר) או משרעת התנודה (מצב AM) כערך setpoint. במצב AM, השלוחה היא מונעת באופן חיצוניבין אם על ידי תנודה אקוסטית או על ידי קרן לייזר פעמו התמקדו בבסיס של שלוחה. משרעת drive היא עוצמת האות תנודתית החיצונית. הערך המוחלט של האמפליטודה הכונן הנדרשת כדי להשיג משרעת תנודה נתונה של שלוחה תלוי בפרמטרים רבים כגון שיטת נהיגה (אקוסטית, photothermal או מגנטי), קיבעון שלוחה ופרמטרים (נוקשות, גיאומטריה) ויישור ליזר. הערך המדויק של משרעת כונן ולכן כבר לא רלוונטי אבל הוא מותאם בכל ניסוי כדי לספק משרעת תנודה מתאימה (וכמותיים) של השלוחה. כאשר השלוחה מונעת היא רחוק מן המדגם ולא דעיכה של הרטט שלה מתרחשת דרך אינטראקציות טיפ-מדגם, משרעת התנודה שלה נקראת משרעת התנודה בחינם. כמו הקצה הרוטט מתקרב פני השטח של המדגם, משרעת שלה מתחיל ירידה. אם המשוב מופעלת, z-piezo יהיה constantly מחדש להתאים הארכתה כך להתעלף משרעת setpoint שנבחרו, מתמיד. שווי setpoint הוא בדרך כלל תמיד קטן יותר משרעת בחינם. זה מקובל להתייחס ליחס setpoint, היחס בין משרעת setpoint (משרעת הדמיה) על משרעת בחינם. ככל שעולה יחס setpoint, את תנאי ההדמיה קשה הם.
Protocol
Representative Results
Discussion
בהנחה כי נוזל ההדמיה קשיחת השלוחה נבחרו כראוי, השלבים הקריטיים ביותר להשגה ברזולוציה גבוהה מוצלחת הם ההתאמה של משרעת ההדמיה, ואת הניקיון הכולל של המערכת הנחקרת.
אמפליטודות להשוות את עובי האזור הנוזל interfacial (בדרך כלל פחות מ 2 ננומטר) בדיקות בעיקר וריאציה את המאפיינים של 42 ממס interfacial. אם משרעת התנודה היא גדולה מדי, הקצה הרוטט יהיה לעבור שדות כוח ארוך טווח, שאינו ליניארי 52 שימנעו היציבות בתנועה שלוחה, ובהכרח פגעו המדגם ללא תלות בתנאי ההדמיה 29, וכתוצאה מכך להידרדרות של ההחלטה. מלבד הפסד רזולוציה, הרמוניות גבוהות מתחילות להופיע בבקשה העצה והמערכת הופכת מסובכת יותר לבנות מודל 55. לחלופין, אם משרעת ההדמיה קטנה מדי oחלק nly של הממשק הוא נחקר (בדרך כלל שכבות מסוימות של נוזל interfacial) והדמיה יציבה יכולה להיות מושגת רק עם cantilevers הנוקשה (> 10 N / m במים 53) יחס אות לרעש משביע רצון, עם הסיכון של דגימות רכות מזיקות מעל וריאציות גובה גדולות. צורך cantilevers הנוקשה הוא להתגבר על הרעש התרמי שיכול להיות משמעותיים יותר כי האות הנמדד כשעובד עם אמפליטודות קטנות, האינטראקציות ארוך הטווח בין העצה לבין המדגם עדיין קיים, אך הם קבועים במידה רבה ואינו משפיעים על ניגודיות גבוהה ברזולוציה של התמונות המתקבלות.
ניקיון של סביבת ההדמיה הוא בעלת חשיבות עליונה כאשר מדובר AFM ברזולוציה גבוהה. תרכובות בלתי רצויות במערכת יכולות להפריע הן הדמיה ואת ספקטרוסקופיה הכח. ישנם שני סוגים עיקריים של זיהומים כי נוטים להשפיע על הניסויים: (i) מזהמים גלויים ישירות כאשר הדמיה ( <strong> איור 4B, 4C) ו- (ii) חוסר מוסברת הכללית של בעלי רזולוציה גבוהה. (I) במקרה נוטה להתרחש רק במערכות מואדרת מאוד כגון בממשק מים יציצו איפה אגרגטים מולקולרי adsorbed שמפריע אינטראקציות מדגם טיפ הוא בניגוד ברור כנגד המשטח יציץ שטוח האטומי (איור 4 א). לפני שינוי העצה לבין המדגם, כדאי לרכוש עקומות ספקטרוסקופיות עם סטייה גדולה, ביעילות לחץ חזק הקצה נגד המדגם שוב ושוב. זה בדרך כלל יפגע טיפ חדש, אבל יכול מדי פעם לנקות טיפ מלוכלך או לגרום אתרי הידרציה יציבים מתאימים הדמיה. טיפ זה יהיה, עם זאת, באופן בלתי נמנע להיות קהה ומכאן להיות מתאים רק מדגם שטוח גם אם ההדמיה משפרת. במקרה של זיהום חשד מעל דגימות נוקשות, היא עשויה להיות שווה לנסות תמונה עם eigenmode השני של השלוחה לפני שתנסה את ההליך ההרסני מעט שתואר לעיל. זה פשוט דורש SWגירוד תדירות הנהיגה אל eigenmode השני מתקן את setpoint משרעת / (ר 'דיון התקלות בהמשך). הנוקשות היעילות של עליות השלוחה משמעותית כאשר פעלו באותה eigenmode השני וכל מזהם adsorbed חלושה עלול להידחף משם על ידי הקצה תוך הדמיה. אסטרטגיה זו אינה מחליפה את צורך מדגם טיפ נקי, אבל מציעה כמה דרכים נוספות לרכוש תמונות משביעות רצון כאשר מדגם טיפ / הוא בבירור לא אידיאלי.
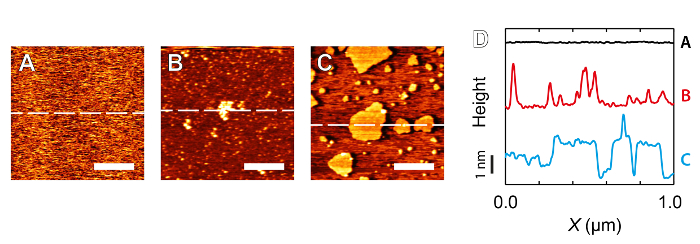
איור 4: דוגמאות של זיהום נצפו כאשר ההדמיה יציץ מוסקבאי מעכבות הדמיה ברזולוציה גבוהה. ת: מיכה צילמו 5 מ"מ RbCl – אין חלקיקים מזהמים גלויים. B: זיהום לקחת את הטופס של אגרגטים בסדר גודל של עשרות ננומטר ברחבי בעוד הדמיה במים ultrapure להלכה. C: מבנים מורכבים עצמית נוצר על ידי contamiחלקיקי nant להניח amphiphilic בטבע. הדמיה שוב נערכה במי ultrapure להלכה. D: סעיפים לקזז אנכית המתאים קווים מקווקווים ב A, B ו- C הממחישות הסטייה משטח שטוח אטומית של מיקה. ברים בקנה מידה A, B ו- C מתאימות 300 ננומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Case (ii) נפוץ יותר ומאופיין בעיקר על ידי העובדה המתסכלת כי תכונות משנה ננומטר פשוט לא יכולות להיפתר, ללא תלות בתנאי ההדמיה. החתימה של סוג של מצב זה היא בדרך כלל גלויה במדידת ספקטרוסקופיה כוח אשר נוטה להראות כמה סתירות. אלה עשויים לכלול עקומות גרועות לשחזור משרעת vs העקומה מרחק חורג באופן משמעותי מן הצורה sigmoidal טיפוסית 42. אם מזהמים, יונים או אחרים, הם dispersed הומוגנית ברחבי הנוזל, הם עשויים שלא להופיע הדמיה טופוגרפית אבל יכולים לשבש את המבנה הידרציה של המדגם 69, שהוא חיוני לשמירה על קשרים שוטפים טיפ-מדגם 29 וקבלה ברזולוציה גבוהה 70. כמו כן יכולה להיות השפעות ישירות של המזהמים על המדגם, במיוחד רכים, ניסויים ביולוגיים. לדוגמא, זה ידוע היטב כי הנוכחות של כהלים (מהליך הניקוי) יכולה לְנַזֵל bilayers שומני ג'ל פאזיים 71 – 73, טיוח ברזולוציה רמה משנת ננומטר בלתי אפשרית. אם ברזולוציה גבוהה אינה אפשרית, יש להיזהר ראשון בתהליך הניקוי, המתמקד בעיקר על כל ציוד הבא במגע עם פתרון ההדמיה. אפילו לכאורה תרכובות יציבות כגון שרף אפוקסי עשויות solvate בנוזל במידה מסוימת אם לא נרפאו לחלוטין.
הדמיה ברזולוציה גבוהה עם AM-AFM היא תובענית, דורשת סבלנותלעתים כמה ניסויים לפני שהגיע תנאי ההדמיה הטובים ביותר האפשריים. בעיות ניסיוני קטנות יכולות להיות מספיק חשובות כדי למנוע ברזולוציה גבוהה ומיומנויות פתרון בעיות חיוניות בקלות. מכאן והלאה אנו מוסיפים חלק מהבעיות הנפוצות ביותר שנתקלנו עם הפתרון המוצע שלנו.
כוונון שלוחה
רוב AFMs המסחרי להשתמש עירור אקוסטי לנהוג השלוחה. במקרה כזה, כוונון השלוחה, כמתואר בשלב 5.4, ליד תדר התהודה שלה לעתים קרובות מספק ביצועים מספיק לפעולה באוויר. בסביבות נוזלות, הנוזל נוטה לגרום צימוד כלשהו בין חלקים מכאניים השונים של AFM כגון שבב שלוחה לבעל. הדבר עלול להשפיע על התהודה לכאורה של השלוחה, לעתים קרובות מאוירת על ידי ספקטרום תדרים שלוח שמספק הרבה פסגות ועמקים חדות תארו בכינויו "יער של פסגות". כתוצאה מכך, הוא לעתים קרובות קשה למצוא את הקורתדירות כונן ct. פסגות אלה קיימות גם בסביבות גז, אך בשל הערך הגבוה של גורם איכות של שלוחה, משרעת ב תהודות גדולות באופן משמעותי 74,75. בנוזל בחירת השיא המתאים לנהוג השלוחה עשויה להיות קלה לא יכול לדרוש ניסוי וטעייה. בפועל, שיא תדירות וריאציה חדה ביותר משרעת של "היער של פסגות" סביב תדר התהודה הוא בדרך כלל ההימור הטוב ביותר למרות היותו לא בהכרח בדיוק על תהודה ולעתים קרובות מספק תדירויות נהיגה נאותות להשיג הדמיה ברזולוציה גבוהה.
עיוות תמונה
להיסחף הדמיה מהווה בעיה לעתים קרובות כאשר מחפש ברזולוציה גבוהה והופך את התמונות נראות מעוות (בדרך כלל מתוח). מקורו הוא תרמית בדרך כלל, אם משום הסורק / AFM לא הגיע טמפרטורת שיווי המשקל שלה, או כי חלק נוזל המדגם הוא מתאדה במהירות (למשל, הדמיה בכוהלים ). בכל המקרים, את הסחף הופך זניח בשיווי משקל תרמי. לכן כדאי לתקן את הטמפרטורה של המדגם במידת האפשר. אחרת, כדאי לעזוב את AFM לסרוק מדגם ריק (סריקת גודל גדול בקצב סריקה איטי) במשך כמה שעות לפני ביצוע הניסוי. אם האידוי אינו מהווה בעיה, הליך זה נעשה הכי טוב אחרי צעד 6 לנוהל, מקפיד ראשון למשוך את קצה מרחק קצר (למשל, 20 מיקרומטר) מפני השטח. לעיתים עלול להיסחף יישאר גם לאחר thermalization נרחב. לרוב, משמעות דבר שלוחה או השבבים חלקית גורר המדגם בעוד הדמיה, משהו שיכול לקרות על דגימות מלוכדות רכות כגון סרטים דקים או אם הקצה / השלוחה / השבב לא ממוקמת כראוי. על שבבים שמארחים יותר שלוחה אחת / טיפ, זה בדרך כלל מועיל לשבור השלוחה שאינן בשימוש במקום לאפשר להם להמשיך לגרור על פני השטח.
כוח יוני
ntent "> מאז ההדמיה נשלטת בידי נוזלי interfacial, זה לפעמים מועיל להוסיף קצת מלח הדמיה ברזולוציה גבוהה של פני השטח הטעונים במים. תפקידו של המלח הוא כפול. ראשית, הוא משנה את הנוף הידרציה של משטח צלם על ספיחה, אשר לעתים קרובות משפרת את הניגודיות. שנית, זה עוזר אינטראקציות אלקטרוסטטיות מסך חזקות בין העצה לבין המדגם (למשל, על מיקה). באופן כללי, אשלגן כגון יונים גדולים, רובידיום ו צזיום לאפשר תמונות טובות יותר בשל מאפייני הידרציה הספציפיים שלהם 76, ואת העובדה שהם לעתים קרובות לספוג בעיקר במצב הידרציה ייחודי 77.שלוחה רעה / טיפ
אם הוא חשוד כי השלוחה היא מקור לזיהום (ראה תסמינים שתוארו לעיל), הוא צריך להיבדק ראשון תחת מיקרוסקופ אופטי. אם מאוחסן בתוך קופסא ג'ל, השלוחה יכולה להרים עקבות של פולימרים ג'ל או סיליקון שמן 59 שיכולים להופיע, ובמקרים קיצוניים, כמו כתמים כהים, על הגב של השלוחה (כמו איור 5 א). תנודת photothermal של השלוחה יכולה לגרום כתמים דומים, אך הם נובעים שפלה / התחממות יתר של ציפוי השלוחה ידי ליזר הנהיגה. זיהום נוטה מופיע באופן אקראי על השלוחה. ארוך יותר (12 שעות) ניקוי עם isopropanol ו, ואז, עם מי ultrapure יכול לסלק את כל חלקיקים לא רצויים מן השלוחה.
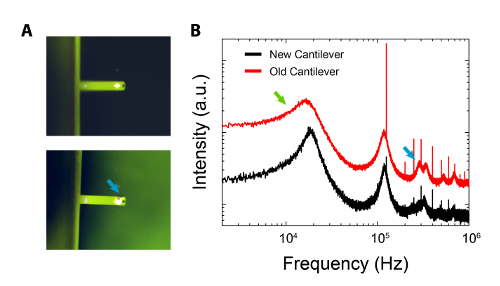
איור 5: השוואה בין שלוחה חדשה ועוד אחד זהה כי כבר נעשה שימוש נרחב על משטחים קשים והשאיר בקופסא ג'ל במשך תקופה ארוכה. ת: למעלה; תמונה אופטית של שלוחה חדשה אשר נוקתה (ראה נוהל). תַחתִית; תמונה אופטית הוכחת הופעת הזיהום גלוי (חץ כחול) מתוך תיבת ג'ל. B: השוואה בין ספקטרום תרמית בהתאמה 'cantilevers.הרחבת שיא התהודה הראשונה של השלוחה הישנה ברורה (חץ ירוק) וכמה מצבי מסדר גבוה משופרים (חץ כחול). ספקטרה מקוזזת במאונך מוצגת בסולם לוג-לוג לבהירות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
אם הרזולוציה משנה ננומטר נדרשה אינה מושגת, למרות תמונות מקובלות ברזולוציה נמוכה, יתכן כי קצה AFM הפך שינוי כימי במהלך סביבת האחסון שלה. זה יכול להיות מטופלים על ידי חשיפה של שבב השלוחה אל מחמצן אולטרא סגול 120 שניות, אשר מסייעת ביצירת קבוצות משטח הידרופילי על הקצה 60. יש להקפיד עם זאת, ככל שהזמן המדויק הדרוש עשוי להשתנות תלוי בגיאומטריה טיפ וכוח UV, לבין חשיפת יתר עלול לגרום הקהיה של קצה ופתרון מופחת.
רעש תרמי </ P>
הדמיה ברזולוציה גבוהה דורשת רגישות רבה לשינויים בכוח ומרחקים (כוחות התת-PN בדרך כלל ותת-אנגסטרום מרחיק 78). לקבלת cantilevers רך, תנועה מכנית-התרמו של שלוחה עקב תנועה בראונית הפנימי שלה (רטט תרמי) יכול להיות בעיה. בשנת בקירוב הראשון, עם שלוחה של k הקשיחה, לא ניתן למדוד תכונות קטנות יותר 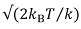 , משרעת של רעש תרמי, שבו B k הוא קבוע בולצמן ו- T היא הטמפרטורה. למעשה, באמצעות שלוחה עם תדרי תהודה גבוהים מתפשט הרעש מעל טווח תדר גדול יותר, ומקטין את רמת הרעש הכוללת של רוחב פס המדידה 79.
, משרעת של רעש תרמי, שבו B k הוא קבוע בולצמן ו- T היא הטמפרטורה. למעשה, באמצעות שלוחה עם תדרי תהודה גבוהים מתפשט הרעש מעל טווח תדר גדול יותר, ומקטין את רמת הרעש הכוללת של רוחב פס המדידה 79.
הדמית eigenmode גבוהה
זה יכול לפעמים להיות שימושי לפעול השלוחה ב eigenmode השני שלהבשל קשיחות הגידול היעילה (ראה דיון של זיהום). למעשה, זה נעשה פשוט על ידי נהיגת השלוחה ב eigenmode השני שלה (שיא התהודה השני בתדירות גבוהה יותר, ראה איור 1 א). כאשר כוונון השלוחה, פשוט לבחור את eigenmode השני במקום התהודה הראשית המשך לשלב 5.4. ראוי לציין, כי InvOLS יהיה שונה כאשר השלוחה היא מונעת על eigenmode השני; בדרך כלל ~ 1/3 של InvOLS נמדד צעד 5.2 עבור שלוחה מלבני.
המגבלה העיקרית של הטכניקה היא שהיא דורשת נוף solvation יציב על פני השטח של המדגם. המדגם צריך להיות חזק מספיק כדי לאפשר perturbing נוזל interfacial ללא גרימת עיוות משמעותית של המדגם עצמו. זה יכול להיות מאתגר על ביומולקולות כה גדולה מאוד רכה דגימות יציבות. בנוסף, קטן-משרעת AFM כמתואר כאן אינם יכולים להשיג מידע מכני על properties של מדגם, כמו קצה השלוחה מבלה את רוב הזמן שלה בנוזל interfacial. לשם כך, זה עשוי להיות מועיל להשתמש גישות אחרות כגון כמוני nanomechanical מיפוי 80 או לעשות שימוש הרמוניות גבוהות יותר של תנועה שלוחה. מפוחיות גבוהות משופרות בדרך כלל כאשר הדמיה בנוזל (עם גורמי איכות נמוכים) 29,81 – 83 והוא יכול לספק טופוגרפיה וקשיחה זמני של דגימות 25,81 – 84 אבל הם משפיעים לרעה בדרך כלל ברזולוציה גבוהה. מגבלות אחרות טבועות בכל שיטות מיקרוסקופיה בדיקת הסריקה עדיין תקפות כאן, בפרט העובדה שהמידע בהכרח לכלול התוצאות על קצה המדידה. השימוש אמפליטודות קטן הוא גם לא אידיאלי עבור דגימות עם וריאציות גובה גדולות; לולאת המשוב בהכרח תגיב לאט יותר כאשר הגירסות גובות גדולות יותר משרעת ההדמיה, ומכאן מסכן את ניזק מדגם טיפ. השימוש of רך שלוחה מפחיתה את הבעיה הזו במידה מסוימת.
היתרון העיקרי של השיטה המוצגת כאן הוא העובדה שהיא מספקת את רזולוציית התמונה הגבוהה ביותר האפשרית עם AFM בנוזל אבל יכולה להיות מיושמת על כל AFM מסחרי, ובלבד רמות הרעש של המכונית נמוכות מספיק. ברזולוציה דומה על מכשירים מסחריים מושגת בדרך כלל במצב מגע, או מדי פעם FM-AFM עם cantilevers הנוקשה. עבודת AM-מצב ועם cantilevers הרך יחסית מאפשרת בחירה רחבה יותר של דגימות, והוא קל יותר מאשר ליישם FM-AFM על רוב המערכות. הגישה מתבססת על ניצול כוחות solvation הקיים בקו התפר שבין כל מוצק לנוזל כדי לשפר את הרזולוציה ולהשיג מידע כימי המקומי. זה יכול באופן עקרוני לשמש בתנאי סביבה, להסתמך רק על שכבות מים (בדרך כלל כמה ננומטרים) בנייה על מרבית המשטחים בשל הלחות של האוויר. העקרונות שבבסיסאסטרטגיה ברזולוציה גבוהה להישאר ללא שינוי אבל רוב הטיפ הוא באוויר, עם גשר נימים רק בין איפקס הקצה ועל המדגם 85. ברזולוציה גבוהה הודגמה על דגימות נוקשות בתנאים אלה 86,87. תנאי ההדמיה הם אולם שונים מאלה של נוזל שקוע בשל גורם-Q גבוה של התנודה של השלוחה. באופן מעשי, התקשינו להשיג פעולה יציבה לאורך דגימות רכות או לא סדירות, ככל הנראה בשל שינויים זמניים של גשר הנימים וגדילת Q-הגורם קשיחה שלוחה נתונה.
הפרוטוקול המתואר במסמך זה מציע מתודולוגיה להשגת תמונות ברזולוציה ברמה המולקולרית של דגימות נוזלות עם AM-AFMs המסחרי המודרני ביותר. אנו מספקים את הרציונל המדעי מאחורי הבחירה שלנו של פרמטרי הדמיה ולהדגיש את תפקידם של כוחות solvation. כמו כן נדונו בעיות נפוצות לזיהום בפרט. האינטראקציות טיפ-המדגם המסוים can משתנה בהתאם דראמטי על תוכן פתרון ההדמיה, גיאומטרית השלוחה והחומר, והכימיה המדגמת. הבנה מעשית של מהות הכוחות הדומיננטיים הנוכחים במהלך הסריקה לכן זה חיוני כדי להתאים את הפרוטוקול למערכות חדשות להבטיח תוצאות אמינות. כאשר אופטימיזציה, הגישה הניסויית היא רבה-עצמה להשגת in-situ תובנה ברמה המולקולרית מקומיות של דגימות בתמיסה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
מימון מן הנדסה המדעים הפיזיקליים המועצה למחקר (מענקים 1,452,230 ו- EP / M023915 / 1), ביוטכנולוגיה ו ביולוגי מדע המועצה למחקר (להעניק BB / M024830 / 1) ואת המועצה האירופית (FP7 CIG 631,186) מוכרים בהכרת תודה.
Materials
| Multimode IIIA AFM | Brucker | NA | One of the machine used |
| Cypher ES AFM | Asylum Resarch | NA | One of the machine used |
| AFM cantilever/tip | Nanoworld | Arrow UHF-AUD | best for high frequency |
| AFM cantilever/tip | Olympus | RC800-PSA | versatile and cheap |
| ultrapure water | Milipore | NA | lab filtering systems can induce contamination |
| Dimethyl sulfoxide | Sigma-Aaldrich | 200-664-3 | standard chemical, no further purification |
| Monovalent salts | Sigma-Aaldrich | standard chemical, no further purification | |
| Lipids | Avanti polar lipids | lipid bilayers formed using stadard protocols | |
| Crystals | MTI | polished crystals | |
| Scotch tape | 3M | Scotch Magic Tape | Translucent tape works best. Transparent sticks too strongly |
References
- Binnig, G., Quate, C. F. Atomic Force Microscope. Phys. Rev. Lett. 56 (9), 930-933 (1986).
- Rico, F., Su, C., Scheuring, S. Mechanical mapping of single membrane proteins at submolecular resolution. Nano Lett. 11 (9), 3983-3986 (2011).
- Payam, A. F., Ramos, J. R., Garcia, R. Molecular and nanoscale compositional contrast of soft matter in liquid: interplay between elastic and dissipative interactions. ACS Nano. 6 (6), 4663-4670 (2012).
- Grandbois, M. How Strong Is a Covalent Bond. Science. 283 (5408), 1727-1730 (1999).
- Oesterhelt, F. Unfolding Pathways of Individual Bacteriorhodopsins. Science. 288 (5463), 143-146 (2000).
- McLean, R. S., Doyle, M., Sauer, B. B. High-Resolution Imaging of Ionic Domains and Crystal Morphology in Ionomers Using AFM Techniques. Macromolecules. 33 (17), 6541-6550 (2000).
- Scheuring, S., Reiss-Husson, F., Engel, A., Rigaud, J. L., Ranck, J. L. High-resolution AFM topographs of Rubrivivax gelatinosus light-harvesting complex LH2. EMBO J. 20 (12), 3029-3035 (2001).
- Novoselov, K. S., et al. Two-dimensional atomic crystals. Proc. Natl. Acad. Sci. U. S. A. 102 (30), 10451-10453 (2005).
- Freeman, M. R., Choi, B. C. Advances in magnetic microscopy. Science. 294 (5546), 1484-1488 (2001).
- Bockrath, M., et al. Scanned Conductance Microscopy of Carbon Nanotubes and λ-DNA. Nano Lett. 2 (3), 187-190 (2002).
- Oliver, R. A. Advances in AFM for the electrical characterization of semiconductors. Reports Prog. Phys. 71 (7), 076501 (2008).
- Butt, H. -. J., Jaschke, M. Calculation of thermal noise in atomic force microscopy. Nanotechnology. 6 (1), 1-7 (1995).
- Majumdar, A., Carrejo, J. P., Lai, J. Thermal imaging using the atomic force microscope. Appl. Phys. Lett. 62 (20), 2501 (1993).
- Vezenov, D. V., Noy, A., Ashby, P. Chemical force microscopy: probing chemical origin of interfacial forces and adhesion. J. Adhes. Sci. Technol. 19 (3-5), 313-364 (2005).
- Gerber, C., Lang, H. P. How the doors to the nanoworld were opened. Nat. Nanotechnol. 1 (1), 3-5 (2006).
- Bharat, B. . Encyclopedia of Nanotechnology. , (2012).
- Giessibl, F. J. Subatomic Features on the Silicon (111)-(7×7) Surface Observed by Atomic Force Microscopy. Science. 289 (5478), 422-425 (2000).
- Haugstad, G. . Atomic Force Microscopy. , (2012).
- Moreno-Herrero, F., Colchero, J., Gòmez-Herrero, J., Barò, A. M. Atomic force microscopy contact, tapping, and jumping modes for imaging biological samples in liquids. Phys. Rev. E. Stat. Nonlin. Soft Matter Phys. 69 (3), 031915 (2004).
- Gan, Y. Atomic and subnanometer resolution in ambient conditions by atomic force microscopy. Surf. Sci. Rep. 64 (3), 99-121 (2009).
- Kodera, N., Yamamoto, D., Ishikawa, R., Ando, T. Video imaging of walking myosin V by high-speed atomic force microscopy. Nature. 468 (7320), 72-76 (2010).
- Picco, L. M., et al. High-speed AFM of human chromosomes in liquid. Nanotechnology. 19 (38), 384018 (2008).
- Fantner, G. E., et al. Components for high speed atomic force microscopy. Ultramicroscopy. 106 (8-9), 881-887 (2006).
- Garcia, R., Herruzo, E. T. The emergence of multifrequency force microscopy. Nat. Nanotechnol. 7 (4), 217-226 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat. Nanotechnol. 6 (12), 809-814 (2011).
- Fukuma, T., Higgins, M. J., Jarvis, S. P. Direct imaging of individual intrinsic hydration layers on lipid bilayers at Angstrom resolution. Biophys. J. 92 (10), 3603-3609 (2007).
- Higgins, M. J., et al. Structured water layers adjacent to biological membranes. Biophys. J. 91 (7), 2532-2542 (2006).
- Kobayashi, K., Oyabu, N., et al. Visualization of hydration layers on muscovite mica in aqueous solution by frequency-modulation atomic force microscopy. J. Chem. Phys. 138 (18), 184704 (2013).
- Voïtchovsky, K. Anharmonicity, solvation forces, and resolution in atomic force microscopy at the solid-liquid interface. Phys. Rev. E. Stat. Nonlin. Soft Matter Phys. 88 (2), 022407 (2013).
- Müller, D. J., Dufrêne, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat. Nanotechnol. 3 (5), 261-269 (2008).
- Alessandrini, A., Seeger, H. M., Di Cerbo, A., Caramaschi, T., Facci, P. What do we really measure in AFM punch-through experiments on supported lipid bilayers. Soft Matter. 7 (15), 7054 (2011).
- Schmidt, S., Biegel, E., Müller, V. The ins and outs of Na(+) bioenergetics in Acetobacterium woodii. Biochim. Biophys. Acta. 1787 (6), 691-696 (2009).
- Bippes, C. A., Muller, D. J. High-resolution atomic force microscopy and spectroscopy of native membrane proteins. Reports Prog. Phys. 74 (8), 086601 (2011).
- Chada, N., et al. Glass is a Viable Substrate for Precision Force Microscopy of Membrane Proteins. Sci. Rep. 5, 12550 (2015).
- Möller, C., Allen, M., Elings, V., Engel, A., Müller, D. J. Tapping-mode atomic force microscopy produces faithful high-resolution images of protein surfaces. Biophys. J. 77 (2), 1150-1158 (1999).
- Antoranz Contera, S., Voïtchovsky, K., Ryan, J. F. Controlled ionic condensation at the surface of a native extremophile membrane. Nanoscale. 2 (2), 222-229 (2010).
- Kumaki, J. Observation of polymer chain structures in two-dimensional films by atomic force microscopy. Polym. J. 48 (1), 3-14 (2015).
- Voïtchovsky, K., et al. In Situ Mapping of the Molecular Arrangement of Amphiphilic Dye Molecules at the TiO Surface of Dye-Sensitized Solar Cells. ACS Appl. Mater. Interfaces. 7 (20), 10834-10842 (2015).
- Segura, J. J., et al. Adsorbed and near surface structure of ionic liquids at a solid interface. Phys. Chem. Chem. Phys. 15 (9), 3320-3328 (2013).
- Hayes, R., Warr, G. G., Atkin, R. Structure and Nanostructure in Ionic Liquids. Chem. Rev. 115 (13), 150601082109009 (2015).
- Fukuma, T., Kobayashi, K., Matsushige, K., Yamada, H. True atomic resolution in liquid by frequency-modulation atomic force microscopy. Appl. Phys. Lett. 87 (3), 034101 (2005).
- Voïtchovsky, K., Kuna, J. J., Contera, S. A., Tosatti, E., Stellacci, F. Direct mapping of the solid-liquid adhesion energy with subnanometre resolution. Nat. Nanotechnol. 5 (6), 401-405 (2010).
- Siretanu, I., et al. Direct observation of ionic structure at solid-liquid interfaces: a deep look into the Stern Layer. Sci. Rep. 4, 4956 (2014).
- Ricci, M., Spijker, P., Voïtchovsky, K. Water-induced correlation between single ions imaged at the solid-liquid interface. Nat. Commun. 5, 4400 (2014).
- Kiracofe, D., Raman, A. On eigenmodes, stiffness, and sensitivity of atomic force microscope cantilevers in air versus liquids. J. Appl. Phys. 107 (3), 033506 (2010).
- San Paulo, A., Garcìa, R. High-resolution imaging of antibodies by tapping-mode atomic force microscopy: attractive and repulsive tip-sample interaction regimes. Biophys. J. 78 (3), 1599-1605 (2000).
- Garcìa, R., San Paulo, A. Attractive and repulsive tip-sample interaction regimes in tapping-mode atomic force microscopy. Phys. Rev. B. 60 (7), 4961-4967 (1999).
- Butt, H. J. Electrostatic interaction in atomic force microscopy. Biophys. J. 60 (4), 777-785 (1991).
- Israelachvili, J. N. Intermolecular and Surface Forces. Intermol. Surf. Forces. , (2011).
- Yu, C. -. J., et al. Order in molecular liquids near solid-liquid interfaces. Appl. Surf. Sci. 182 (3-4), 231-235 (2001).
- Ortiz-Young, D., Chiu, H. -. C., Kim, S., Voïtchovsky, K., Riedo, E. The interplay between apparent viscosity and wettability in nanoconfined water. Nat. Commun. 4, 2482 (2013).
- Patil, S. V., Hoffmann, P. M. Small-Amplitude Atomic Force Microscopy. Adv. Eng. Mater. 7 (8), 707-712 (2005).
- Fukuma, T., Jarvis, S. P. Development of liquid-environment frequency modulation atomic force microscope with low noise deflection sensor for cantilevers of various dimensions. Rev. Sci. Instrum. 77 (4), 043701 (2006).
- Burkhardt, M., et al. Concept of a molecular charge storage dielectric layer for organic thin-film memory transistors. Adv. Mater. 22 (23), 2525-2528 (2010).
- Garcìa, R. . Amplitude Modulation Atomic Force Microscopy. , (2010).
- Uchihashi, T., et al. Quantitative force measurements in liquid using frequency modulation atomic force microscopy. Appl. Phys. Lett. 85 (16), 3575 (2004).
- Yamada, H., et al. Molecular Resolution Imaging of Protein Molecules in Liquid Using Frequency Modulation Atomic Force Microscopy. Appl. Phys. Express. 2 (9), 095007 (2009).
- Stark, M., et al. From Images to Interactions: High-Resolution Phase Imaging in Tapping-Mode Atomic Force Microscopy. Biophys. J. 80 (6), 3009-3018 (2001).
- Lo, Y. -. S., et al. Organic and Inorganic Contamination on Commercial AFM Cantilevers. Langmuir. 15 (19), 6522-6526 (1999).
- Akrami, S. M. R., Nakayachi, H., Watanabe-Nakayama, T., Asakawa, H., Fukuma, T. Significant improvements in stability and reproducibility of atomic-scale atomic force microscopy in liquid. Nanotechnology. 25 (45), 455701 (2014).
- Meyer, G., Amer, N. M. Novel optical approach to atomic force microscopy. Appl. Phys. Lett. 53 (12), 1045 (1988).
- Alexander, S., et al. An atomic-resolution atomic-force microscope implemented using an optical lever. J. Appl. Phys. 65 (1), 164 (1989).
- Green, C. P., et al. Normal and torsional spring constants of atomic force microscope cantilevers. Rev. Sci. Instrum. 75 (6), 1988 (2004).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Rev. Sci. Instrum. 64 (2), 403 (1993).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev. Sci. Instrum. 64 (7), 1868 (1993).
- Sader, J. E., Larson, I., Mulvaney, P., White, L. R. Method for the calibration of atomic force microscope cantilevers. Rev. Sci. Instrum. 66 (7), 3789 (1995).
- Ricci, M., Quinlan, R., Voitchovsky, K. No Title. Soft Matter. , (2016).
- Ricci, M., Spijker, P., Stellacci, F., Molinari, J. -. F., Voïtchovsky, K. Direct visualization of single ions in the Stern layer of calcite. Langmuir. 29 (7), 2207-2216 (2013).
- Kilpatrick, J. I., Loh, S. -. H., Jarvis, S. P. Directly probing the effects of ions on hydration forces at interfaces. J. Am. Chem. Soc. 135 (7), 2628-2634 (2013).
- Fukuma, T., et al. Mechanism of atomic force microscopy imaging of three-dimensional hydration structures at a solid-liquid interface. Phys. Rev. B. 92 (15), 155412 (2015).
- Maula, T., Westerlund, B., Slotte, J. P. Differential ability of cholesterol-enriched and gel phase domains to resist benzyl alcohol-induced fluidization in multilamellar lipid vesicles. Biochim. Biophys. Acta. 1788 (11), 2454-2461 (2009).
- Schroeder, F., Morrison, W. J., Gorka, C., Wood, W. G. Transbilayer effects of ethanol on fluidity of brain membrane leaflets. Biochim. Biophys. Acta – Biomembr. 946 (1), 85-94 (1988).
- Tierney, K. J., Block, D. E., Longo, M. L. Elasticity and phase behavior of DPPC membrane modulated by cholesterol, ergosterol, and ethanol. Biophys. J. 89 (4), 2481-2493 (2005).
- Basak, S., Raman, A. Dynamics of tapping mode atomic force microscopy in liquids: Theory and experiments. Appl. Phys. Lett. 91 (6), 064107 (2007).
- Eslami, B., Solares, S. D. Experimental approach for selecting the excitation frequency for maximum compositional contrast in viscous environments for piezo-driven bimodal atomic force microscopy. J. Appl. Phys. 119 (8), 084901 (2016).
- Collins, K. D., Neilson, G. W., Enderby, J. E. Ions in water: characterizing the forces that control chemical processes and biological structure. Biophys. Chem. 128 (2-3), 95-104 (2007).
- Lee, S. S., Fenter, P., Park, C., Sturchio, N. C., Nagy, K. L. Hydrated cation speciation at the muscovite (001)-water interface. Langmuir. 26 (22), 16647-16651 (2010).
- Liang, S., et al. Thermal noise reduction of mechanical oscillators by actively controlled external dissipative forces. Ultramicroscopy. 84 (1-2), 119-125 (2000).
- Hodges, A. R., Bussmann, K. M., Hoh, J. H. Improved atomic force microscope cantilever performance by ion beam modification. Rev. Sci. Instrum. 72 (10), 3880 (2001).
- Adamcik, J., Berquand, A., Mezzenga, R. Single-step direct measurement of amyloid fibrils stiffness by peak force quantitative nanomechanical atomic force microscopy. Appl. Phys. Lett. 98 (19), 193701 (2011).
- Preiner, J., Tang, J., Pastushenko, V., Hinterdorfer, P. Higher harmonic atomic force microscopy: imaging of biological membranes in liquid. Phys. Rev. Lett. 99 (4), 046102 (2007).
- Dulebo, A., et al. Second harmonic atomic force microscopy imaging of live and fixed mammalian cells. Ultramicroscopy. 109 (8), 1056-1060 (2009).
- Xu, X., Melcher, J., Basak, S., Reifenberger, R., Raman, A. Compositional contrast of biological materials in liquids using the momentary excitation of higher eigenmodes in dynamic atomic force microscopy. Phys. Rev. Lett. 102 (6), 060801 (2009).
- Turner, R. D., Kirkham, J., Devine, D., Thomson, N. H. Second harmonic atomic force microscopy of living Staphylococcus aureus bacteria. Appl. Phys. Lett. 94 (4), 043901 (2009).
- Barcons, V., Verdaguer, A., Font, J., Chiesa, M., Santos, S. Nanoscale Capillary Interactions in Dynamic Atomic Force Microscopy. J. Phys. Chem. C. 116 (14), 7757-7766 (2012).
- Wastl, D. S., Weymouth, A. J., Giessibl, F. J. Atomically resolved graphitic surfaces in air by atomic force microscopy. ACS Nano. 8 (5), 5233-5239 (2014).
- Wastl, D. S., Judmann, M., Weymouth, A. J., Giessibl, F. J. Atomic Resolution of Calcium and Oxygen Sublattices of Calcite in Ambient Conditions by Atomic Force Microscopy Using qPlus Sensors with Sapphire Tips. ACS Nano. 9 (4), 3858-3865 (2015).

