液体中の振幅変調原子間力顕微鏡でのサブナノメートル分解能イメージング
Summary
我々は、液体中の振幅変調(タッピングモード)原子間力顕微鏡を用いて、サブナノメートルの解像度の画像を達成するための方法を提示します。この方法は、市販の原子間力顕微鏡で実証されています。私たちは、パラメータの私達の選択の背後にある理論的根拠を説明し、解像度の最適化のための戦略を示唆しています。
Abstract
Atomic force microscopy (AFM) has become a well-established technique for nanoscale imaging of samples in air and in liquid. Recent studies have shown that when operated in amplitude-modulation (tapping) mode, atomic or molecular-level resolution images can be achieved over a wide range of soft and hard samples in liquid. In these situations, small oscillation amplitudes (SAM-AFM) enhance the resolution by exploiting the solvated liquid at the surface of the sample. Although the technique has been successfully applied across fields as diverse as materials science, biology and biophysics and surface chemistry, obtaining high-resolution images in liquid can still remain challenging for novice users. This is partly due to the large number of variables to control and optimize such as the choice of cantilever, the sample preparation, and the correct manipulation of the imaging parameters. Here, we present a protocol for achieving high-resolution images of hard and soft samples in fluid using SAM-AFM on a commercial instrument. Our goal is to provide a step-by-step practical guide to achieving high-resolution images, including the cleaning and preparation of the apparatus and the sample, the choice of cantilever and optimization of the imaging parameters. For each step, we explain the scientific rationale behind our choices to facilitate the adaptation of the methodology to every user’s specific system.
Introduction
その発明以来、30年前、原子間力顕微鏡(AFM)1は、特に巨視的な表面領域にわたって平均ところ、ナノスケールでサンプルを調査するための選択肢の技術としての地位を確立していることは不可能であり、地域の情報が必要です。典型的なAFM測定では、フレキシブルカンチレバーの偏向は分子の少数カンチレバーの端部に取り付けられultrasharp先端との間の相互作用力を定量化するために使用されます。考え相互作用のタイプ及び時間スケールに応じて、情報の広い範囲は、ソフト生体膜2,3の粘弾性特性を含む、誘導することができる、単一の化学物質の強さまたは分子結合4,5の原子論的な詳細表面6から8、磁気9、容量10、サンプルの11、熱12,13および化学14導電特性を<sup> 15。それは探針と試料との間の特定の力に依存しないため、AFMの成功の一部は、材料16の広い範囲に及び、真空17、ガス11,18または液体19,20などの複数の環境で動作する能力であります。
しかし、実際には、周囲以外の条件でAFMを動作させるのは、困難で、多くの公開された結果は、静止空気中で得られることができます。追加された困難は、大きな摩擦力を回避することにより、チップと試料の両方を保持するために動的モード(振動先端)でAFMを動作させるために通常必要であるという事実に由来します。より困難なものの、動的な動作は、原則的に分析し、空間分解能の損失なしに、サンプルに関する詳細な情報を提供することができます。多周波測定を、23 – 10年間で、液体の動的AFMのフィールドは、ビデオレートAFM 21の出現から、重要な進展が見られました<sup> 24,25およびインタフェース26で水和構造のサブナノメートルイメージング– 31。 36、ポリマー研究37、電気化学38 – – 40固液界面41特徴付け– 44を液中に浸漬しながら、AFM動作について日常的に生物学および生物物理学32で使用されています。振動カンチレバーの周りの液体の存在はかなりそのダイナミクス45と同様に、先端と試料29,42の間の相互作用を変化させます。適切に使用されるとき、液体は、周囲条件46で達成最高の解像度と比較して、大きさのほぼオーダーの典型的な改善と、撮像解像度26,29を強化するために利用することができます。
AFMでは、特定の測定のために達成可能な最高の空間分解能は、AFM自体の品質とtの両方の性質に依存します彼は相互作用が20,47,48をプローブしました。現時点では、ほとんどのハイエンドは、熱限界12のそれに近い市販のAFM存在するノイズレベルはそれほど解像度のための決定要因は、通常、チップと試料の相互作用です。これは、効果的に解像度を決定し、この相互作用の空間勾配である:短距離、急速に減衰する相互作用に基づく測定は長距離相互作用が遊んでいるときよりも高い解像度の結果を生成します。彼らは離れて、試料49の表面から移動するときに液体のわずか数分子径(一般的に<1 nm)を超える消滅する傾向があるため、液体では、溶媒和力は、撮像解像度を向上させることができます。これらの力は、液体分子と試料の表面との間の相互作用に由来します。表面に強い親和性を有する液体は、より規則およびサンプル29,42,50との界面におけるバルク液体未満の携帯になる傾向があります。結果として、それはナノスケール-the溶媒和の風景での界面の液体の特性の局所的な変化に非常に敏感な測定をレンダリング、バルク液体42よりも界面の液晶分子を変位させる振動AFMチップのために多くのエネルギーがかかります。
溶媒和力を利用するために、いくつかの実用的な側面を考慮する必要があります。まず、先端の振動振幅は<一般的に、1 nmの溶媒和力の範囲に匹敵する必要があります。第二に、使用される液体は、試料の表面で明確に定義された溶媒和の景観を形成しなければなりません。肉眼、これは考えサンプルのための「濡れ」の液体を必要とすることと同じです。例えば、水に、疎水性グラファイト42,51よりも親水性の雲母の分子レベルの分解能を達成することが容易です。最後に、先端部を支持するカンチレバーのバネ定数を適切52,53選択する必要があります。これらの詐欺で作業する場合ditions、AFMは、界面の分子レベルの画像を提供しないだけでなく、試料表面54に関する化学的情報を得るために使用することができ、ローカルサンプル液親和性に関する情報を導出します。
液体中のAFMのための操作の最も一般的なダイナミックモードは、振幅変調(AM、また「タッピングモード ')AFMと周波数変調(FM)AFMです。その振動振幅が連続チップ-試料間距離を再調整するフィードバックループによって一定に保たれつつ、第1ケース55には、チップサンプルをラスタ・スキャンします。試料のトポグラフィ画像は、フィードバックループによって適用される補正から得られます。 FM-AFM 28,41,56には、先端が試料を走査しながら、一定に保持されるカンチレバー/チップの発振周波数です。両方の技術は、液体36,57で同等の地形分解能を提供します。チップと試料の相互作用の定量化は、よりstraiになる傾向がありますghtforwardと正確なFM-AFMではなく、AM-AFMは、実装が簡単より堅牢で、より柔らかいカンチレバー、容易に変形やデリケートなサンプルを研究するために有用なものを扱うことができます。重要なことは、AM-AFMの一部は歴史的な理由だけでなく、原因、制御することが技術的に容易であるという事実のために、AFMユーザーの間でより広範囲です。
振幅AM-AFMイメージングの間のフィードバックループによって一定に保たれているが、先端振動と駆動振動との間の位相遅れを自由に変更することが許されます。位相遅れはサンプル58との界面における先端の振動中に消費するエネルギーに関連している、チップと試料の相互作用についての有用な情報を提供することができます。したがって、位相イメージングは地形イメージングに同時に取得することができ、多くの場合、試料表面の不均一性を強調で相補的です。位相イメージングは、ジ含む、相互作用の様々なマッピングのために利用されています付着エネルギー42、粘弾性特性58とインターフェース44の水和風景の矩形マッピング。
具体的には、液体中に高解像度の画像を得ることにより制御する多数のパラメータ、およびすべての状況で動作する単純な、系統的プロトコルが存在しないため、非自明なままです。画質は、典型的には、他の55のうち、カンチレバー形状および弾性、先端化学、振動振幅、およびサンプルの剛性に依存します。 AFM測定は、定義により、また、システムの摂動です。その結果、適切な配慮なしにイメージング変数や環境条件を変更すると、再現性の困難および/または不適当な観察と誤った結果につながることができます。
ここでは、AMPLで動作市販の装置を用いて、溶液中でのハードおよびソフトのサンプルの高解像度の画像を達成するための我々のプロトコルを提示しますitude変調。私たちの目標は、それぞれの場合にイメージングプロセスの基礎となる物理的原理からの私達の選択の根拠を説明する、異なるサンプル以上の解像度に影響を与える可能性が高い主なパラメータを最適化するための実用的な手順を提供することです。我々詳細は、基板洗浄及び準備から、カンチレバー、撮像パラメータの調整と共通の問題のトラブルシューティングの選択にステップ・バイ・ステップのアプローチ、。高解像度のための私達の選択や手続きの背後にある科学的根拠を説明することの方法論を適応させる際に合理的な選択をすることに役立ち、およびイメージング・小説・システムのための出発点となるべき。
このテキストを通して、私たちは、AFMの振幅変調動作モードを参照するためにAMを使用しています。我々は、 設定値のいずれかと、カンチレバーの偏向(接触モード)または振動振幅(AMモード)の間、フィードバックパラメータを一定に維持指します。 AMモードでは、カンチレバーは、外部から駆動されます。いずれかの音響振動によってまたはパルスレーザでは、カンチレバーの基部に焦点を当てました。 駆動振幅は、外部振動信号の強度です。カンチレバーの所定の振動振幅を達成するのに必要な駆動振幅の絶対値は、このような駆動方法(音響、磁気または光熱)、カンチレバーの固定及びパラメータ(剛性、幾何学)およびレーザアラインメントのような多くのパラメータに依存します。駆動振幅の正確な値は、したがって、関連しないが、カンチレバーの適切な(および定量化)の振動振幅を提供するようにそれを各実験に調整されます。駆動カンチレバーは遠く離れたサンプルからであり、その振動のない減衰がチップと試料の相互作用を介して発生していない場合には、その振動振幅は自由振動の振幅と呼ばれています。振動先端が試料表面に近づくと、その振幅が減少し始めます。フィードバックが有効になっている場合は、z軸ピエゾはconstでますantly選択した設定点の振幅をキールするように、その拡張子を再調整定数。目標値は、通常、無料の振幅よりも常に小さいです。自由振幅の上に設定点比 、セットポイントの振幅の比(撮像振幅)を参照するのが一般的です。目標比より小さい、厳しい撮影条件です。
Protocol
Representative Results
Discussion
イメージング液とカンチレバー剛性が適切に選択されたと仮定すると、成功した高解像度を達成するための最も重要なステップは、撮像振幅の調整であり、システムの全体的な清浄度を調べました。
界面液体領域(典型的には2nm未満)の厚さに匹敵する振幅は、界面の溶媒42の特性で主に変化をプローブします。振動振幅が大きすぎる場合には、振動チップは、カンチレバーの運動の安定性を排除し、そして必然的に解像度の低下をもたらす関係なく、撮影条件29のサンプルを打つ長距離、非線形力場52を横断します。別に解像度の損失から、高調波は、先端運動に表示されるように開始し、システムが55をモデル化するために、より複雑になります。あるいは、撮像振幅が小さすぎるOである場合インタフェースのNLY一部(界面の液体、典型的には、特定の層)をプローブして、安定した画像形成のみ堅いカンチレバーを用いて達成することができるリスクが良好な信号対雑音比のために(>水53 10 N / m)を、大規模な高さの変動の上に柔らかい試料に損傷を与えます。硬いカンチレバーの必要性は小さい振幅で作業する場合、測定された信号は、チップと試料の間の長距離相互作用が依然として存在しているが、大部分は一定であり、影響しないことが、より重要になることができ、熱雑音を克服することです得られた画像中の高解像度のコントラスト。
それは、高分解能AFMになると、撮像環境の清浄度は最も重要です。システム内の望ましくない化合物は、イメージングおよび力分光法の両方を妨害することができます。撮影する場合(ⅰ)汚染物質(直接見る:実験に影響を与える傾向がある汚染の2つの主なカテゴリがあります。 <stroNG>図4B、4C)と高解像度の(ii)の一般的な原因不明の欠如。ケース(i)は唯一のそのようなチップと試料の相互作用を妨害し、吸着分子集合体が明らかに原子レベルで平坦な雲母表面( 図4A)に対して対比される水マイカ界面でのような高度に理想化されたシステムで発生する傾向があります。チップとサンプルを変更する前に、それが効果的に繰り返しサンプルに対してハード先端を押すと、大きな偏向に分光曲線を取得する価値があります。これは通常、新しいチップに損傷を与えるだろうが、時折汚い先端を清掃またはイメージングに適した安定した水和サイトを誘導することができます。このヒントは、しかし、必然的に平滑化され、従って、イメージングが改善される場合でも、フラットサンプルのためにのみ適しています。堅いサンプルを超える疑いがある汚染の場合には、上記のやや破壊的な手順を実行する前に、カンチレバーの第二の固有モードで画像に試す価値はあるかもしれ。これは、単にSWが必要です第二の固有モードへの駆動周波数をかゆみと振幅/設定値を(以下のトラブルシューティングの説明を参照)再調整。第二の固有モードで作動し、いかなる弱く吸着した汚染物質が撮影しながら先端によって押しのけすることができるかなりカンチレバー増加の有効剛性。この戦略は、きれいなサンプルとチップの必要性を置き換えるが、チップ/サンプルが明らかに理想的ではないときに良好な画像を取得するために、いくつかのさらなる手段を提供していますされません。
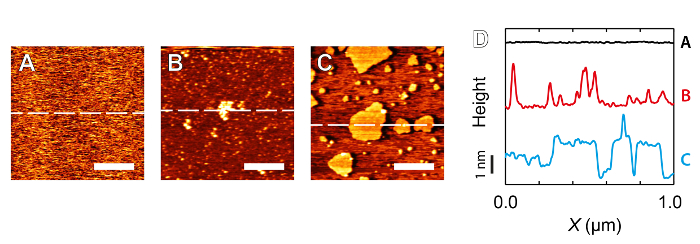
図4:高分解能イメージングを阻害白雲母を撮影するときに観察汚染の例。 :マイカは5 mMのRbClをで撮像された-何の汚染粒子が表示されていません。 B:汚染は名目上、超純水を撮像しながら、全体で数十nmのオーダーの凝集体の形をとります。 C:contamiによって形成された自己集合構造自然の中でおそらく両親媒性NAntの粒子。イメージングは再び名目上は、超純水で行いました。 D:マイカの原子レベルで平坦な表面からの偏差を示すA、BおよびCの破線に対応する垂直方向オフセットのセクション。 A、B及びC中のスケールバーは300nmで対応します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ケース(ii)は、より一般的なサブナノメートルの機能は、単に関係なく、撮影条件を、解決することができないイライラ事実によって主に特徴づけられます。この種の状況の署名は、いくつかの矛盾を示す傾向にある力分光測定では通常表示されます。これらは、かなり一般的なS字状の形状42から外れる距離曲線対再現性に乏しい曲線と振幅を含むことができます。イオン性または他の汚染物質は、ディスある場合流体全体に均質編、彼らは地形イメージングに表示されない場合がありますが、通常のチップと試料の相互作用29を維持し、高解像度の70を得るために重要であるサンプル69の水和構造を破壊する可能性があります。また、特にソフト、生物学的実験では、試料上の汚染物質の直接的な影響があってもよいです。不可能なサブナノメートルレベルの解像度をレンダリングする、73 –例えば、ウェル(洗浄手順から)のアルコールの存在がゲル相の脂質二重層71を流動化することができることが知られています。高解像度が可能でない場合、注意は、第1の撮像溶液と接触する任意の装置に特に焦点を当て、洗浄工程中に注意すべきです。完全に硬化していない場合、このようなエポキシ樹脂としても表向きは安定な化合物は、ある程度の流体に溶媒和することができます。
AM-AFMによる高分解能イメージングが要求している、忍耐を必要とし、可能な限り最高の撮影条件に到達する前に、多くの場合、いくつかの試験。小さな実験的な問題は、簡単に高解像度とトラブルシューティングスキルが不可欠である防ぐために十分に重要になることができます。以下、私たちは私たちが提案された解決策で発生する最も一般的な問題のいくつかをリストアップ。
カンチレバーのチューニング
ほとんどの市販のAFMカンチレバーを駆動するための音響励起を使用します。ステップ5.4に記載されているような場合には、その共振周波数付近で、カンチレバーのチューニング多くの場合、空気中の動作のために十分な性能を提供します。液体環境では、液体は、カンチレバーチップホルダーとしてAFMの異なる機械部品間のいくつかの結合を誘導する傾向があります。これは、多くの場合、一般に「ピークの森」として記載されている多くの鋭いピークと谷を示すカンチレバーの周波数スペクトルによって示され、カンチレバーの見かけ上の共振に影響を与えることができます。その結果、カレを見つけることがしばしば困難ですCTの駆動周波数。これらのピークは、ガス環境内に存在するが、によりカンチレバーの品質係数の高い値に、共振の振幅は、74,75かなり大きいです。液体では、カンチレバーを駆動するために、適切なピークを選択することは容易ではないとすることができ、試行錯誤を必要とすることができます。実際には、共振周波数の周りの「ピークの森」での振幅の最も急な変動による周波数ピークは通常、必ずしも正確に共鳴上、多くの場合、高分解能イメージングを取得するのに十分な駆動周波数を提供しているにもかかわらず、最善の策です。
画像の歪み
イメージングドリフトは、多くの場合、高解像度を求めている問題で、画像が歪んだ(一般的に引き伸ばさ)に見えるのです。その起源は、スキャナ/ AFMが平衡動作温度に達していないため、またはサンプル液体の一部が急激に蒸発しているので( 例えば 、画像化アルコールのいずれかで、一般的に熱であります )。すべての場合において、ドリフトが熱平衡に無視できるようになります。可能な場合は、サンプルの温度を固定するために有用です。それ以外の場合は、実験を行う前に、数時間のブランクサンプル(低速走査速度で大型スキャン)をスキャンするためにAFMを残す価値があります。蒸発が問題ではない場合は、この手順は最良の第一の面から先端に短い距離( 例えば 、20μm)を撤回するように注意しながら、手順の手順6の後に行われます。時折、ドリフトがあっても大規模な熱化後に残ります。これは通常、カンチレバーまたはそのチップの一部は、撮影しながら、このような薄いフィルムのような柔らかい粘着性の試料上またはチップ/カンチレバー/チップが適切に配置されていない場合に発生する可能性が何かをサンプルをドラッグしていることを示しています。 1カンチレバー/先端よりもホストより多くのチップでは、しばしば使用されていないカンチレバーを壊すのではなく、それらが表面上にドラッグしてみましょうすると便利です。
イオン強度
ntent ">イメージングは、界面液体によって支配されているので、時々水に帯電した表面の高分解能イメージングのためのいくつかの塩を追加すると便利です。塩の役割は2つある。第一に、それはの水和の風景を変更します表面は、多くの場合、コントラストを向上させる吸着、上に結像。第二に、それは(雲母上例えば、)先端と試料との間の画面強い静電相互作用をするのに役立ちます。一般的に、より大きなイオン例えば、カリウム、ルビジウム、セシウムが、それらの特定の水和特性に優れた画像を許可します76、彼らは多くの場合、ユニークな水和状態77で主に吸着するという事実。バートカンチレバー/先端
それは、(上述の症状を参照)カンチレバーが汚染源であることが疑われる場合、それは最初に光学顕微鏡下で検査されるべきです。ゲルボックスに保存されている場合は、カンチレバーが表示されることがゲルポリマーまたはシリコンオイル59の痕跡を拾うことができます、極端な場合には、暗いスポットとして、カンチレバーの背面にある( 図5(a)のように)。カンチレバーの光熱振動は、同様のスポットを誘導することができるが、それらはレーザ駆動によってカンチレバーコーティングの劣化/過熱に起因するものです。汚染は、カンチレバーにランダムに表示される傾向にあります。超純水で、その後、イソプロパノールで洗浄し、(12時間)が長くカンチレバーから望ましくない粒子を除去することができます。
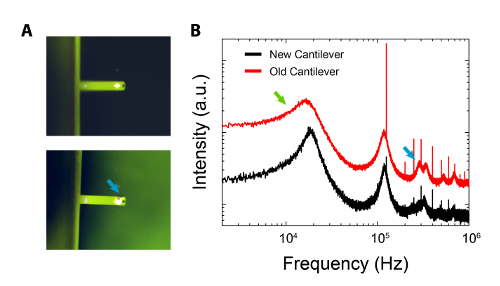
図5:新しいカンチレバーとの比較や長時間のハード面に広く使用され、ゲルボックスに残されている同一1。 :トップ;クリーニングされた新品のカンチレバーの光学像(手順を参照してください)。ボトム;光学像は、ゲルボックスから見える汚染(青い矢印)の外観を実証します。 B:カンチレバーのそれぞれの熱スペクトルの比較。古いカンチレバーの第1の共振ピークの広がり(緑色の矢印)がクリアされると、いくつかの高次モードが強化されている(青い矢印)。スペクトルは垂直オフセットと明瞭にするために対数スケールで提示されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
必要なサブナノメートルの解像度を低解像度に許容される画像にもかかわらず、達成されない場合には、AFMチップは、化学的に、そのストレージ環境中に変更となっている可能性があります。これは、チップ60上の親水性表面基の生成を助ける120秒間紫外線酸化剤にカンチレバーチップの曝露によって治療することができます。ケアは、先端の形状とUV出力に応じて変えることができる必要が正確な時間として、しかし取られるべきである、と過剰露出先端と低解像度の鈍化をもたらす可能性があります。
熱雑音</ P>
高解像度イメージングは、力と距離の変化に大きな感度が必要です(通常、サブ-PN力をサブオングストロームは78を距離)。より柔らかいカンチレバーは、その固有のブラウン運動(熱振動)によるカンチレバーの熱機械的な動きが問題になる可能性があります。第一近似では、剛性kのカンチレバーでは、より小さいフィーチャを測定することは不可能です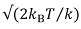 で、k Bはボルツマン定数、Tは温度であり、熱雑音の振幅。具体的には、より高い共振周波数を有するカンチレバーを使用すると、より大きな周波数範囲で騒音を拡散し、測定帯域幅79内の全体のノイズレベルを低下させます。
で、k Bはボルツマン定数、Tは温度であり、熱雑音の振幅。具体的には、より高い共振周波数を有するカンチレバーを使用すると、より大きな周波数範囲で騒音を拡散し、測定帯域幅79内の全体のノイズレベルを低下させます。
高い固有モードイメージング
時々その第二の固有モードでカンチレバーを動作させるのに有用であることができます増加有効剛性による(汚染の説明を参照してください)。実際に、これはその第二の固有モードにカンチレバー駆動することによって簡単に行われる(より高い周波数で第2の共振ピークを、 図1Aを参照)。カンチレバーをチューニングする場合、代わりに単に主共振の第二の固有モードを選択して、5.4に進みます。カンチレバーは、第2の固有モードで駆動されたときにInvOLSは異なるであろうことに注意してください。一般的に長方形のカンチレバーのためのステップ5.2で測定InvOLSの〜1月3日。
技術の主な制限は、試料の表面に安定した溶媒和の風景を必要とすることです。サンプルは、サンプル自体の大幅な変形を引き起こすことなく、界面の液体を乱す可能にするのに十分に堅牢でなければなりません。これは非常に柔らかく、不安定なサンプルなど大きな生体分子に挑戦することができます。さらに、小振幅AFMのpについての機械的な情報を得ることができない、ここで説明したようにサンプルのroperties、カンチレバー先端が界面流体にその時間の大半を費やしているよう。このため、このような定量的ナノメカニカルマッピング80のような他の方法を使用するか、カンチレバー運動の高調波を利用することが有益であり得ます。 83、同時に地形やサンプル25,81の剛性を提供することができます– – (低品質因子で)流体に29,81を撮像する場合、より高いハーモニカは、一般的に強化されている84が、それらは一般的に高解像度に有害です。すべての走査型プローブ顕微鏡技術に固有の他の制限は、特に、ここではまだ結果は必然的に測定チップに関する情報が含まれているという事実有効です。小振幅の使用は、大規模な高さ変動を有するサンプルのための理想的ではありません。高さの変動は、撮像振幅よりも大きい場合、フィードバックループは、必然的に、したがって、試料と先端の損傷の危険、よりゆっくりと反応します。使用OFより柔らかいカンチレバーがある程度この問題を軽減します。
ここに提示される方法の主な利点は、それが液体でAFMで可能な最高の画像解像度を提供することであるが、任意の商業AFM上に実装することができ、機械のノイズレベルが十分に低いことを条件とします。市販の装置に匹敵する解像度は、通常、硬いカンチレバーと接触モードで、または時折FM-AFMで達成されます。 AMモードでは、比較的柔らかいカンチレバーを操作するサンプルのより広い選択を可能にし、ほとんどのシステムでFM-AFMよりも実装が容易です。アプローチは、解像度を向上させ、局所的な化学的情報を得るために、任意の固体と液体の間の界面に存在する溶媒和力を利用するに依存しています。これは、原理的にのみ空気の湿度に起因するほとんどの表面上に構築水層(典型的には数ナノメートルの厚さ)に依存する、周囲条件で使用することができます。基本原理高解像度の戦略は変わらないが、先端のほとんどは、先端の頂点と試料85の間のみの毛細管ブリッジと、空気中です。高解像度は、これらの状態86,87に固い試料で実証されています。撮影条件が原因で、カンチレバーの振動の高いQ値に浸漬液体のものとはしかし異なっています。実際に、我々は、おそらく毛細管ブリッジの時間的変化に、それが困難なソフトや不規則なサンプルにわたって安定した動作を実現発見し、与えられたカンチレバー剛性のためのQ値を増加させました。
本明細書に記載されたプロトコルは、最も近代的な商業AM-のAFMによる液中のサンプルの分子レベルの解像度の画像を達成するための方法論を提供しています。私たちは、撮像パラメータの我々の選択の背後にある科学的根拠を提供し、溶媒和力の役割を強調する。また、一般的な問題を議論し、特に汚染インチ特定のチップと試料の相互作用CAn個の撮像溶液、カンチレバー形状および材料、およびサンプルの化学的性質の内容に応じて劇的に変化します。スキャンの間に存在する支配的な力の性質の実用的な理解は、新しいシステムにこのプロトコルを適応させ、信頼性の高い結果を確保することが不可欠です。最適化されたときは、実験的なアプローチは、in-situで 、溶液中の試料の局所的分子レベルの洞察を得るために強力です。
Disclosures
The authors have nothing to disclose.
Acknowledgements
工学物理科学研究会議からの資金(補助金1452230およびEP / M023915 / 1)、バイオテクノロジー・生物科学研究会議(BB / M024830 / 1を付与)および欧州理事会(FP7 CIG 631186)は深く感謝しています。
Materials
| Multimode IIIA AFM | Brucker | NA | One of the machine used |
| Cypher ES AFM | Asylum Resarch | NA | One of the machine used |
| AFM cantilever/tip | Nanoworld | Arrow UHF-AUD | best for high frequency |
| AFM cantilever/tip | Olympus | RC800-PSA | versatile and cheap |
| ultrapure water | Milipore | NA | lab filtering systems can induce contamination |
| Dimethyl sulfoxide | Sigma-Aaldrich | 200-664-3 | standard chemical, no further purification |
| Monovalent salts | Sigma-Aaldrich | standard chemical, no further purification | |
| Lipids | Avanti polar lipids | lipid bilayers formed using stadard protocols | |
| Crystals | MTI | polished crystals | |
| Scotch tape | 3M | Scotch Magic Tape | Translucent tape works best. Transparent sticks too strongly |
References
- Binnig, G., Quate, C. F. Atomic Force Microscope. Phys. Rev. Lett. 56 (9), 930-933 (1986).
- Rico, F., Su, C., Scheuring, S. Mechanical mapping of single membrane proteins at submolecular resolution. Nano Lett. 11 (9), 3983-3986 (2011).
- Payam, A. F., Ramos, J. R., Garcia, R. Molecular and nanoscale compositional contrast of soft matter in liquid: interplay between elastic and dissipative interactions. ACS Nano. 6 (6), 4663-4670 (2012).
- Grandbois, M. How Strong Is a Covalent Bond. Science. 283 (5408), 1727-1730 (1999).
- Oesterhelt, F. Unfolding Pathways of Individual Bacteriorhodopsins. Science. 288 (5463), 143-146 (2000).
- McLean, R. S., Doyle, M., Sauer, B. B. High-Resolution Imaging of Ionic Domains and Crystal Morphology in Ionomers Using AFM Techniques. Macromolecules. 33 (17), 6541-6550 (2000).
- Scheuring, S., Reiss-Husson, F., Engel, A., Rigaud, J. L., Ranck, J. L. High-resolution AFM topographs of Rubrivivax gelatinosus light-harvesting complex LH2. EMBO J. 20 (12), 3029-3035 (2001).
- Novoselov, K. S., et al. Two-dimensional atomic crystals. Proc. Natl. Acad. Sci. U. S. A. 102 (30), 10451-10453 (2005).
- Freeman, M. R., Choi, B. C. Advances in magnetic microscopy. Science. 294 (5546), 1484-1488 (2001).
- Bockrath, M., et al. Scanned Conductance Microscopy of Carbon Nanotubes and λ-DNA. Nano Lett. 2 (3), 187-190 (2002).
- Oliver, R. A. Advances in AFM for the electrical characterization of semiconductors. Reports Prog. Phys. 71 (7), 076501 (2008).
- Butt, H. -. J., Jaschke, M. Calculation of thermal noise in atomic force microscopy. Nanotechnology. 6 (1), 1-7 (1995).
- Majumdar, A., Carrejo, J. P., Lai, J. Thermal imaging using the atomic force microscope. Appl. Phys. Lett. 62 (20), 2501 (1993).
- Vezenov, D. V., Noy, A., Ashby, P. Chemical force microscopy: probing chemical origin of interfacial forces and adhesion. J. Adhes. Sci. Technol. 19 (3-5), 313-364 (2005).
- Gerber, C., Lang, H. P. How the doors to the nanoworld were opened. Nat. Nanotechnol. 1 (1), 3-5 (2006).
- Bharat, B. . Encyclopedia of Nanotechnology. , (2012).
- Giessibl, F. J. Subatomic Features on the Silicon (111)-(7×7) Surface Observed by Atomic Force Microscopy. Science. 289 (5478), 422-425 (2000).
- Haugstad, G. . Atomic Force Microscopy. , (2012).
- Moreno-Herrero, F., Colchero, J., Gòmez-Herrero, J., Barò, A. M. Atomic force microscopy contact, tapping, and jumping modes for imaging biological samples in liquids. Phys. Rev. E. Stat. Nonlin. Soft Matter Phys. 69 (3), 031915 (2004).
- Gan, Y. Atomic and subnanometer resolution in ambient conditions by atomic force microscopy. Surf. Sci. Rep. 64 (3), 99-121 (2009).
- Kodera, N., Yamamoto, D., Ishikawa, R., Ando, T. Video imaging of walking myosin V by high-speed atomic force microscopy. Nature. 468 (7320), 72-76 (2010).
- Picco, L. M., et al. High-speed AFM of human chromosomes in liquid. Nanotechnology. 19 (38), 384018 (2008).
- Fantner, G. E., et al. Components for high speed atomic force microscopy. Ultramicroscopy. 106 (8-9), 881-887 (2006).
- Garcia, R., Herruzo, E. T. The emergence of multifrequency force microscopy. Nat. Nanotechnol. 7 (4), 217-226 (2012).
- Raman, A., et al. Mapping nanomechanical properties of live cells using multi-harmonic atomic force microscopy. Nat. Nanotechnol. 6 (12), 809-814 (2011).
- Fukuma, T., Higgins, M. J., Jarvis, S. P. Direct imaging of individual intrinsic hydration layers on lipid bilayers at Angstrom resolution. Biophys. J. 92 (10), 3603-3609 (2007).
- Higgins, M. J., et al. Structured water layers adjacent to biological membranes. Biophys. J. 91 (7), 2532-2542 (2006).
- Kobayashi, K., Oyabu, N., et al. Visualization of hydration layers on muscovite mica in aqueous solution by frequency-modulation atomic force microscopy. J. Chem. Phys. 138 (18), 184704 (2013).
- Voïtchovsky, K. Anharmonicity, solvation forces, and resolution in atomic force microscopy at the solid-liquid interface. Phys. Rev. E. Stat. Nonlin. Soft Matter Phys. 88 (2), 022407 (2013).
- Müller, D. J., Dufrêne, Y. F. Atomic force microscopy as a multifunctional molecular toolbox in nanobiotechnology. Nat. Nanotechnol. 3 (5), 261-269 (2008).
- Alessandrini, A., Seeger, H. M., Di Cerbo, A., Caramaschi, T., Facci, P. What do we really measure in AFM punch-through experiments on supported lipid bilayers. Soft Matter. 7 (15), 7054 (2011).
- Schmidt, S., Biegel, E., Müller, V. The ins and outs of Na(+) bioenergetics in Acetobacterium woodii. Biochim. Biophys. Acta. 1787 (6), 691-696 (2009).
- Bippes, C. A., Muller, D. J. High-resolution atomic force microscopy and spectroscopy of native membrane proteins. Reports Prog. Phys. 74 (8), 086601 (2011).
- Chada, N., et al. Glass is a Viable Substrate for Precision Force Microscopy of Membrane Proteins. Sci. Rep. 5, 12550 (2015).
- Möller, C., Allen, M., Elings, V., Engel, A., Müller, D. J. Tapping-mode atomic force microscopy produces faithful high-resolution images of protein surfaces. Biophys. J. 77 (2), 1150-1158 (1999).
- Antoranz Contera, S., Voïtchovsky, K., Ryan, J. F. Controlled ionic condensation at the surface of a native extremophile membrane. Nanoscale. 2 (2), 222-229 (2010).
- Kumaki, J. Observation of polymer chain structures in two-dimensional films by atomic force microscopy. Polym. J. 48 (1), 3-14 (2015).
- Voïtchovsky, K., et al. In Situ Mapping of the Molecular Arrangement of Amphiphilic Dye Molecules at the TiO Surface of Dye-Sensitized Solar Cells. ACS Appl. Mater. Interfaces. 7 (20), 10834-10842 (2015).
- Segura, J. J., et al. Adsorbed and near surface structure of ionic liquids at a solid interface. Phys. Chem. Chem. Phys. 15 (9), 3320-3328 (2013).
- Hayes, R., Warr, G. G., Atkin, R. Structure and Nanostructure in Ionic Liquids. Chem. Rev. 115 (13), 150601082109009 (2015).
- Fukuma, T., Kobayashi, K., Matsushige, K., Yamada, H. True atomic resolution in liquid by frequency-modulation atomic force microscopy. Appl. Phys. Lett. 87 (3), 034101 (2005).
- Voïtchovsky, K., Kuna, J. J., Contera, S. A., Tosatti, E., Stellacci, F. Direct mapping of the solid-liquid adhesion energy with subnanometre resolution. Nat. Nanotechnol. 5 (6), 401-405 (2010).
- Siretanu, I., et al. Direct observation of ionic structure at solid-liquid interfaces: a deep look into the Stern Layer. Sci. Rep. 4, 4956 (2014).
- Ricci, M., Spijker, P., Voïtchovsky, K. Water-induced correlation between single ions imaged at the solid-liquid interface. Nat. Commun. 5, 4400 (2014).
- Kiracofe, D., Raman, A. On eigenmodes, stiffness, and sensitivity of atomic force microscope cantilevers in air versus liquids. J. Appl. Phys. 107 (3), 033506 (2010).
- San Paulo, A., Garcìa, R. High-resolution imaging of antibodies by tapping-mode atomic force microscopy: attractive and repulsive tip-sample interaction regimes. Biophys. J. 78 (3), 1599-1605 (2000).
- Garcìa, R., San Paulo, A. Attractive and repulsive tip-sample interaction regimes in tapping-mode atomic force microscopy. Phys. Rev. B. 60 (7), 4961-4967 (1999).
- Butt, H. J. Electrostatic interaction in atomic force microscopy. Biophys. J. 60 (4), 777-785 (1991).
- Israelachvili, J. N. Intermolecular and Surface Forces. Intermol. Surf. Forces. , (2011).
- Yu, C. -. J., et al. Order in molecular liquids near solid-liquid interfaces. Appl. Surf. Sci. 182 (3-4), 231-235 (2001).
- Ortiz-Young, D., Chiu, H. -. C., Kim, S., Voïtchovsky, K., Riedo, E. The interplay between apparent viscosity and wettability in nanoconfined water. Nat. Commun. 4, 2482 (2013).
- Patil, S. V., Hoffmann, P. M. Small-Amplitude Atomic Force Microscopy. Adv. Eng. Mater. 7 (8), 707-712 (2005).
- Fukuma, T., Jarvis, S. P. Development of liquid-environment frequency modulation atomic force microscope with low noise deflection sensor for cantilevers of various dimensions. Rev. Sci. Instrum. 77 (4), 043701 (2006).
- Burkhardt, M., et al. Concept of a molecular charge storage dielectric layer for organic thin-film memory transistors. Adv. Mater. 22 (23), 2525-2528 (2010).
- Garcìa, R. . Amplitude Modulation Atomic Force Microscopy. , (2010).
- Uchihashi, T., et al. Quantitative force measurements in liquid using frequency modulation atomic force microscopy. Appl. Phys. Lett. 85 (16), 3575 (2004).
- Yamada, H., et al. Molecular Resolution Imaging of Protein Molecules in Liquid Using Frequency Modulation Atomic Force Microscopy. Appl. Phys. Express. 2 (9), 095007 (2009).
- Stark, M., et al. From Images to Interactions: High-Resolution Phase Imaging in Tapping-Mode Atomic Force Microscopy. Biophys. J. 80 (6), 3009-3018 (2001).
- Lo, Y. -. S., et al. Organic and Inorganic Contamination on Commercial AFM Cantilevers. Langmuir. 15 (19), 6522-6526 (1999).
- Akrami, S. M. R., Nakayachi, H., Watanabe-Nakayama, T., Asakawa, H., Fukuma, T. Significant improvements in stability and reproducibility of atomic-scale atomic force microscopy in liquid. Nanotechnology. 25 (45), 455701 (2014).
- Meyer, G., Amer, N. M. Novel optical approach to atomic force microscopy. Appl. Phys. Lett. 53 (12), 1045 (1988).
- Alexander, S., et al. An atomic-resolution atomic-force microscope implemented using an optical lever. J. Appl. Phys. 65 (1), 164 (1989).
- Green, C. P., et al. Normal and torsional spring constants of atomic force microscope cantilevers. Rev. Sci. Instrum. 75 (6), 1988 (2004).
- Cleveland, J. P., Manne, S., Bocek, D., Hansma, P. K. A nondestructive method for determining the spring constant of cantilevers for scanning force microscopy. Rev. Sci. Instrum. 64 (2), 403 (1993).
- Hutter, J. L., Bechhoefer, J. Calibration of atomic-force microscope tips. Rev. Sci. Instrum. 64 (7), 1868 (1993).
- Sader, J. E., Larson, I., Mulvaney, P., White, L. R. Method for the calibration of atomic force microscope cantilevers. Rev. Sci. Instrum. 66 (7), 3789 (1995).
- Ricci, M., Quinlan, R., Voitchovsky, K. No Title. Soft Matter. , (2016).
- Ricci, M., Spijker, P., Stellacci, F., Molinari, J. -. F., Voïtchovsky, K. Direct visualization of single ions in the Stern layer of calcite. Langmuir. 29 (7), 2207-2216 (2013).
- Kilpatrick, J. I., Loh, S. -. H., Jarvis, S. P. Directly probing the effects of ions on hydration forces at interfaces. J. Am. Chem. Soc. 135 (7), 2628-2634 (2013).
- Fukuma, T., et al. Mechanism of atomic force microscopy imaging of three-dimensional hydration structures at a solid-liquid interface. Phys. Rev. B. 92 (15), 155412 (2015).
- Maula, T., Westerlund, B., Slotte, J. P. Differential ability of cholesterol-enriched and gel phase domains to resist benzyl alcohol-induced fluidization in multilamellar lipid vesicles. Biochim. Biophys. Acta. 1788 (11), 2454-2461 (2009).
- Schroeder, F., Morrison, W. J., Gorka, C., Wood, W. G. Transbilayer effects of ethanol on fluidity of brain membrane leaflets. Biochim. Biophys. Acta – Biomembr. 946 (1), 85-94 (1988).
- Tierney, K. J., Block, D. E., Longo, M. L. Elasticity and phase behavior of DPPC membrane modulated by cholesterol, ergosterol, and ethanol. Biophys. J. 89 (4), 2481-2493 (2005).
- Basak, S., Raman, A. Dynamics of tapping mode atomic force microscopy in liquids: Theory and experiments. Appl. Phys. Lett. 91 (6), 064107 (2007).
- Eslami, B., Solares, S. D. Experimental approach for selecting the excitation frequency for maximum compositional contrast in viscous environments for piezo-driven bimodal atomic force microscopy. J. Appl. Phys. 119 (8), 084901 (2016).
- Collins, K. D., Neilson, G. W., Enderby, J. E. Ions in water: characterizing the forces that control chemical processes and biological structure. Biophys. Chem. 128 (2-3), 95-104 (2007).
- Lee, S. S., Fenter, P., Park, C., Sturchio, N. C., Nagy, K. L. Hydrated cation speciation at the muscovite (001)-water interface. Langmuir. 26 (22), 16647-16651 (2010).
- Liang, S., et al. Thermal noise reduction of mechanical oscillators by actively controlled external dissipative forces. Ultramicroscopy. 84 (1-2), 119-125 (2000).
- Hodges, A. R., Bussmann, K. M., Hoh, J. H. Improved atomic force microscope cantilever performance by ion beam modification. Rev. Sci. Instrum. 72 (10), 3880 (2001).
- Adamcik, J., Berquand, A., Mezzenga, R. Single-step direct measurement of amyloid fibrils stiffness by peak force quantitative nanomechanical atomic force microscopy. Appl. Phys. Lett. 98 (19), 193701 (2011).
- Preiner, J., Tang, J., Pastushenko, V., Hinterdorfer, P. Higher harmonic atomic force microscopy: imaging of biological membranes in liquid. Phys. Rev. Lett. 99 (4), 046102 (2007).
- Dulebo, A., et al. Second harmonic atomic force microscopy imaging of live and fixed mammalian cells. Ultramicroscopy. 109 (8), 1056-1060 (2009).
- Xu, X., Melcher, J., Basak, S., Reifenberger, R., Raman, A. Compositional contrast of biological materials in liquids using the momentary excitation of higher eigenmodes in dynamic atomic force microscopy. Phys. Rev. Lett. 102 (6), 060801 (2009).
- Turner, R. D., Kirkham, J., Devine, D., Thomson, N. H. Second harmonic atomic force microscopy of living Staphylococcus aureus bacteria. Appl. Phys. Lett. 94 (4), 043901 (2009).
- Barcons, V., Verdaguer, A., Font, J., Chiesa, M., Santos, S. Nanoscale Capillary Interactions in Dynamic Atomic Force Microscopy. J. Phys. Chem. C. 116 (14), 7757-7766 (2012).
- Wastl, D. S., Weymouth, A. J., Giessibl, F. J. Atomically resolved graphitic surfaces in air by atomic force microscopy. ACS Nano. 8 (5), 5233-5239 (2014).
- Wastl, D. S., Judmann, M., Weymouth, A. J., Giessibl, F. J. Atomic Resolution of Calcium and Oxygen Sublattices of Calcite in Ambient Conditions by Atomic Force Microscopy Using qPlus Sensors with Sapphire Tips. ACS Nano. 9 (4), 3858-3865 (2015).

