Характеристика внутри хрящевых транспортных свойств катиоических пептидных носителей
Summary
Этот протокол определяет равновесное поглощение, глубину проникновения и не равновесную скорость диффузии для катионных носителей пептида в хряще. Характеристика транспортных свойств имеет решающее значение для обеспечения эффективного биологического реагирования. Эти методы могут быть применены для разработки оптимально заряженных носителей наркотиков для ориентации отрицательно заряженных тканей.
Abstract
Несколько отрицательно заряженных тканей в организме, как хрящ, представляют вроде барьера для целевой доставки лекарств из-за их высокой плотности отрицательно заряженных аггреканов и, следовательно, требуют усовершенствованных методов таргетинга для увеличения их терапевтической реакции. Поскольку хрящ имеет высокую отрицательную плотность фиксированного заряда, препараты могут быть изменены с положительно заряженных носителей наркотиков, чтобы воспользоваться электростатических взаимодействий, что позволяет для повышения внутри хряща наркотиков транспорта. Поэтому изучение транспортировки носителей наркотиков имеет решающее значение для прогнозирования эффективности лекарственных средств для индуцирования биологической реакции. Мы показываем дизайн трех экспериментов, которые могут количественно равновесного поглощения, глубины проникновения и не равновесной скорости диффузии катионных пептидных носителей в хряще explants. Эксперименты по поглощению равновесия обеспечивают меру концентрации раствора в хряще по сравнению с окружающей его ванной, что полезно для прогнозирования потенциала носителя препарата в повышении терапевтической концентрации наркотиков в хрящевой ткани. Глубина исследования проникновения с использованием конфокальные микроскопии позволяют визуальное представление 1D растворимой диффузии от поверхностной до глубокой зоны хряща, что важно для оценки того, растворы достигают их матрицы и клеточных целевых участков. Не равновесные исследования скорости диффузии с использованием специально разработанной транспортной камеры позволяет измерять прочность связывающих взаимодействий с матрицей тканей, характеризовав скорость диффузии флуоресцентно помеченных растворов по всей ткани; это полезно для проектирования носителей оптимальной прочности связывания с хрящом. В совокупности результаты трех транспортных экспериментов дают руководство по разработке оптимально заряженных носителей наркотиков, которые используют слабые и обратимые взаимодействия с зарядами для применения лекарственных средств. Эти экспериментальные методы также могут быть применены для оценки транспортировки наркотиков и спряжения носителей наркотиков. Кроме того, эти методы могут быть адаптированы для использования в ориентации других отрицательно заряженных тканей, таких как мениск, роговица и стекловидного юмора.
Introduction
Доставка лекарств в отрицательно заряженные ткани в организме остается проблемой из-за неспособности препаратов проникать глубоко в ткани, чтобы достичь клеток и матрицы целевыхучастков 1. Некоторые из этих тканей состоят из плотно упакованных, отрицательно заряженных аггреканов, которые создают высокую отрицательную плотность фиксированного заряда (FCD)2 в тканях и выступают в качестве барьера для доставки большинства макромолекул3,4. Однако, с помощью положительно заряженных носителей наркотиков, этот отрицательно заряженный барьер ткани действительно может быть преобразован в депо наркотиков через электростатические взаимодействия заряда для устойчивойдоставки наркотиков 1,5,6,7(Рисунок 1).
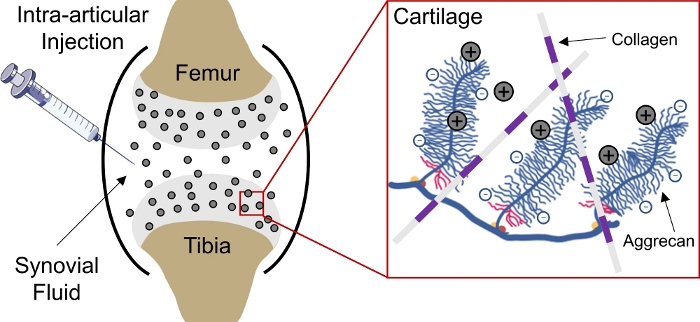
Рисунок 1: Зарядка на основе внутри хрящевой доставки КПК. Внутрисумаскулярная инъекция КПК в пространство коленного сустава. Электростатическое взаимодействие между положительно заряженными КЦК и отрицательно заряженными аггреканическими группами обеспечивает быстрое и полное проникновение через хрящ. Эта цифра была изменена из Vedadghavami идр. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Недавно, короткой длины катиотических носителей пептида (CPCs) были разработаны с целью создания небольших катиотических доменов, способных нести больших размеров терапии для доставки в отрицательно заряженныйхрящ 4. Для эффективной доставки препарата в хрящ длялечения распространенных 8,9 и дегенеративных заболеваний, таких как остеоартрит (ОА)10, очень важно, чтобы терапевтические концентрации наркотиков проникают глубоко в ткани, где большинство клеток хряща (хондроциты)лежат 11. Хотя Есть несколько потенциальных заболеваний изменения лекарств, ни один из них получили одобрение FDA, потому что они не в состоянии эффективноцелевой хрящ 12,13. Поэтому оценка транспортных свойств носителей наркотиков необходима для прогнозирования эффективности препаратов при индуцировании терапевтического ответа. Здесь мы разработали три отдельных эксперимента, которые могут быть использованы для оценки равновесного поглощения, глубины проникновения и не равновесной скорости диффузииКПК 4.
Для обеспечения достаточной концентрации препарата в хряще, который может обеспечить оптимальный терапевтический ответ, эксперименты поглощения были разработаны для количественной оценки равновесной концентрации КТК вхряще 4. В этой конструкции, следуя равновесию между хрящом и окружающей его ванной, общее количество раствора внутри хряща (либо привязанного к матрице, либо свободного) может быть определено с помощью коэффициента поглощения. Это соотношение рассчитывается путем нормализации концентрации растворим внутри хряща к концентрации равновесия в ванне. В принципе, нейтральные растворы, диффузии которых через хрящ не помогает заряда взаимодействия, будет иметь коэффициент поглощения менее 1. И наоборот, катиотические растворы, транспортировка которых усиливается с помощью электростатических взаимодействий, показывают коэффициент поглощения, более 1. Однако, как показано с CPCs, использование оптимального положительного заряда может привести к гораздо более высоким коэффициентам поглощения (больше, чем 300)4.
Хотя высокая концентрация наркотиков в хряще имеет важное значение для достижения терапевтической пользы, также важно, чтобы препараты рассеиваются через полную толщину хряща. Таким образом, исследования, показывающие глубину проникновения необходимы для обеспечения того, чтобы наркотики достигают глубоко внутри хряща, так что матрицы и клеточных целевых сайтов могут быть достигнуты, тем самым обеспечивая более эффективную терапию. Этот эксперимент был разработан для оценки одной из способов диффузии растворим через хрящ, имитируя диффузию наркотиков в хрящ после внутрисумочковой инъекции in vivo. Флуоресценция изображения с помощью конфокальные микроскопии позволяет для оценки глубины проникновения в хрящ. Чистый заряд частиц играет ключевую роль в модерации, как глубокие наркотики могут распространяться через матрицу. Оптимальный чистый заряд, основанный на ткани FCD, необходим для того, чтобы обеспечить слабо обратимое связывающее взаимодействие между катическими частицами и матрицей анионых тканей. Это означает, что любое взаимодействие достаточно слабо, так что частицы могут отмежеваться от матрицы, но обратимы в природе, так что он может связываться с другой матрицы связывания сайта глубже вткани 4. И наоборот, чрезмерный положительный чистый заряд частицы может быть пагубным по отношению к диффузии, так как слишком сильная матричная привязка предотвращает отслоение частиц от первоначального места связывания в поверхностной зоне хряща. Это приведет к недостаточной биологической реакции, как большинство целевых участков лежат глубоко в ткани11.
Для дальнейшей количественной оценки прочности связывающих взаимодействий, анализ наркотиков диффузии ставки через хрящ является выгодным. Не равновесные исследования диффузии позволяют сравнивать показатели диффузии в режиме реального времени между различными растворами. Поскольку препараты рассеиваются через поверхностные, средние и глубокие зоны хряща, наличие связывающих взаимодействий может значительно изменить скорость диффузии. При взаимодействии между препаратами и матрицей хряща, он определяется как эффективная диффузивность (DEFF). В этом случае, как только все связывающие сайты были заняты, уровень диффузии наркотиков регулируется устойчивым состоянием диффузии (DSS). Сравнение DEFF различных растворов определяет относительную связывающую прочность растворов с матрицей. Для данного раствора,если D EFF и DSS находятся в пределах одного порядка величины, это означает, что существует минимальное связывание настоящее время между препаратом и матрицы во время диффузии. Однако,если D EFF больше, чем DSS, существенное связывание частиц с матрицей существует.
Разработанные эксперименты индивидуально позволяют характеристику растворимого транспорта через хрящ, однако, целостный анализ с включением всех результатов требуется для разработки оптимально заряженных наркотиков перевозчика. Слабый и обратимый характер взаимодействия заряда контролирует скорость диффузии частиц и обеспечивает высокое равновесное поглощение и быстрое полное проникновение глубины через хрящ. Через эксперименты по равновесному поглощению, мы должны искать носителей, которые показывают высокое поглощение в результате взаимодействия заряда, которые могут быть проверены с помощью не равновесных исследований скорости диффузии. Тем не менее, эти связывающие взаимодействия должны быть слабыми и обратимыми по своему характеру, чтобы обеспечить полно толщину проникновения раствора через хрящ. Идеальный препарат перевозчик будет обладать оптимальным зарядом, который позволяет достаточно сильным связывания для поглощения и высокой концентрации внутри хряща наркотиков, но не слишком сильны, чтобы препятствовать полной толщиныдиффузии 4. Представленные эксперименты помогут в разработке характеристик для на основе заряда ткани ориентации носителей наркотиков. Эти протоколы были использованы для характеристики транспортировки КПКчерез хрящ 4, однако, они также могут быть применены к различным препаратам и носителей наркотиков через хрящ и другие отрицательно заряженные ткани.
Protocol
Representative Results
Discussion
Описанные здесь методы и протоколы имеют важное значение для области целевой доставки лекарств в отрицательно заряженные ткани. Из-за высокой плотности отрицательно заряженных аггреканов, присутствующих в этих тканях, создается барьер, тем самым предотвращая наркотики от достижения …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа финансировалась Министерством обороны США в рамках программ медицинских исследований Конгресса (CDMRP) по контракту W81XWH-17-1-0085 и Национального института здравоохранения R03 EB025903-1. AV финансировался стипендией инженерного декана в Северо-Восточном университете.
Materials
| 316 Stainless Steel SAE Washer | McMaster-Carr | 91950A044 | For number 5 screw size, 0.14" ID, 0.312" OD |
| 96-Well Polystyrene Plate | Fisherbrand | 12566620 | Black |
| Acrylic Thick Gauge Sheet | Reynolds Polymer | N/A | For non-equilibrium diffusion and 1-D diffusion transport chamber |
| Antibiotic-Antimycotic | Gibco | 15240062 | 100x |
| Bovine Cartilage | Research 87 | N/A | 2-3 weeks old, femoropatellar groove |
| Bovine Serum Albumin | Fisher BioReagents | BP671-1 | |
| CPC+14 | LifeTein | LT1524 | Custom designed peptide |
| CPC+20 | LifeTein | LT1525 | Custom designed peptide |
| CPC+8 | LifeTein | LT1523 | Custom designed peptide |
| Delicate Task Wipers | Kimberly-Clark Professional | 34155 | |
| Dermal Punch | MedBlades | MB5-1 | 3, 4 and 6 mm |
| Economy Plain Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Flat Bottom Cell Culture Plates | Corning Costar | 3595 | Clear, 96 well |
| Flexible Wrapping Film | Bemis Parafilm M Laboratory | 1337412 | |
| Gold Seal Cover Glass | Electron Microscopy Sciences | 6378701 | # 1.5, 18×18 mm |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A15 | 1/2" Diameter |
| Hammer-Driven Hole Punch | McMaster-Carr | 3427A19 | 3/4" Diameter |
| Laser | Chroma Technology | AT480/30m | Spectrophotometer Laser Light |
| Low-Strength Steel Hex Nut | McMaster-Carr | 90480A007 | 6-32 Thread size |
| LSM 700 Confocal Microscope | Zeiss | LSM 700 | |
| Micro Magnetic Stirring Bars | Bel-Art Spinbar | F37119-0007 | 7×2 mm |
| Multipurpose Neoprene Rubber Sheet | McMaster-Carr | 1370N12 | 1/32" Thickness |
| Non-Fat Dried Bovine Milk | Sigma Aldrich | M7409 | |
| Petri Dish | Chemglass Life Sciences | CGN1802145 | 150 mm diameter |
| Phosphate-Buffered Saline | Corning | 21-040-CMR | 1x |
| Plate Shaker | VWR | 89032-088 | |
| Protease Inhibitors | Thermo Scientific | A32953 | |
| Razor Blades | Fisherbrand | 12640 | |
| R-Cast Acrylic Thin Gauge Sheet | Reynolds Polymer | N/A | Black transport chamber inserts |
| RTV Silicone | Loctite | 234323 | Epoxy, Non-corrosive, clear |
| Scalpel | TedPella | 549-3 | #10, #11 blades |
| Signal Receiver | Chroma Technology | ET515lp | Spectrophotometer Laser Signal Receiver |
| Snap-Cap Microcentrifuge Tubes | Eppendorf | 22363204 | 1.5 mL |
| Spatula | TedPella | 13508 | |
| Synergy H1 Microplate Reader | Biotek | H1M | |
| Zinc-Plated Alloy Steel Socket Head Screw | McMaster-Carr | 90128A153 | 6-32 Thread size, 1" Long |
References
- Bajpayee, A. G., Grodzinsky, A. J. Cartilage-targeting drug delivery: can electrostatic interactions help. Nature Reviews Rheumatology. 13 (3), 183-193 (2017).
- Maroudas, A. Transport of solutes through cartilage: permeability to large molecules. Journal of Anatomy. 122, 335-347 (1976).
- Bajpayee, A. G., Wong, C. R., Bawendi, M. G., Frank, E. H., Grodzinsky, A. J. Avidin as a model for charge driven transport into cartilage and drug delivery for treating early stage post-traumatic osteoarthritis. Biomaterials. 35 (1), 538-549 (2014).
- Vedadghavami, A., et al. Cartilage penetrating cationic peptide carriers for applications in drug delivery to avascular negatively charged tissues. Acta Biomaterialia. 93, 258-269 (2019).
- Mehta, S., Akhtar, S., Porter, R. M., Önnerfjord, P., Bajpayee, A. G. Interleukin-1 receptor antagonist (IL-1Ra) is more effective in suppressing cytokine-induced catabolism in cartilage-synovium co-culture than in cartilage monoculture. Arthritis Research & Therapy. 21 (1), 238 (2019).
- Vedadghavami, A., Zhang, C., Bajpayee, A. G. Overcoming negatively charged tissue barriers: Drug delivery using cationic peptides and proteins. Nano Today. 34, 100898 (2020).
- Young, C. C., Vedadghavami, A., Bajpayee, A. G. Bioelectricity for Drug Delivery: The Promise of Cationic Therapeutics. Bioelectricity. , (2020).
- Felson, D. T. Osteoarthritis of the knee. New England Journal of Medicine. 354 (8), 841-848 (2006).
- Wieland, H. A., Michaelis, M., Kirschbaum, B. J., Rudolphi, K. A. Osteoarthritis – An untreatable disease. Nature Reviews Drug Discovery. 4 (4), 331-344 (2005).
- Martel-Pelletier, J. Pathophysiology of osteoarthritis. Osteoarthritis and Cartilage. 7 (4), 371-373 (1999).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage: Structure, composition, and function. Sports Health. 1 (6), 461-468 (2009).
- Chevalier, X., et al. Intraarticular injection of anakinra in osteoarthritis of the knee: A multicenter, randomized, double-blind, placebo-controlled study. Arthritis Care and Research. 61 (3), 344-352 (2009).
- Cohen, S. B., et al. A randomized, double-blind study of AMG 108 (a fully human monoclonal antibody to IL-1R1) in patients with osteoarthritis of the knee. Arthritis Research and Therapy. 13 (4), 125 (2011).
- Evans, C. H., Kraus, V. B., Setton, L. A. Progress in intra-articular therapy. Nature Reviews Rheumatology. 10 (1), 11-22 (2014).
- He, T., et al. Multi-arm Avidin nano-construct for intra-cartilage delivery of small molecule drugs. Journal of Controlled Release. 318, 109-123 (2020).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. A rabbit model demonstrates the influence of cartilage thickness on intra-articular drug delivery and retention within cartilage. Journal of Orthopaedic Research. 33 (5), 660-667 (2015).
- Bajpayee, A. G., Quadir, M. A., Hammond, P. T., Grodzinsky, A. J. Charge based intra-cartilage delivery of single dose dexamethasone using Avidin nano-carriers suppresses cytokine-induced catabolism long term. Osteoarthritis and Cartilage. 24 (1), 71-81 (2016).
- Zhang, C., et al. Avidin-biotin technology to synthesize multi-arm nano-construct for drug delivery. MethodsX. , 100882 (2020).
- Wagner, E. K., et al. Avidin grafted dextran nanostructure enables a month-long intra-discal retention. Scientific Reports. 10.1, 1-14 (2020).
- Troeberg, L., Nagase, H. Proteases involved in cartilage matrix degradation in osteoarthritis. Biochimica et Biophysica Acta – Proteins and Proteomics. 1824 (1), 133-145 (2012).
- Kirk, T. B., Wilson, A. S., Stachowiak, G. The effects of dehydration on the surface morphology of articular cartilage. Journal of Orthopaedic Rheumatology. 6 (2-3), 75-80 (1993).
- Ateshian, G. A., Maas, S., Weiss, J. A. Solute transport across a contact interface in deformable porous media. Journal of Biomechanics. 45 (6), 1023-1027 (2012).
- Arbabi, V., Pouran, B., Weinans, H., Zadpoor, A. A. Multiphasic modeling of charged solute transport across articular cartilage: Application of multi-zone finite-bath model. Journal of Biomechanics. 49 (9), 1510-1517 (2016).
- Arbabi, V., Pouran, B., Zadpoor, A. A., Weinans, H. An experimental and finite element protocol to investigate the transport of neutral and charged solutes across articular cartilage. Journal of Visualized Experiments. 2017 (122), (2017).
- Sampson, S. L., Sylvia, M., Fields, A. J. Effects of dynamic loading on solute transport through the human cartilage endplate. Journal of Biomechanics. 83, 273-279 (2019).
- Bajpayee, A. G., Scheu, M., Grodzinsky, A. J., Porter, R. M. Electrostatic interactions enable rapid penetration, enhanced uptake and retention of intra-articular injected avidin in rat knee joints. Journal of Orthopaedic Research : Official Publication of the Orthopaedic Research Society. 32 (8), 1044-1051 (2014).
- Bajpayee, A. G., et al. Sustained intra-cartilage delivery of low dose dexamethasone using a cationic carrier for treatment of post traumatic osteoarthritis. European Cells & Materials. 34, 341-364 (2017).
- Malda, J., et al. Of Mice, Men and Elephants: The Relation between Articular Cartilage Thickness and Body Mass. PLoS One. 8 (2), 57683 (2013).
- Frisbie, D. D., Cross, M. W., McIlwraith, C. W. A comparative study of articular cartilage thickness in the stifle of animal species used in human pre-clinical studies compared to articular cartilage thickness in the human knee. Veterinary and Comparative Orthopaedics and Traumatology. 19 (3), 142-146 (2006).

