تحسين نمو بلورات الإندوثيابسين لتجارب علم البلورات التسلسلي
Summary
الهدف من هذه المقالة هو إعطاء المشاهد فهما قويا لكيفية تحويل بروتوكول انتشار البخار صغير الحجم ، لزراعة بلورات بروتينية كبيرة مفردة ، إلى طريقة تبلور دقيق دفعة كبيرة الحجم لعلم البلورات التسلسلي.
Abstract
هنا ، يتم تقديم بروتوكول لتسهيل إنشاء كميات كبيرة (> 100 ميكرولتر) من الملاط البلوري الدقيق المناسب لتجارب علم البلورات التسلسلي في كل من السنكروترونات و XFELs. تعتمد الطريقة على فهم مخطط الطور البلوري للبروتين ، وكيف يمكن استخدام هذه المعرفة. تنقسم الطريقة إلى ثلاث مراحل: (1) تحسين التشكل البلوري ، (2) الانتقال إلى الدفعة ، و (3) التحجيم. تتضمن المرحلة 1 العثور على بلورات مفردة حيود بشكل جيد ، نأمل ولكن ليس بالضرورة ، في شكل يشبه المكعب. في المرحلة 2 ، يتم تحسين حالة المرحلة 1 من خلال وقت نمو البلورة. يمكن لهذه الاستراتيجية تحويل البلورات المزروعة عن طريق انتشار البخار إلى دفعة. بمجرد أن يحدث نمو بلوري في غضون 24 ساعة تقريبا ، يمكن رسم مورفوجرام للبروتين وخليط الراسب واستخدامه كأساس لاستراتيجية التحجيم (المرحلة 3). عندما يمكن زراعة البلورات دفعة واحدة ، يمكن محاولة التحجيم ، وتحسين حجم البلورة وتركيزها مع زيادة الحجم. تم استخدام Endothiapepsin كبروتين توضيحي لهذا البروتوكول. بعض القرارات المقدمة خاصة بالإندوثيابسين. ومع ذلك ، من المأمول أن تلهم الطريقة التي تم تطبيقها بها طريقة للتفكير في هذا الإجراء يمكن للآخرين تكييفها مع مشاريعهم الخاصة.
Introduction
درجة حرارة الغرفة (RT) علم البلورات الجزيئية شعبية مرة أخرى في مجتمع البيولوجيا الهيكلية. حفز تطوير مصادر ضوء ليزر الإلكترون الخالي من الأشعة السينية (XFEL) تطوير طرق توصيل عينات RT1،2،3،4 ، وقد تم تطبيق هذه الطرق الآن على السنكروترونات5،6،7،8. لا تفتح طرق RT فقط إمكانية وجود خيوط تجريبية لمسبار المضخة9،10،11،12 ، ولكن هناك أيضا أدلة متزايدة على أنها تعزز حالات مطابقة بديلة داخل البروتينات 13،14،15،16،17.
ومع ذلك ، فإن السبب الرئيسي وراء اكتساب طرق التبريد قوة جذب على نهج RT في أواخر تسعينيات القرن العشرين كان تباطؤ الضرر الإشعاعي بسبب درجات حرارة الكريستال دون الصفر18. بدأت طرق التبريد19 في السماح بجمع مجموعة بيانات كاملة من بلورة بروتين واحدة. حلت طرق RT الحديثة في XFELs والسنكروترونات مشكلة تلف الإشعاع أحادي البلورة من خلال تطوير استراتيجيات توصيل بلورية سريعة (> 100 هرتز)1،2،3،4. تسمح هذه الطرق بجمع مجموعة بيانات كاملة من آلاف البلورات المكشوفة بشكل فردي. لذلك تتطلب مناهج توصيل RT هذه إنتاج كميات كبيرة من المحاليل التي تحتوي على بلورات دقيقة متجانسة (> 100 ميكرولتر من بلورات < 50 ميكرومتر). ومع ذلك ، نظرا لأن طرق التبريد تميل إلى طلب بلورات مفردة فقط ، فإن طرق إنشاء مثل هذه الملاط البلوري الدقيق ليست موجودة حاليا في كل مكان عبر مختبرات علم بلورات البروتين.
هناك أمثلة في الأدبيات حول كيفية القيام بأجزاء من إجراء تحسين التبلور الدقيق لعينات علم البلورات التسلسلي. هنا ، يجب التمييز بين الغشاء والبروتينات القابلة للذوبان. تم وصف بروتوكولات تحسين نمو بلورات البروتين الغشائية الدقيقة المزروعة في monoolein (أو بعض الدهون الأخرى) ، للمرحلة المكعبة الدهنية (LCP) ، بشكل جيد20،21،22. ومع ذلك ، فإن طرق التبلور الدقيق للبروتينات القابلة للذوبان ، بما في ذلك البروتينات الغشائية المزروعة في ظروف غير LCP ، غير موجودة بشكل عام. ركزت الدراسات السابقة على أجزاء محددة من العملية ، مثل فحص البلورات الدقيقة 23,24 ، وتعزيز التنوي 24 ، والقياس باستخدام انتشار الواجهة الحرة25 ، ولكن ليس طريقة كاملة.
ومع ذلك ، تم وصف طريقة مؤخرا26 تحاول تقديم بروتوكول كامل. مثل العديد من جوانب علم بلورات البروتين ، فهي ليست جديدة. وقد وصف رايمنت (2002)27 بالفعل العديد من الأفكار المقترحة. تهدف الطريقة إلى إظهار علماء البلورات كيفية إجراء التحويل من بلورة واحدة نمت باستخدام انتشار البخار ، إلى منهجية دفعية لزراعة الآلاف من البلورات الدقيقة. تركز الطريقة على انتشار البخار كنقطة انطلاق مشتركة ، حيث أن 95٪ من جميع ترسبات بنك بيانات البروتين (PDB) تأتي من بلورات تزرع في ألواح انتشار البخار26. ومع ذلك ، فإن انتشار البخار ليس الطريقة المثالية للتبلور الدقيق26 ، لذلك يتم وصف منهجية لتحويل انتشار البخار إلى بلورة دفعية. بمجرد أن يمكن زراعة البلورات دفعة واحدة ، يصبح توسيع المسارات إلى أحجام أكبر أكثر قابلية للتطبيق. بالنظر إلى تقلبات تبلور البروتين ، يؤكد المؤلفون أن هذه الطريقة ليست آمنة من الفشل. ومع ذلك ، يجب أن يوفر البروتوكول ، على الأقل ، نظرة ثاقبة على “مساحة التبلور” للبروتين.
تعتمد هذه الطريقة على مخطط مرحلة بلورة البروتين وكيف يمكن أن يكون فهم هذا المخطط بمثابة دليل أثناء تحسين التبلور الدقيق. عادة ما يتم تصوير مخطط طور البروتين على أنه مخطط x / y مع تركيزات المرسب والبروتين على المحورين x و y ، على التوالي (الشكل 1A). من نقطة الماء النقي (الزاوية اليسرى السفلية – الشكل 1 أ) ، يزداد تركيز كل من البروتين والراسب حتى يتم الوصول إلى خط الذوبان. يشير خط الذوبان إلى نقطة التشبع الفائق (الخط الأرجواني – الشكل 1 أ). عندما يكون البروتين مفرط التشبع ، يصبح المحلول غير مستقر ديناميكيا حراريا وسيبدأ في الانفصال إلى مرحلتين: “غني بالبروتين” ومحلول مشبع مستقر. يمكن أن يحدث هذا الفصل في أي مكان خارج خط الذوبانية وتعتمد حركيته على خصائص البروتين ومكونات المحلول.
عندما يكون البروتين وتركيزات المرسب كبيرة جدا ، سوف يتحلل البروتين بشكل غير مستقر من المحلول وينتج عنه راسب غير متبلور (المنطقة الوردية – الشكل 1 أ). ومع ذلك ، يمكن أن يحدث فصل الطور المرتب في منطقة النواة [انظر Garcia-Ruiz (2003) 28 للحصول على وصف مفصل] والنيوكليات البلورية لديها ميل للتكوين (المنطقة الخضراء – الشكل 1 أ). يزيل التنوي والنمو البروتين من المحلول وينقلان الهبوط إلى المنطقة شبه المستقرة حيث يمكن أن يستمر النمو حتى يتم الوصول إلى خط الذوبان [انظر McPherson and Kuznetsov (2014) 29 لمناقشة مفصلة]. الرسم البياني هو ، بالنسبة للغالبية العظمى من ظروف التبلور ، تبسيط مفرطإجمالي 30. بغض النظر عن هذا ، لا يزال الرسم البياني ذا فائدة كبيرة لعلماء البلورات الدقيقة لأن تعيين الرسم البياني يسمح بتحديد خط الذوبان وحركية النواة.
من حيث إنشاء بلورات دقيقة ، فإن العاملين أثناء التبلور اللذين يحتاجان إلى تحسين هما عدد البلورات (Xn) ومتوسطها الأطول بعدا (Xs). X n سيكون متناسبا مع عدد أحداث التنوي (n ) (مكافئ 1).
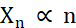 مكافئ 1
مكافئ 1
X s يتناسب مع تركيز البروتين الحر فوق خط الذوبان (Ps) مقسوما على Xn (مكافئ 2).
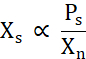 مكافئ 2
مكافئ 2
في الوضع المثالي ، سينتج عن كل حدث نواة بلورة محتملة وكل واحدة من هذه البلورات ، سيكون لها وصول متساو إلى البروتين المتاح في المحلول. الشكل 2 هو تمثيل رسومي من سيناريو مثالي للعلاقة بين Xn و Xs. من الناحية العملية ، فإن التحكم الرئيسي الذي يمتلكه عالم البلورات على Xn و Xs هو التأثير على كمية النوى أو عن طريق إضافة بلورات البذور. يجب أن يحكم عالم البلورات الدقيقة على كيفية زيادة Xn بحيث يمكن إنشاء تركيز بلوري مناسب وحجم بلوري.
تتطلب غالبية تقنيات التبلور “فترة انتقالية” (الشكل 1 ب). على سبيل المثال ، في تجربة انتشار البخار ، عند خلط البروتين والمحاليل المرسبة ، ستتغير تركيزات كل منهما مع توازن القطرة مع محلول البئر. يأمل المرء أن تؤدي هذه التغييرات إلى نقل الانخفاض تدريجيا إلى منطقة النواة حيث سيزداد الميل إلى التبلور. عندما تبدأ البلورات في النواة والنمو ، ستبدأ كمية البروتين في المحلول في الانخفاض ، مما يقلل من احتمال حدوث المزيد من النواة. ستكون الكمية النهائية من التنوي محددة البروتين والحالة ، وتعتمد أيضا على عمق الاختراق في منطقة النواة. بالنظر إلى الاختراق المحدود لمنطقة التنوي للطرق التي تتطلب خطوة انتقالية ، فإن مستوى التنوي سيقتصر في النهاية على معدل التنوي عند حدود منطقة التنوي شبه المستقرة.
نظرا لأهمية القدرة على تحسين مستوى التنوي لعالم البلورات الدقيقة ، من المهم الانتقال إلى منهجية تبلور الدفعات. يمكن أن تستفيد الدفعة بشكل أكبر من منطقة التنوي بأكملها (الشكل 1C). في طرق الدفعات ، تتمثل الفكرة في خلط البروتين والراسب معا بحيث يتم إنشاء محلول مفرط التشبع دون الحاجة إلى أي تغييرات في تركيزات المكونات. يجب أن تكون النواة ممكنة فور الخلط. لذلك تسمح طرق الدفعات بالوصول إلى منطقة التنوي بأكملها نظريا. يمكن بعد ذلك استخدام أي زيادة في حركية التنوي تتجاوز حدود النوى المستقرة.
إذا لم يكن المستوى القاعدي للنواة البلورية كافيا لتوليد Xn كبير ، فيمكن استخدام طرق البذر الدقيق. في البذر الدقيق ، يتم تكسير البلورات المزروعة مسبقا لإنشاء ملاط من الشظايا البلورية التي يمكن أن تكون بمثابة سقالة لنمو البلورات الطازجة31,32. تم استخدام البذر الدقيق على نطاق واسع في تحضير العينات البلورية التسلسلية كطريقة لزيادة Xn دون الحاجة إلى زيادة النوى البلورية (الشكل 1C).
يمكن تصور الانتقال من الانتشار البخاري إلى الدفعة على مخطط الطور على أنه نقل نقطة البداية التجريبية من المناطق غير المشبعة أو شبه المستقرة إلى منطقة النواة. يمكن القيام بذلك عن طريق زيادة تركيزات البروتين و / أو المرسب ، و / أو نسبة الاثنين داخل القطرة (الشكل 1 د) ، ومراقبة الظروف التي تنتج بلورات تظهر بسرعة (< 24 ساعة)26. يمكن أن يستغرق التوازن الكامل لانخفاض انتشار البخار أياما أو أسابيع33. لذلك ، من خلال البحث عن الظروف التي تظهر بلورات سريعة الظهور ، يمكن العثور على ظروف الدفعات دون الحاجة إلى الانتقال إلى تنسيقات فحص التبلور البديلة مثل الدفعة الدقيقة34،35،36،37.
بمجرد العثور على منطقة التنوي ، تم العثور على حالة دفعة ويمكن إنشاء مورفوغرام – هنا ، مخطط طور تقريبي. يعد الرسم البياني ذا فائدة كبيرة عند التفكير فيما إذا كان سيتم استخدام بروتوكول دفعة مصنفة أو دفعة مستقيمة. من خلال رسم Xn كدالة للبروتين وتركيز الراسب ، يمكن إجراء تقييم لحركية التنوي26. إذا ظل X n منخفضا عبر منطقة التنوي بأكملها ، فقد تكون هناك حاجة إلى دفعة مصنفة لجعل Xn كبيرا بما يكفي للحد من نمو البلورات. هذا التقييم هو الخطوة الأولى في عملية التوسع إلى أحجام أكبر (> 100 ميكرولتر).
تم تصميم هذه الطريقة بحيث يمكن إجراؤها في غالبية مختبرات التبلور باستخدام معدات بلورة انتشار البخار القياسية. كما أجريت العديد من الدراسات التي تصف التقنيات لتسهيل أجزاء كثيرة من هذه العملية ، إذا كانت المعدات متوفرة. وتشمل هذه ، على سبيل المثال لا الحصر ، تشتت الضوء الديناميكي (DLS) 25،27 ، والتصوير غير الخطي 20،24،25 ، وحيود المسحوق 20،24،27 ، والمجهر الإلكتروني 26 [انظر Cheng et al. (2020) 40 للحصول على مراجعة لطيفة].
الهدف من هذا العمل هو تقديم عرض مرئي لطريقة الانتقال من تبلور انتشار البخار صغير الحجم ( 100 ميكرولتر). تم استخدام Endothiapepsin من Cryphonectria parasitica كنظام مثال لتوضيح هذه الترجمة. سيؤثر نوع التجربة وطريقة تسليم العينات المطلوبة للبلورات الدقيقة على ناتج Xs المثالي 26. بالنسبة لتجارب الخلط التي تتطلب دقة زمنية ميليثانية 41 أو فوهات افتراضية ديناميكية للغاز42 ، قد يكون من المرغوب فيه الحصول على Xs نهائي يبلغ < 5 ميكرومتر. في هذه الحالة ، كان الهدف هو إنتاج بلورات بروتينية تنحرف إلى حوالي 1.5 Å ، لتجربة مسبار المضخة المنشط بالفوتون ، واستخدام نهج توصيل الهدف الثابت.
لإعطاء توضيح لمتطلبات العينة لتجربة علم البلورات التسلسلية هذه باستخدام endothiapepsin ، يوضح الجدول 1 المعلمات التجريبية لتجربة افتراضية. استندت معلومات العينة إلى البروتوكول الموضح أدناه. بالنظر إلى بعض التقديرات المتحفظة حول معدلات الإصابة ومتطلبات جمع البيانات ، فإن 50 مجم هو إجمالي تقدير استهلاك العينة للتجربة بأكملها.
يوضح الشكل 3 مخططا انسيابيا لعملية التحسين الكاملة من تبلور انتشار البخار الأولي صغير الحجم إلى الدفعة واسعة النطاق. بالنسبة لغالبية مشاريع علم البلورات التسلسلي ، سيبدأ هذا البروتوكول في الخطوة 2: “الانتقال إلى الدفعة” ، حيث أن البروتين المستهدف سيكون قد تبلور بالفعل. ومع ذلك ، تم تضمين الخطوة 1 للتأكد من اكتمالها ولتذكير القراء بأهميتها. إن العثور على حالة تؤدي إلى حيود جيد ، بلورة مفردة ، كبيرة هو أفضل نقطة انطلاق لتحسين البلورات الدقيقة. في الخطوة 2 ، يمكن بعد ذلك تحسين هذه الحالة من انتشار البخار إلى الدفعة ، ويمكن رسم مورفوغرام للمناطق النواة وشبه المستقرة. بمجرد الانتهاء من ذلك ، يمكن إجراء تغيير حجم حالة الدفعات إلى أحجام أكبر في الخطوة 3. بحلول نهاية المخطط الانسيابي ، سيكون عالم البلورات قد أنشأ بروتوكولا قابلا للتكرار ، كبير الحجم (> 100 ميكرولتر) ، تبلور دقيق ، بروتوكول دفعي للإندوثيابسين. يمكن بعد ذلك تطبيق هذه الطريقة على البروتين الخاص الذي يهمهم.
Protocol
Representative Results
Discussion
توضح الطريقة المقدمة كيفية تحسين تبلور endothiapepsin من بلورات كبيرة (أطول بعد ≥ 100 ميكرومتر) ، نمت في شاشات متفرقة ذات مصفوفة 96 بئرا ، إلى بلورات دقيقة ، نمت في أنابيب طرد مركزي (حجم 300 ميكرولتر) عبر الدفعة. الفكرة وراء البروتوكول هي أن الخطوات المتخذة لتحسين endothiapepsin يمكن استخدامها أيضا للبروتينات الأخرى. في نهاية المطاف ، الإجابة على مشكلة إنشاء كميات كبيرة (>100 ميكرولتر) من البلورات الدقيقة (10-20 ميكرومتر) لتجارب علم البلورات التسلسلية في XFELs والسنكروترونات.
يقسم البروتوكول مهمة التبلور الدقيق كبير الحجم إلى ثلاث خطوات: (1) تحسين مورفولوجيا البلورة ، (2) الانتقال إلى الدفعة ، و (3) التحجيم. في الخطوة 1 ، يجب استكشاف مجموعة الأشكال البلورية التي يمكن أن ينتجها البروتين في ألواح انتشار البخار. يجب أن تكون الظروف التي تؤدي إلى بلورات مفردة تشبه الصندوق تنحرف إلى الدقة المطلوبة هي الهدف. في الخطوة 2 ، يمكن بعد ذلك تحويل الظروف المحددة من انتشار البخار إلى الدفعة. هنا ، معيار التحسين هو وقت نمو البلورات وإيجاد الظروف التي تؤدي إلى بلورات البروتين في غضون 24 ساعة. يمكن أيضا رسم مورفوجرام لإعطاء المجرب فكرة عن موقع خط الذوبان وحدود منطقة النواة. هذا المورفوغرام له فائدة كبيرة في الخطوة 3 ، التحجيم. سيعطي المورفوجرام مؤشرا على ما إذا كانت النواة وحدها يمكن أن تزيد Xn وتدفع Xs إلى أسفل. مع زيادة حجم التجربة ، يمكن تقييم Xn و Xs باستمرار كمعايير رئيسية لتوسيع نطاق النجاح.
في حالة Endothiapepsin ، اكتشفت الخطوة 1 ما يحتمل أن يكون مورفولوجيا بلورية غير معروفة سابقا ل endothiapepsin. كان لهذا التشكل نفس المجموعة الفضائية مثل تلك التي تم الإبلاغ عنها سابقا ، ولكن الأهم من ذلك بالنسبة لعلم البلورات التسلسلي ، شكل يشبه الصندوق. يبدو أيضا أن البلورات المفردة تنمو من نقاط نواة مفردة ، على عكس المراوح التي تم إنشاؤها من ظروف أخرى (الشكل 4). بالنسبة للحالة المحددة ، كانت الخطوة 2 راضية جزئيا بالفعل حيث حدث نمو بلوري في < 24 ساعة. أشار المورفوجرام إلى أن كلا من بروتوكول الدفعات المستقيمة أو المصنفة قد يكون ناجحا عند التوسع في الخطوة 3. أدى التحجيم الأولي في دفعة مستقيمة إلى إنشاء حالة أنتجت بلورات بنطاق Xn و Xs من 3.6 ± 1.2 × 106 بلورات · mL-1 و 42 ± 4.1 ميكرومتر ، على التوالي. هذه البلورات ، على الرغم من أنها مقبولة لبعض تجارب علم البلورات التسلسلي ، اعتبرت كبيرة جدا. لذلك تم إجراء تحسينات إضافية. أنتج البروتوكول النهائي بلورات بتركيز ونطاق حجم 3.1 × 106 بلورات · مل -1 و 15 ± 3.9 ميكرومتر ، على التوالي. كان هذا أكثر من مثالي للتجارب المخطط لها.
تركز الطريقة على تحويل بلورات البروتين “القابلة للذوبان” المزروعة في ألواح انتشار البخار إلى دفعة. والسبب في هذا التركيز هو أن الغالبية العظمى من بلورات البروتين القابلة للذوبان تزرع عن طريق انتشار البخار26. ومع ذلك ، يمكن أيضا تطبيق المفاهيم المقدمة على بلورات البروتين القابلة للذوبان المزروعة باستخدام طرق أخرى ، مثل الدفعة الدقيقة. قد تكون المفاهيم قابلة للتطبيق أيضا على بلورات البروتين الغشائية المزروعة في LCP. لأن هذه أيضا عملية بلورة دفعية.
يتمثل أحد الجوانب الرئيسية للبروتوكول في عملية تحويل ظروف البلورات المزروعة في ألواح انتشار البخار بحيث يمكن زراعتها دفعة واحدة. لهذا التحول ، تستخدم الطريقة المعيار الذي اقترحه Beale et al. (2019) 26. تتشكل البلورات المزروعة عبر عملية الدفعات ، حتى في ألواح انتشار البخار ، بسرعة (< 24 ساعة). هذا المعيار هو تقريب يعتمد على سرعة توازن انخفاض انتشار البخار ، وهو أكثر صحة بالنسبة لظروف الراسب القائمة على PEG. ومع ذلك ، ستحتوي ظروف التبلور على مجموعة متنوعة من المركبات التي ستؤثر على وقت التوازن. يمكن أن يحدث توازن ظروف التبلور القائمة على الملح ، على سبيل المثال كلوريد الأمونيوم عالي التركيز ، في 1-2 أيام. لذلك ، قد لا يكون معيار 24 ساعة صحيحا بالنسبة للظروف القائمة على الملح. يمكن أن تحتوي الظروف القائمة على الملح أيضا على مخططات طور أكثر تعقيدا 26,30 قد لا تتوافق مع النموذج الأصلي المقدم في هذا البروتوكول. قد يكون من الضروري تقليل المعيار الزمني للظروف القائمة على الملح إلى 12 أو 6 ساعات إذا ثبت أن التوسع إلى أحجام أكبر مستحيل.
قيد آخر لهذه الطريقة هو تعقيدها الواضح. البروتوكول الذي تم اتباعه لتحسين التبلور الدقيق للإندوثيابسين غير الحالة الأصلية من شاشة المصفوفة المتناثرة قليلا نسبيا. كانت الضربة الأولى التي لوحظت في شاشة PACT هي 0.1 HEPES pH 7.0 و 0.2 M MgCl2 و 20٪ (وزن / حجم) PEG 6000. كان المخزن المؤقت النهائي للتبلور المتدرج 0.1 Tris-HCl pH 7.0 و 0.15 M MgCl2 و 40٪ (w / v) PEG 6000. من الممكن أيضا أن يكون التغيير في المخزن المؤقت من HEPES إلى Tris-HCl ، وتركيز MgCl2 ، قد ساهم قليلا في نجاح العملية. ترك الزيادة في تركيز PEG 6,000 هو التحسين الوحيد ، والذي كان من الممكن تحقيقه بكل بساطة.
غير أن هذا التقييم مفرط في التبسيط. إنه لا يقلل فقط من المشاكل التي تواجهها أثناء التحجيم (أي استخدام البذور والتبريد) ، ولكن أيضا حقيقة أنه لمجرد أن هذا البروتين أثبت أنه واضح ومباشر ، فليس هناك ما يضمن أن البروتين التالي سيثبت أيضا. تم وضع الخطوات الموصى بها في البروتوكول لأن تحسين حجم أحجام بلورة البروتين يمكن أن يكون مكلفا للغاية بالنسبة للبروتين. خلال تجارب تحجيم الإندوثيابسين السبع الموضحة ، تم استهلاك 100 ملغ من البروتين. ومن المسلم به أن بعض هذه الخطوات قد نفذت لإظهار عواقبها في ضوء هذا البروتوكول. ومع ذلك ، فإن 100 ملغ من البروتين ، بالإضافة إلى 50 ملغ أخرى للبروتين المستهلك أثناء التجربة (الجدول 1) ، يمكن أن يكون استثمارا كبيرا في الوقت أو المال.
لحسن الحظ ، ليس من الواضح أن هذه الكتلة من العينة المطلوبة موجودة في كل مكان عبر جميع البروتينات. كان Endothiapepsin قابلا للذوبان بدرجة عالية ، وبالتالي يتطلب تركيزا كبيرا من البروتين للوصول إلى التشبع الفائق. في حالات أخرى (قيد التحسين حاليا) ، يمكن الوصول إلى التشبع الفائق عند 10 أو حتى 5 مجم / مل. هذه المتغيرات خاصة بالبروتين وتحتاج إلى تبنيها عند ظهورها.
تشمل القيود الأخرى للطريقة اعتمادها على المعدات المعقدة مثل روبوتات معالجة السوائل لإنشاء الشاشة واللوحة ، وأجهزة التصوير لتصوير اللوحات تلقائيا عند الحاجة. تم تقديم إجراءات بديلة للحد من الحاجة إلى بعض هذه القطع من المعدات ، لكن البروتوكول سيستغرق وقتا أطول للمتابعة بدونها. يقترح البروتوكول أيضا اختبار حيود البلورات المحسنة. بالنسبة لعلماء البلورات الذين ليس لديهم وصول منتظم إلى السنكروترون ، قد تكون هذه الاختبارات صعبة. قد لا تكون عناصر التحكم في كل خطوة ضرورية ، ولكن يوصى بشدة بهذه الاختبارات بمجرد تحديد النتيجة ، وقبل القياس وبعده. البلورات غير الحيود في XFEL ، للأسف ، ليست أمرا غير شائع. بالنظر إلى هذا ، من الأفضل أن نخطئ في جانب الحذر فيما يتعلق بالافتراضات حول حيود البلورة.
في النهاية ، سيقدم هذا البروتوكول والنتائج المعروضة هنا دليلا وأفكارا ومثالا لأولئك الذين يكافحون من أجل إنتاج عينات لتجارب علم البلورات التسلسلية. ومن المأمول، مع زيادة تطوير علم البلورات التسلسلي، أن تقل متطلبات العينات لهذه التقنية بحيث تقل الحاجة إلى بروتوكولات كهذه. ومع ذلك ، حتى في هذا الحدث ، ستظل الاستراتيجيات المقدمة هنا مفيدة لأولئك الذين يرغبون في استكشاف مساحة تبلور البروتين الخاصة بهم.
Disclosures
The authors have nothing to disclose.
Acknowledgements
تلقى هذا المشروع تمويلا من برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية منحة Marie Skłodowska-Curie رقم 701647. شكرا جزيلا لمساعدة ودعم علماء خط الشعاع في خط شعاع مصدر الضوء السويسري X10SA-PXII.
Materials
| Swissci 96-well 2-Drop plates | Molecular Dimensions | MD11-002 | 96-well 2-drop crystallisation plate |
| Swissci 96-well 3-Drop plates | Molecular Dimensions | MD11-003 | 96-well 3-drop crystallisation plate |
| mosquito LCP liquid handling robot | sptlabtech | mosquito LCP | Crystallisation robot |
| ClearVue Sheets | Molecular Dimensions | MD6-015 | 96-well crystallization plate seals |
| Safe-Tube 1.5 mL | Eppendorf | 30120086 | 1.5 mL centrifuge tubes |
| Scaple | Swan and Morton | No. 3 scalple and No. 3 handle | Scalple for cutting open plate seals |
| MS 3 Vortex | IKA | 3319000 | Vortex for mixing solution and making seed stocks |
| 24-well XRL Plate | Molecular Dimensions | MD3-11 | 24-well hanging-drop plates |
| Tube revolver/rotator | Thermo Fischer Scientific | 88881001 | Tube revolver for mixing solution during scaling |
| Eppendorf Research plus pipettes | Eppendorf | Range of manual pipettes, 0.5-10, 1-20, 10-100, 100-1000 µL | |
| Eppendorf pipette tips | Eppendorf | Range of tip sizes for manual pipettes | |
| Suparen 600 | Prochem AG | Suparen 600 | Endothiapepsin solution |
| Sodium Acetate | Sigma-Aldrich | 241245-1KG | Sodium Acetate |
| Tris | Merck | 8382T014 | Tris |
| Magnesium Chloride | Sigma-Aldrich | M2670-1kg | Magnesium Chloride |
| PEG 6,000 | Sigma-Aldrich | 81255-1kg | PEG 6,000 |
| Ethelyene glycol | Sigma-Aldrich | 324558-1L | Ethelyene glycol for cyro-protecting the crystals |
| PACT Premier HT screen | Molecular Dimensions | MD1-36 | PACT Premier 96-well crystal screen |
| DOW CORNING high vacuum grease | Molecular Dimensions | MD6-02 | Grease for sealing 24-well plates |
| Hirschmann 22 x 22 mm glaser cover slides | Hirschmann | 8000104 | Cover slides for sealing 24-well sitting drop plates |
| Crystal pins | PSI | Manufactured inhouse | Thin-film supports for micro-crystals. |
| 1-1.3 mm SiLibeads Type S | Faust | 6239547 | Glass beads for making mico-seed stocks |
| Macbook Pro | Apple | Macbook Pro | Computer for performing data analysis |
| CCP4 software suite | CCP4 | Diffraction pattern data processing software | |
| Excel | Microsoft | Microsoft Office | Plotting tool for phase diagram |
| Hausser Scientific Bright-Line counting chamber | Thermo Fischer Scientific | 02-671-51B | Tool to calculate crystal concentration |
| PACT Premier | Molecular Dimensions | MD1-29-ECO | Sparse-matrix crystallization screen |
| Rock Imager | Formulatrix | Rock Imager | Temperature controlled crystal plate storage and imager |
| Rock MakerWeb | Formulatrix | Rock MakerWeb | Crystal plate creation and image storage stoftware |
| Formulator | Formulatrix | Formulator | 96-well crystal screen creation liquid handling robot |
| Leica MZ16 Microscope | Leica | Leica MZ16 | Light microscope |
| LAS V4.6 | Leica | LAS V4.6 | Software for Leica microscopes |
| Spectra/Por 3.5 kDa dialysis tubing | Spectrumlabs | Spectra/Por 3 Dialysis Membrane | 3.5 kDa dialysis membrane |
| Dialysis tubing closures | Spectrumlabs | Spectra/Por 3 Duniversal Closures | Clips to seal the dialysis tubing ends |
| Amicon 10 kDa centrifugal concentrator | Merck-Millipore | Amicon Ultra-15 10 kDa centrifugal concentrator | 10 kDa centrifugal filter |
| 5810 R swing bucket centrifuge | Eppendorf | 5810 R Centrifuge | Swing bucket centrifuge |
References
- DePonte, D. P., et al. Gas dynamic virtual nozzle for generation of microscopic droplet streams. Journal of Physics D: Applied Physics. 41 (19), 195505 (2008).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Scientific Reports. 4 (1), 6026 (2014).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature Communications. 5 (1), 1-6 (2014).
- Roessler, C. G. G., et al. Acoustic Injectors for Drop-On-Demand Serial Femtosecond Crystallography. Structure. 24 (4), 631-640 (2016).
- Sherrell, D. A., et al. A modular and compact portable mini-endstation for high-precision, high-speed fixed target serial crystallography at FEL and synchrotron sources. Journal of Synchrotron Radiation. 22 (6), 1372-1378 (2015).
- Roedig, P., et al. A micro-patterned silicon chip as sample holder for macromolecular crystallography experiments with minimal background scattering. Scientific Reports. 5 (1), 1-11 (2015).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Nango, E., et al. A three-dimensionalmovie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Halle, B. Biomolecular cryocrystallography: structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Fraser, J. S., et al. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Fenwick, R. B., van den Bedem, H., Fraser, J. S., Wright, P. E. Integrated description of protein dynamics from room-temperature X-ray crystallography and NMR. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 445-454 (2014).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. Elife. 4, (2015).
- Thomaston, J. L., et al. XFEL structures of the influenza M2 proton channel: Room temperature water networks and insights into proton conduction. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 13357-13362 (2017).
- Haas, D. J., Rossmann, M. G. Crystallographic studies on lactate dehydrogenase at -75 °C. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26 (7), 998-1004 (1970).
- Hope, H. Cryocrystallography of biological macromolecules: a generally applicable method. Acta Crystallographica Section B Structural Science. 44 (1), 22-26 (1988).
- Wu, W., et al. Batch crystallization of rhodopsin for structural dynamics using an X-ray free-electron laser. Acta Crystallographica Section:F Structural Biology Communications. 71 (7), 856-860 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and delivery of protein microcrystals in lipidic cubic phase for serial femtosecond crystallography. Journal of Visualized Experiments. (115), e54463 (2016).
- Andersson, R., et al. Well-based crystallization of lipidic cubic phase microcrystals for serial X-ray crystallography experiments. Acta Crystallographica Section D: Structural Biology. 75 (10), 937-946 (2019).
- Luft, J. R., et al. The detection and subsequent volume optimization of biological nanocrystals. Structural Dynamics. 2 (4), 041710 (2015).
- Lee, D. B., et al. Supersaturation-controlled microcrystallization and visualization analysis for serial femtosecond crystallography. Scientific Reports. 8 (1), 1-10 (2018).
- Kupitz, C., et al. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1647), 20130316 (2014).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Rayment, I. Small-scale batch crystallization of proteins revisited: An underutilized way to grow large protein crystals. Structure. 10 (2), 147-151 (2002).
- García-Ruiz, J. M. Nucleation of protein crystals. Journal of Structural Biology. 142 (1), 22-31 (2003).
- McPherson, A., Kuznetsov, Y. G. Mechanisms, kinetics, impurities and defects: Consequences in macromolecular crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (4), 384-403 (2014).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta crystallographica. Section F, Structural biology communications. 71, 247-260 (2015).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D Biological Crystallography. 55 (5), 988-993 (1999).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta crystallographica. Section D, Biological crystallography. 60 (3), 601-605 (2004).
- Forsythe, E. L., Maxwell, D. L., Pusey, M. Vapor diffusion, nucleation rates and the reservoir to crystallization volume ratio. Acta Crystallographica Section D Biological Crystallography. 58 (10), 1601-1605 (2002).
- Chayen, N. E., Shaw Stewart, P. D., Maeder, D. L., Blow, D. M. IUCr An automated system for micro-batch protein crystallization and screening. Journal of Applied Crystallography. 23 (4), 297-302 (1990).
- Chayen, N. E., Shaw Stewart, P. D., Blow, D. M. Microbatch crystallization under oil – a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Chayen, N. E. Comparative studies of protein crystallization by vapour-diffusion and microbatch techniques. Acta Crystallographica Section D: Biological Crystallography. 54 (1), 8-15 (1998).
- D’Arcy, A., Mac Sweeney, A., Stihle, M., Haber, A. The advantages of using a modified microbatch method for rapid screening of protein crystallization conditions. Acta Crystallographica – Section D Biological Crystallography. 59 (2), 396-399 (2003).
- Darmanin, C., et al. Protein crystal screening and characterization for serial femtosecond nanocrystallography. Scientific Reports. 6, 25345 (2016).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2247-2252 (2017).
- Cheng, R. K. Y. Towards an optimal sample delivery method for serial crystallography at XFEL. Crystals. 10 (3), 215 (2020).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. 2013, 1-10 (2013).
- Oberthuer, D., et al. Double-flow focused liquid injector for efficient serial femtosecond crystallography. Scientific Reports. 7 (1), 44628 (2017).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- Yaoi, M., et al. Effect of stirring method on protein crystallization. Japanese Journal of Applied Physics, Part 2: Letters. 43 (10), 1318 (2004).
- Castro, F., Ferreira, A., Teixeira, J. J., Rocha, F. Influence of Mixing Intensity on Lysozyme Crystallization in a Meso Oscillatory Flow Reactor. Crystal Growth & Design. 18 (10), 5940-5946 (2018).
- Moews, P. C., Bunn, C. W. An X-ray crystallographic study of the rennin-like enzyme of Endothia parasitica. Journal of Molecular Biology. 54 (2), 395-397 (1970).
- Newman, J., et al. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta crystallographica. Section D, Biological. 61, 1426-1431 (2005).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D Structural Biology. 75, 151-159 (2019).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), (2019).

