Otimizando o Crescimento de Cristais de Endotiapsina para Experimentos de Cristalografia Seriada
Summary
O objetivo deste artigo é dar ao espectador uma compreensão sólida de como transformar seu protocolo de difusão de vapor de pequeno volume, para o cultivo de grandes cristais de proteína única, em um método de microcristalização em lote de grande volume para cristalografia seriada.
Abstract
Aqui, um protocolo é apresentado para facilitar a criação de grandes volumes (> 100 μL) de polpas microcristalinas adequadas para experimentos seriados de cristalografia em síncrotrons e XFELs. O método é baseado na compreensão do diagrama de fases do cristal de proteínas, e como esse conhecimento pode ser utilizado. O método é dividido em três etapas: (1) otimização da morfologia cristalina, (2) transição para batelada e (3) dimensionamento. O estágio 1 envolve encontrar cristais simples bem difratantes, esperançosamente, mas não necessariamente, apresentando-se em uma morfologia semelhante a um cubo. No Estágio 2, a condição do Estágio 1 é otimizada pelo tempo de crescimento do cristal. Esta estratégia pode transformar cristais crescidos por difusão de vapor em batelada. Uma vez que o crescimento do cristal pode ocorrer dentro de aproximadamente 24 h, um morfograma da proteína e da mistura precipitante pode ser plotado e usado como base para uma estratégia de escalonamento (Estágio 3). Quando os cristais podem ser cultivados em lote, a escala pode ser tentada e o tamanho e a concentração do cristal são otimizados à medida que o volume é aumentado. A endotiapepsina tem sido utilizada como proteína de demonstração para este protocolo. Algumas das decisões apresentadas são específicas da endotiapepsina. No entanto, espera-se que a forma como foram aplicados inspire uma forma de pensar sobre este procedimento que outros possam adaptar aos seus próprios projetos.
Introduction
A cristalografia de macromoléculas à temperatura ambiente (TR) é novamente popular na comunidade de biologia estrutural. O desenvolvimento de fontes de luz XFEL (X-ray Free Electron Laser) estimulou o desenvolvimento de abordagens de entrega de amostras de RT 1,2,3,4, e esses métodos têm sido aplicados a síncrotrons 5,6,7,8. Não só os métodos de RT abrem a possibilidade de estrangulamentos experimentais bomba-sonda 9,10,11,12, mas também há evidências crescentes de que eles promovem estados conformacionais alternativos dentro das proteínas 13,14,15,16,17.
No entanto, a principal razão pela qual os criométodos ganharam força sobre as abordagens de RT no final da década de 1990 foi a desaceleração dos danos da radiação por temperaturas cristalinas abaixo de zero18. O criométodo19 começou a permitir a coleta de um conjunto completo de dados a partir de um único cristal de proteína. Métodos modernos de RT em XFELs e síncrotrons resolveram o problema dos danos por radiação monocristalina através do desenvolvimento de estratégias rápidas de liberação de cristais (> 100 Hz) 1,2,3,4. Esses métodos permitem a coleta de um conjunto de dados completo a partir de milhares de cristais expostos individualmente. Essas abordagens de entrega de RT requerem, portanto, a produção de grandes quantidades de soluções contendo microcristais homogêneos (> 100 μL de < cristais de 50 μm). No entanto, como os criométodos tendem a exigir apenas cristais individuais, os métodos para criar tais polpas microcristalinas não são atualmente onipresentes nos laboratórios de cristalografia de proteínas.
Existem exemplos na literatura de como realizar partes do procedimento de otimização da microcristalização para amostras seriadas de cristalografia. Aqui, deve-se fazer uma distinção entre proteínas de membrana e proteínas solúveis. Protocolos para otimizar o crescimento de cristais de proteína de micromembrana cultivados em monooleína (ou algum outro lipídio), para fase cúbica lipídica (LCP), têm sido bem descritos20,21,22. No entanto, métodos para a microcristalização de proteínas solúveis, incluindo proteínas de membrana cultivadas em condições não-LCP, são geralmente escassos. Estudos anteriores focaram em partes específicas do processo, como a triagem de microcristais 23,24, o aumento da nucleação 24 e a escala usando difusão em interface livre 25, mas não um método completo.
No entanto, recentemente foi descritoum método 26 que tenta oferecer um protocolo completo. Como muitos aspectos da cristalografia de proteínas, ela não é nova. Muitas das ideias propostas já foram descritas por Rayment (2002)27. O método visa mostrar aos cristalógrafos como realizar a conversão de um único cristal cultivado usando difusão de vapor, para uma metodologia em batelada para cultivar milhares de microcristais. O método enfoca a difusão de vapor como um ponto de partida comum, já que 95% de todas as deposições do Protein Data Bank (PDB) provêm de cristais crescidos em placas de difusão de vapor26. A difusão de vapor não é, no entanto, o método ideal para microcristalização26, por isso é descrita uma metodologia para converter a difusão de vapor em cristalização em batelada. Uma vez que os cristais podem ser cultivados em lote, as rotas de escala para volumes maiores tornam-se mais viáveis. Dado os caprichos da cristalização de proteínas, os autores enfatizam que este método não é à prova de falhas. No entanto, o protocolo deve, pelo menos, fornecer uma visão sobre o “espaço de cristalização” de uma proteína.
Este método baseia-se no diagrama de fase de cristalização de proteínas e em como a compreensão desse diagrama pode atuar como um guia durante a otimização da microcristalização. Um diagrama de fase de proteína é comumente representado como um gráfico x/y com concentrações precipitantes e proteicas nos eixos x e y, respectivamente (Figura 1A). A partir do ponto de água pura (canto inferior esquerdo – Figura 1A), a concentração de proteína e precipitante aumenta até atingir a linha de solubilidade. A linha de solubilidade marca o ponto de supersaturação (linha roxa – Figura 1A). Quando uma proteína é supersaturada, a solução torna-se termodinamicamente instável e começará a separar-se em duas fases: “rica em proteínas” e uma solução saturada estável. Essa separação pode ocorrer em qualquer lugar além da linha de solubilidade e sua cinética depende das propriedades da proteína e dos componentes da solução.
Quando as concentrações de proteína e precipitante são muito grandes, a proteína se decompõe de forma instável fora da solução e resulta em precipitado amorfo (região rósea – Figura 1A). No entanto, a separação ordenada de fases pode ocorrer na região de nucleação [ver Garcia-Ruiz (2003)28 para descrição detalhada] e os nucleantes cristalinos têm propensão a se formar (região verde – Figura 1A). A nucleação e o crescimento removem a proteína da solução e movem a gota para a região metaestável, onde o crescimento pode continuar até que a linha de solubilidade seja atingida [ver McPherson e Kuznetsov (2014)29 para discussão detalhada]. O diagrama é, para a grande maioria das condições de cristalização, uma simplificação grosseira30. Apesar disso, no entanto, o diagrama ainda é de grande utilidade para os microcristalógrafos, pois o mapeamento do diagrama permite determinar a linha de solubilidade e a cinética de nucleação.
Em termos de criação de microcristais, os dois fatores durante a cristalização que precisam ser otimizados são o número de cristais (Xn) e sua dimensão média e mais longa (Xs). X n será proporcional ao número de eventos de nucleação (n ) (Eq. 1).
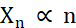 Eq. 1
Eq. 1
X s é proporcional à concentração de proteína livre acima da linha de solubilidade (Ps) dividida por Xn (Eq. 2).
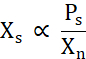 Eq. 2
Eq. 2
Em uma situação perfeita, cada evento de nucleação produziria um cristal possível e cada um desses cristais, teria igual acesso à proteína disponível em solução. A Figura 2 é uma representação gráfica de um cenário ideal da relação entre Xn e Xs. Na prática, o principal controle que um cristalógrafo tem sobre Xn e Xs é influenciando a quantidade de nucleação ou pela adição de cristais de sementes. O microcristalógrafo deve julgar como aumentar Xn de tal forma que uma concentração de cristal adequada e tamanho de cristal possam ser criados.
A maioria das técnicas de cristalização requer um “período de transição” (Figura 1B). Por exemplo, em um experimento de difusão de vapor, ao misturar a proteína e as soluções precipitantes, as concentrações de cada uma mudam à medida que a gota se equilibra com a solução do poço. Espera-se que essas mudanças façam a transição gradual da queda para a zona de nucleação, onde a propensão para cristalização aumentará. À medida que os cristais começam a se nuclear e crescem, a quantidade de proteína em solução começará a cair, diminuindo a probabilidade de nucleação adicional. A quantidade final de nucleação será específica da proteína e da condição, e também dependente da profundidade de penetração na zona de nucleação. Dada a penetração limitada da zona de nucleação de métodos que requerem uma etapa de transição, o nível de nucleação será limitado à taxa de nucleação no limite da região de nucleação metaestável.
Devido à importância de ser capaz de aumentar o nível de nucleação para um microcristalógrafo, é importante passar para uma metodologia de cristalização em batelada. O lote pode aproveitar melhor toda a região de nucleação (Figura 1C). Em métodos em batelada, a ideia é misturar a proteína e o precipitante de forma que uma solução supersaturada seja criada sem a necessidade de mudanças nas concentrações dos componentes. A nucleação deve ser possível imediatamente após a mistura. Os métodos em lote permitem, portanto, que toda a zona de nucleação seja teoricamente atingida. Qualquer aumento na cinética de nucleação além do limite de nucleação metaestável pode então ser utilizado.
Se o nível basal de nucleação de cristais não for suficiente para gerar um Xn grande, métodos de micro-semeadura podem ser usados. Na micro-semeadura, cristais pré-cultivados são quebrados para criar uma lama de fragmentos cristalinos que podem atuar como arcabouço para o crescimento de cristais frescos31,32. A microsemeadura tem sido amplamente utilizada na preparação seriada de amostras cristalográficas como forma de aumentar Xn sem a necessidade de aumentar a nucleação de cristais (Figura 1C).
A transição da difusão de vapor para a batelada pode ser visualizada em um diagrama de fases como movendo o ponto de partida experimental das regiões não supersaturadas ou metaestáveis para a zona de nucleação. Isso pode ser feito aumentando-se as concentrações de proteínas e/ou precipitantes e/ou a relação dos dois dentro da gota (Figura 1D), observando-se em quais condições os cristais aparecem rapidamente (< 24 h)26. O equilíbrio completo da gota de difusão do vapor pode levar dias ou semanas33. Portanto, ao procurar condições que mostrem cristais aparecendo rapidamente, condições de lote podem ser encontradas sem ter que passar para formatos alternativos de triagem de cristalização, como micro-lote34,35,36,37.
Uma vez que a zona de nucleação foi encontrada, uma condição de lote foi encontrada e um morfograma – aqui, um diagrama de fase aproximado – pode ser criado. O morfograma é de grande utilidade quando se pensa em utilizar um protocolo de batelada semeada ou batelada reta. Plotando o Xn em função da proteína e da concentração precipitante, pode-se avaliar a cinética de nucleação26. Se X n permanecer baixo em toda a região de nucleação, o lote semeado pode ser necessário para tornar Xn grande o suficiente para limitar o crescimento de cristais. Essa avaliação é o primeiro passo no processo de escalonamento para volumes maiores (> 100 μL).
Este método foi projetado de tal forma que pudesse ser conduzido na maioria dos laboratórios de cristalização usando equipamento padrão de cristalização por difusão de vapor. Muitos estudos também têm sido realizados descrevendo técnicas para facilitar muitas partes desse processo, caso o equipamento esteja disponível. Estes incluem, mas não estão limitados a, espalhamento dinâmico de luz (DLS)25,27, imagem não-linear 20,24,25, difração de pó 20,24,27 e microscopia eletrônica 26 [ver Cheng et al. (2020)40 para uma bela revisão].
O objetivo deste trabalho é fornecer uma demonstração visual do método de transição da cristalização por difusão de vapor de pequeno volume ( de 100 μL). A endotiapepsina de Cryphonectria parasitica tem sido usada como um sistema de exemplo para demonstrar essa tradução. O tipo de experimento e o método de entrega da amostra para os quais os microcristais são necessários influenciarão a saída idealde X s 26. Para experimentos de mistura que requerem uma resolução de tempo de milissegundos41 ou bicos virtuaisdinâmicos a gás42, um X s final de < 5 μm pode ser desejável. Neste caso, o objetivo era produzir cristais de proteína que difratassem a aproximadamente 1,5 Å, para um experimento de bomba-sonda ativada por fótons, e usando uma abordagem de entrega de alvo fixo.
Para ilustrar as necessidades amostrais de um experimento de cristalografia seriado usando endotiapsina, a Tabela 1 mostra os parâmetros experimentais de um experimento hipotético. As informações da amostra foram baseadas no protocolo descrito a seguir. Dadas algumas estimativas conservadoras sobre as taxas de acerto e os requisitos de coleta de dados, 50 mg é a estimativa do consumo total da amostra para todo o experimento.
A Figura 3 mostra um fluxograma do processo completo de otimização, desde a cristalização inicial por difusão de vapor de pequeno volume até o lote em grande escala. Para a maioria dos projetos de cristalografia seriada, este protocolo começará na Etapa 2: ‘transição para lote’, uma vez que a proteína alvo já terá sido cristalizada. No entanto, o Passo 1 foi incluído para completude e para lembrar os leitores de sua importância. Encontrar uma condição que dê origem a um cristal bem difratante, único e grande é o melhor ponto de partida para a otimização de microcristais. Na Etapa 2, essa condição pode então ser otimizada da difusão de vapor para batelada, e um morfograma das regiões de nucleação e metaestável pode ser plotado. Feito isso, o dimensionamento da condição de lote para volumes maiores pode ser executado na Etapa 3. Ao final do fluxograma, um cristalógrafo terá criado um protocolo de microcristalização repetível, de grande volume (> de 100 μL), de microcristalização, em lote para endotiapsina. Este método pode então ser aplicado à sua proteína particular de interesse.
Protocol
Representative Results
Discussion
O método apresentado mostra como otimizar a cristalização da endotiapepsina de grandes cristais (≥ 100 μm de maior dimensão), cultivados em telas de matriz esparsa de 96 poços, para microcristais, cultivados em tubos de centrífuga (volume de 300 μL) via batelada. A ideia por trás do protocolo é que as etapas tomadas para otimizar a endotiapepsina também possam ser usadas para outras proteínas. Em última análise, respondendo ao problema de criar grandes volumes (>100 μL) de micro-cristais (10-20 μm) para experimentos de cristalografia seriada em XFELs e síncrotrons.
O protocolo divide a tarefa de microcristalização de grandes volumes em três etapas: (1) Otimização da morfologia cristalina, (2) Transição para lote e (3) Dimensionamento. Na Etapa 1, a gama de formas cristalinas que uma proteína pode criar deve ser explorada em placas de difusão de vapor. Condições que dão origem a cristais únicos, semelhantes a caixas, que difratizam para a resolução requerida devem ser o objetivo. Na Etapa 2, as condições selecionadas podem então ser transformadas da difusão de vapor em batelada. Aqui, o critério de otimização é o tempo de crescimento dos cristais e encontrar condições que dão origem aos cristais de proteína dentro de 24 h. Um morfograma também pode ser plotado dando ao experimentador uma ideia da localização da linha de solubilidade e limites da zona de nucleação. Este morfograma é de grande utilidade na Etapa 3, Escala. O morfograma dará uma indicação de se a nucleação sozinha pode aumentar Xn e reduzir Xs. À medida que o volume do experimento é aumentado, Xn e Xs podem ser continuamente avaliados como os principais critérios de sucesso de escala.
No caso da endotiapsina, o passo 1 desenterrou o que potencialmente era uma morfologia cristalina até então desconhecida para a endotiapsina. Essa morfologia tinha o mesmo grupo espacial que os relatados anteriormente, mas, importante para a cristalografia serial, uma forma mais parecida com uma caixa. Monocristais também pareciam crescer a partir de pontos de nucleação únicos, ao contrário dos leques criados a partir de outras condições (Figura 4). Para a condição selecionada, o Passo 2 já estava parcialmente satisfeito, pois o crescimento dos cristais ocorreu em < de 24 h. O morfograma indicou que um protocolo de batelada reta ou semeado pode ser bem-sucedido ao escalar na Etapa 3. A escala inicial, em lote reto, criou uma condição que produziu cristais com uma faixade Xn e X s de 3,6 ± 1,2 x 106 cristais·mL-1 e 42 ± 4,1 μm, respectivamente. Esses cristais, embora aceitáveis para alguns experimentos seriados de cristalografia, foram considerados muito grandes. Assim, otimizações adicionais foram realizadas. O protocolo final produziu cristais com uma faixa de concentração e tamanho de 3,1 x 106 cristais·mL-1 e 15 ± 3,9 μm, respectivamente. Isso foi mais do que ideal para os experimentos planejados.
O método se concentra na transformação de cristais de proteína “solúveis” cultivados em placas de difusão de vapor em batelada. A razão para esse foco é que a grande maioria dos cristais de proteínas solúveis é cultivada via difusão de vapor26. No entanto, os conceitos apresentados também podem ser aplicados a cristais de proteína solúvel cultivados usando outros métodos, como micro-batelada. Os conceitos também podem ser aplicáveis a cristais de proteína de membrana cultivados em LCP; pois este também é um processo de cristalização em batelada.
Um aspecto chave do protocolo é o processo de transformação das condições dos cristais crescidos em placas de difusão de vapor para que possam ser cultivados em batelada. Para essa transformação, o método utiliza o critério proposto por Beale e colaboradores (2019)26. Cristais crescidos através de um processo em batelada, mesmo em placas de difusão de vapor, se formarão rapidamente (< 24 h). Este critério é uma aproximação baseada na velocidade de equilíbrio da gota de difusão de vapor, e é mais verdadeiro para condições precipitantes baseadas em PEG. No entanto, as condições de cristalização conterão uma grande variedade de compostos que influenciarão o tempo de equilíbrio. O equilíbrio das condições de cristalização à base de sal, por exemplo, cloreto de amônio altamente concentrado, pode acontecer em 1-2 dias. Portanto, o critério de 24 h pode não ser verdadeiro para condições à base de sal. Condições à base de sal também podem apresentar diagramas de fases mais complexos26,30 que podem não estar de acordo com o arquétipo apresentado neste protocolo. Pode ser necessária uma redução do critério de tempo para condições à base de sal para 12 ou 6 h se a escala em volumes maiores se revelar impossível.
Outra limitação desse método é sua aparente complexidade. O protocolo seguido para otimizar a microcristalização da endotiapepsina realmente mudou relativamente pouco a condição original da tela de matriz esparsa. O primeiro acerto observado na tela PACT foi de 0,1 HEPES pH 7,0, 0,2 M MgCl2 e 20% (p/v) PEG 6.000. O tampão de cristalização escalonado final foi 0,1 Tris-HCl pH 7,0, 0,15 M MgCl2 e 40% (p/v) PEG 6.000. Também é muito possível que a mudança no tampão de HEPES para Tris-HCl, e a concentração de MgCl2 , tenham contribuído pouco para o sucesso do processo. Deixando o aumento na concentração de PEG 6.000 a única otimização, e que poderia ter sido alcançada de forma bem simples.
No entanto, esta avaliação é também demasiado simplista. Ele não apenas desconta os problemas encontrados durante o escalonamento (ou seja , o uso de sementes e têmpera), mas também o fato de que só porque essa proteína se mostrou simples, não há garantia de que a próxima também se provará ser. As etapas aconselhadas no protocolo, foram concebidas porque otimizar a escala de volumes de cristalização de proteínas pode ser muito caro para proteínas. Ao longo dos sete ensaios de escalonamento de endotiapsina que são mostrados, 100 mg de proteína foram consumidos. É certo que algumas dessas etapas foram realizadas para mostrar suas consequências à luz desse protocolo. Mesmo assim, 100 mg de uma proteína, mais potencialmente mais 50 mg de proteína consumida durante um experimento (Tabela 1), podem ser um investimento significativo em tempo ou dinheiro.
Felizmente, não está claro se essa massa de amostra necessária é onipresente em todas as proteínas. A endotiapepsina era altamente solúvel e, portanto, necessitava de uma grande concentração de proteínas para atingir a supersaturação. Em outros (atualmente em fase de otimização), a supersaturação pode ser alcançada em 10 ou até 5 mg/mL. Tais variáveis são específicas de proteínas e precisam ser abraçadas quando aparecem.
Outras limitações do método incluem sua dependência de equipamentos complexos, como robôs de manuseio de líquidos para a criação de telas e placas, e imageadores para criar imagens automáticas de placas quando necessário. Rotinas alternativas têm sido oferecidas para limitar a necessidade de alguns desses equipamentos, mas o protocolo será mais demorado de ser seguido sem eles. O protocolo também sugere testar a difração de cristais otimizados. Para cristalógrafos sem acesso regular a um síncrotron, esses testes podem ser desafiadores. Controles em cada etapa podem não ser necessários, mas esses testes são altamente recomendados uma vez que um acerto tenha sido identificado, e pré e pós-escala. Cristais não difratantes em um XFEL não são, infelizmente, uma ocorrência incomum. Diante disso, é melhor errar do lado da cautela em relação às suposições sobre a difração de cristais.
Em última análise, este protocolo e os resultados apresentados aqui oferecerão um guia, ideias e um exemplo para aqueles que lutam com a produção de amostras para experimentos de cristalografia seriada. Espera-se que, à medida que a cristalografia seriada for mais desenvolvida, as demandas de amostra da técnica sejam reduzidas de tal forma que a necessidade de protocolos como este seja reduzida. No entanto, mesmo neste evento, as estratégias aqui apresentadas ainda serão úteis para aqueles que desejam explorar o espaço de cristalização de sua proteína.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este projeto recebeu financiamento do programa de investigação e inovação Horizonte 2020 da União Europeia ao abrigo do acordo de subvenção Marie Skłodowska-Curie n.º 701647. Muito obrigado pela assistência e apoio dos cientistas da linha de luz da linha de luz suíça X10SA-PXII.
Materials
| Swissci 96-well 2-Drop plates | Molecular Dimensions | MD11-002 | 96-well 2-drop crystallisation plate |
| Swissci 96-well 3-Drop plates | Molecular Dimensions | MD11-003 | 96-well 3-drop crystallisation plate |
| mosquito LCP liquid handling robot | sptlabtech | mosquito LCP | Crystallisation robot |
| ClearVue Sheets | Molecular Dimensions | MD6-015 | 96-well crystallization plate seals |
| Safe-Tube 1.5 mL | Eppendorf | 30120086 | 1.5 mL centrifuge tubes |
| Scaple | Swan and Morton | No. 3 scalple and No. 3 handle | Scalple for cutting open plate seals |
| MS 3 Vortex | IKA | 3319000 | Vortex for mixing solution and making seed stocks |
| 24-well XRL Plate | Molecular Dimensions | MD3-11 | 24-well hanging-drop plates |
| Tube revolver/rotator | Thermo Fischer Scientific | 88881001 | Tube revolver for mixing solution during scaling |
| Eppendorf Research plus pipettes | Eppendorf | Range of manual pipettes, 0.5-10, 1-20, 10-100, 100-1000 µL | |
| Eppendorf pipette tips | Eppendorf | Range of tip sizes for manual pipettes | |
| Suparen 600 | Prochem AG | Suparen 600 | Endothiapepsin solution |
| Sodium Acetate | Sigma-Aldrich | 241245-1KG | Sodium Acetate |
| Tris | Merck | 8382T014 | Tris |
| Magnesium Chloride | Sigma-Aldrich | M2670-1kg | Magnesium Chloride |
| PEG 6,000 | Sigma-Aldrich | 81255-1kg | PEG 6,000 |
| Ethelyene glycol | Sigma-Aldrich | 324558-1L | Ethelyene glycol for cyro-protecting the crystals |
| PACT Premier HT screen | Molecular Dimensions | MD1-36 | PACT Premier 96-well crystal screen |
| DOW CORNING high vacuum grease | Molecular Dimensions | MD6-02 | Grease for sealing 24-well plates |
| Hirschmann 22 x 22 mm glaser cover slides | Hirschmann | 8000104 | Cover slides for sealing 24-well sitting drop plates |
| Crystal pins | PSI | Manufactured inhouse | Thin-film supports for micro-crystals. |
| 1-1.3 mm SiLibeads Type S | Faust | 6239547 | Glass beads for making mico-seed stocks |
| Macbook Pro | Apple | Macbook Pro | Computer for performing data analysis |
| CCP4 software suite | CCP4 | Diffraction pattern data processing software | |
| Excel | Microsoft | Microsoft Office | Plotting tool for phase diagram |
| Hausser Scientific Bright-Line counting chamber | Thermo Fischer Scientific | 02-671-51B | Tool to calculate crystal concentration |
| PACT Premier | Molecular Dimensions | MD1-29-ECO | Sparse-matrix crystallization screen |
| Rock Imager | Formulatrix | Rock Imager | Temperature controlled crystal plate storage and imager |
| Rock MakerWeb | Formulatrix | Rock MakerWeb | Crystal plate creation and image storage stoftware |
| Formulator | Formulatrix | Formulator | 96-well crystal screen creation liquid handling robot |
| Leica MZ16 Microscope | Leica | Leica MZ16 | Light microscope |
| LAS V4.6 | Leica | LAS V4.6 | Software for Leica microscopes |
| Spectra/Por 3.5 kDa dialysis tubing | Spectrumlabs | Spectra/Por 3 Dialysis Membrane | 3.5 kDa dialysis membrane |
| Dialysis tubing closures | Spectrumlabs | Spectra/Por 3 Duniversal Closures | Clips to seal the dialysis tubing ends |
| Amicon 10 kDa centrifugal concentrator | Merck-Millipore | Amicon Ultra-15 10 kDa centrifugal concentrator | 10 kDa centrifugal filter |
| 5810 R swing bucket centrifuge | Eppendorf | 5810 R Centrifuge | Swing bucket centrifuge |
References
- DePonte, D. P., et al. Gas dynamic virtual nozzle for generation of microscopic droplet streams. Journal of Physics D: Applied Physics. 41 (19), 195505 (2008).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Scientific Reports. 4 (1), 6026 (2014).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature Communications. 5 (1), 1-6 (2014).
- Roessler, C. G. G., et al. Acoustic Injectors for Drop-On-Demand Serial Femtosecond Crystallography. Structure. 24 (4), 631-640 (2016).
- Sherrell, D. A., et al. A modular and compact portable mini-endstation for high-precision, high-speed fixed target serial crystallography at FEL and synchrotron sources. Journal of Synchrotron Radiation. 22 (6), 1372-1378 (2015).
- Roedig, P., et al. A micro-patterned silicon chip as sample holder for macromolecular crystallography experiments with minimal background scattering. Scientific Reports. 5 (1), 1-11 (2015).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Nango, E., et al. A three-dimensionalmovie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Halle, B. Biomolecular cryocrystallography: structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Fraser, J. S., et al. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Fenwick, R. B., van den Bedem, H., Fraser, J. S., Wright, P. E. Integrated description of protein dynamics from room-temperature X-ray crystallography and NMR. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 445-454 (2014).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. Elife. 4, (2015).
- Thomaston, J. L., et al. XFEL structures of the influenza M2 proton channel: Room temperature water networks and insights into proton conduction. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 13357-13362 (2017).
- Haas, D. J., Rossmann, M. G. Crystallographic studies on lactate dehydrogenase at -75 °C. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26 (7), 998-1004 (1970).
- Hope, H. Cryocrystallography of biological macromolecules: a generally applicable method. Acta Crystallographica Section B Structural Science. 44 (1), 22-26 (1988).
- Wu, W., et al. Batch crystallization of rhodopsin for structural dynamics using an X-ray free-electron laser. Acta Crystallographica Section:F Structural Biology Communications. 71 (7), 856-860 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and delivery of protein microcrystals in lipidic cubic phase for serial femtosecond crystallography. Journal of Visualized Experiments. (115), e54463 (2016).
- Andersson, R., et al. Well-based crystallization of lipidic cubic phase microcrystals for serial X-ray crystallography experiments. Acta Crystallographica Section D: Structural Biology. 75 (10), 937-946 (2019).
- Luft, J. R., et al. The detection and subsequent volume optimization of biological nanocrystals. Structural Dynamics. 2 (4), 041710 (2015).
- Lee, D. B., et al. Supersaturation-controlled microcrystallization and visualization analysis for serial femtosecond crystallography. Scientific Reports. 8 (1), 1-10 (2018).
- Kupitz, C., et al. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1647), 20130316 (2014).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Rayment, I. Small-scale batch crystallization of proteins revisited: An underutilized way to grow large protein crystals. Structure. 10 (2), 147-151 (2002).
- García-Ruiz, J. M. Nucleation of protein crystals. Journal of Structural Biology. 142 (1), 22-31 (2003).
- McPherson, A., Kuznetsov, Y. G. Mechanisms, kinetics, impurities and defects: Consequences in macromolecular crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (4), 384-403 (2014).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta crystallographica. Section F, Structural biology communications. 71, 247-260 (2015).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D Biological Crystallography. 55 (5), 988-993 (1999).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta crystallographica. Section D, Biological crystallography. 60 (3), 601-605 (2004).
- Forsythe, E. L., Maxwell, D. L., Pusey, M. Vapor diffusion, nucleation rates and the reservoir to crystallization volume ratio. Acta Crystallographica Section D Biological Crystallography. 58 (10), 1601-1605 (2002).
- Chayen, N. E., Shaw Stewart, P. D., Maeder, D. L., Blow, D. M. IUCr An automated system for micro-batch protein crystallization and screening. Journal of Applied Crystallography. 23 (4), 297-302 (1990).
- Chayen, N. E., Shaw Stewart, P. D., Blow, D. M. Microbatch crystallization under oil – a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Chayen, N. E. Comparative studies of protein crystallization by vapour-diffusion and microbatch techniques. Acta Crystallographica Section D: Biological Crystallography. 54 (1), 8-15 (1998).
- D’Arcy, A., Mac Sweeney, A., Stihle, M., Haber, A. The advantages of using a modified microbatch method for rapid screening of protein crystallization conditions. Acta Crystallographica – Section D Biological Crystallography. 59 (2), 396-399 (2003).
- Darmanin, C., et al. Protein crystal screening and characterization for serial femtosecond nanocrystallography. Scientific Reports. 6, 25345 (2016).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2247-2252 (2017).
- Cheng, R. K. Y. Towards an optimal sample delivery method for serial crystallography at XFEL. Crystals. 10 (3), 215 (2020).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. 2013, 1-10 (2013).
- Oberthuer, D., et al. Double-flow focused liquid injector for efficient serial femtosecond crystallography. Scientific Reports. 7 (1), 44628 (2017).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- Yaoi, M., et al. Effect of stirring method on protein crystallization. Japanese Journal of Applied Physics, Part 2: Letters. 43 (10), 1318 (2004).
- Castro, F., Ferreira, A., Teixeira, J. J., Rocha, F. Influence of Mixing Intensity on Lysozyme Crystallization in a Meso Oscillatory Flow Reactor. Crystal Growth & Design. 18 (10), 5940-5946 (2018).
- Moews, P. C., Bunn, C. W. An X-ray crystallographic study of the rennin-like enzyme of Endothia parasitica. Journal of Molecular Biology. 54 (2), 395-397 (1970).
- Newman, J., et al. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta crystallographica. Section D, Biological. 61, 1426-1431 (2005).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D Structural Biology. 75, 151-159 (2019).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), (2019).

