Visualizzazione e quantificazione della segnalazione TGFβ/BMP/SMAD in diverse condizioni di sforzo di taglio del fluido utilizzando il test di prossimità-legatura
Summary
Qui, stabiliamo un protocollo per visualizzare e analizzare simultaneamente più complessi SMAD utilizzando il test di legatura di prossimità (PLA) in cellule endoteliali esposte a condizioni patologiche e fisiologiche di stress da taglio del fluido.
Abstract
La segnalazione del fattore di crescita trasformante β (TGFβ) / proteina morfogenetica ossea (BMP) è strettamente regolata ed equilibrata durante lo sviluppo e l’omeostasi del sistema vascolare Pertanto, la deregolazione in questa via di segnalazione provoca gravi patologie vascolari, come l’ipertensione dell’arteria polmonare, la teleangectasia emorragica ereditaria e l’aterosclerosi. Le cellule endoteliali (CE), come strato più interno dei vasi sanguigni, sono costantemente esposte allo stress da taglio fluido (SS). Modelli anormali di SS fluida hanno dimostrato di migliorare la segnalazione TGFβ / BMP, che, insieme ad altri stimoli, induce l’aterogenesi. In relazione a questo, l’ateroprone, SS a basso laminare è stato trovato per migliorare la segnalazione TGFβ / BMP mentre l’ateroprotettivo, SS laminare elevato, diminuisce questa segnalazione. Per analizzare in modo efficiente l’attivazione di questi percorsi, abbiamo progettato un flusso di lavoro per studiare la formazione di complessi di fattori di trascrizione in condizioni di SS a basso laminare e SS laminare elevato utilizzando un sistema di pompe pneumatiche disponibile in commercio e un test di legatura di prossimità (PLA).
La segnalazione attiva TGFβ/BMP richiede la formazione di complessi trimerici SMAD costituiti da due SMED regolatori (R-SMAD); SMAD2/3 e SMAD1/5/8 per la segnalazione TGFβ e BMP, rispettivamente) con un mediatore comune SMAD (co-SMAD; SMAD4). Utilizzando il PLA mirato a diverse subunità del complesso trimerico SMAD, cioè R-SMAD / co-SMAD o R-SMAD / R-SMAD, la formazione di complessi di fattori di trascrizione SMAD attivi può essere misurata quantitativamente e spazialmente utilizzando la microscopia a fluorescenza.
L’utilizzo di guide di flusso con 6 piccoli canali paralleli, collegabili in serie, consente di studiare la formazione complessa del fattore di trascrizione e di inserire i necessari controlli.
Il flusso di lavoro qui spiegato può essere facilmente adattato per studi mirati alla vicinanza degli SMED ad altri fattori di trascrizione o a complessi di fattori di trascrizione diversi dagli SMAD, in diverse condizioni di SS fluida. Il flusso di lavoro qui presentato mostra un modo rapido ed efficace per studiare la segnalazione TGFβ/BMP indotta da SS fluidi nelle CE, sia quantitativamente che spazialmente.
Introduction
Le proteine della superfamiglia dei fattori di crescita trasformanti beta (TGFβ) sono citochine pleiotropiche con una varietà di membri, tra cui TGFβs, proteine morfogenetiche ossee (BMP) e Activins1,2. Il legame del ligando induce la formazione di oligomeri recettoriali che portano alla fosforilazione e, quindi, all’attivazione dello SMAD citosolico regolatorio (R-SMAD). A seconda della sottofamiglia di ligandi, vengono attivati diversi R-SED1,2. Mentre TGFβs e Activins inducono principalmente fosforilazione di SMAD2/3, BMP inducono fosforilazione SMAD1/5/8. Tuttavia, ci sono prove crescenti che BMP e TGFβs / Activins attivano anche R-SMAD della rispettiva altra sottofamiglia, in un processo definito come “segnalazione laterale” 3,4,5,6,7,8 e che esistono complessi SMAD misti costituiti da entrambi, SMAD1/5 e SMAD2/3, members3,9 . Due R-SMAD attivati formano successivamente complessi trimerici con il mediatore comune SMAD4. Questi complessi di fattori di trascrizione sono quindi in grado di traslocare nel nucleo e regolare la trascrizione dei geni bersaglio. Gli SED possono interagire con una varietà di diversi co-attivatori e co-repressori trascrizionali, portando alla diversificazione delle possibilità di regolare i geni bersaglio10. La deregolamentazione della segnalazione SMAD ha gravi implicazioni in una varietà di malattie. In linea con questo, la segnalazione Squilibrata di TGFβ/BMP può portare a gravi patologie vascolari, come ipertensione dell’arteria polmonare, teleangectasia emorragica ereditaria o aterosclerosi3,11,12,13,14.
Le cellule endoteliali (CE) formano lo strato più interno dei vasi sanguigni e sono, quindi, esposte allo stress da taglio (SS), una forza di attrito esercitata dal flusso viscoso del sangue. È interessante notare che le CE che risiedono nelle parti della vascolarizzazione, che sono esposte ad alti livelli di SS uniforme e laminare, sono mantenute in uno stato omeostatico e quiescente. Al contrario, le CE che sperimentano SS basse e non uniformi, ad esempio a biforcazioni o la minore curvatura dell’arco aortico, sono proliferative e attivano le vie infiammatorie15. A loro volta, i siti di EC disfunzionali sono inclini a sviluppare aterosclerosi. È interessante notare che gli EC in queste aree di ateropatrone mostrano livelli aberrantemente elevati di SMAD2/3 e SMAD1/516,17,18 attivati. In questo contesto, la segnalazione TGFβ/BMP potenziata è risultata essere un evento precoce nello sviluppo di lesioni aterosclerotiche19 e l’interferenza con la segnalazione BMP è risultata ridurre notevolmente l’infiammazione vascolare, la formazione di ateroma e la calcificazione associata20.
Proximity Ligation Assay (PLA) è una tecnica biochimica per studiare le interazioni proteina-proteina in situ21,22. Si basa sulla specificità di anticorpi di diverse specie che possono legare proteine bersaglio di interesse, consentendo il rilevamento altamente specifico di interazioni proteiche endogene a livello di singola cellula. Qui, gli anticorpi primari devono legarsi al loro epitopo bersaglio a una distanza inferiore a 40 nm per consentire il rilevamento23. Pertanto, il PLA è molto utile rispetto ai tradizionali approcci di co-immunoprecipitazione, in cui sono necessari diversi milioni di cellule per rilevare le interazioni proteiche endogene. Nel PLA, gli anticorpi secondari specie-specifici, legati covalentemente ai frammenti di DNA (chiamati sonde Plus e Minus), legano gli anticorpi primari e se le proteine di interesse interagiscono, le sonde Plus e Minus si avvicinano. Il DNA viene legato nella fase successiva e l’amplificazione del cerchio rotolante del DNA circolare è resa possibile. Durante l’amplificazione, oligonucleotidi complementari marcati fluorescenti si legano al DNA sintetizzato, consentendo a queste interazioni proteiche di essere visualizzate mediante microscopia a fluorescenza convenzionale.
Il protocollo qui descritto consente agli scienziati di confrontare quantitativamente il numero di complessi di trascrizione SMAD attivi in condizioni ateroprotettive e ateroprotroniche SS in vitro utilizzando PLA. SS è generato tramite un sistema di pompe pneumatiche programmabili che è in grado di generare flusso unidirezionale laminare di livelli definiti e consente aumenti graduali delle portate. Questo metodo consente il rilevamento di interazioni tra SMAD1/5 o SMAD2/3 con SMAD4, nonché complessi misti-R-SMAD. Può essere facilmente espanso per analizzare le interazioni degli SMAD con i co-regolatori trascrizionali o con complessi di fattori di trascrizione diversi dagli SMAD. La Figura 1 mostra i passaggi principali del protocollo presentati di seguito.
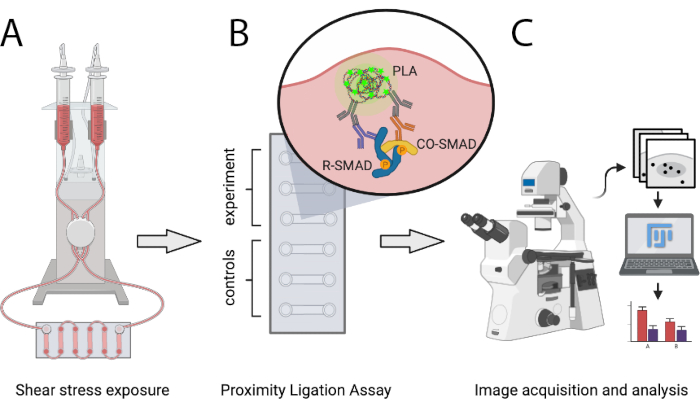
Figura 1: Rappresentazione schematica del protocollo descritto. (A) Le celle seminate in vetrini a 6 canali sono esposte a sollecitazioni di taglio con un sistema di pompe pneumatiche. (B) Le celle fisse sono utilizzate per esperimenti PLA o per condizioni di controllo. (C) Le immagini degli esperimenti PLA vengono acquisite con un microscopio a fluorescenza e vengono analizzate utilizzando il software di analisi ImageJ. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il protocollo basato sul PLA qui descritto offre un modo efficiente per determinare la stretta vicinanza di due proteine (ad esempio, la loro interazione diretta) nelle CE esposte allo stress di taglio con risoluzione quantitativa e spaziale. Utilizzando diapositive di flusso con più canali paralleli, diverse interazioni proteiche possono essere esaminate contemporaneamente in cellule in condizioni meccaniche identiche. Al contrario, i sistemi di camere di flusso costruiti su misura spesso utilizzano un singolo canale c…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ringraziamo la dott.ssa Maria Reichenbach e il dott. Christian Hiepen per il loro supporto sul sistema di impostazione del flusso e Eleanor Fox e Yunyun Xiao per aver letto criticamente il manoscritto. P-L.M. è stato finanziato dalla Scuola di Ricerca internazionale Max Planck IMPRS-Biology and Computation (IMPRS-BAC). PK ha ricevuto finanziamenti dal DFG-SFB1444. La Figura 1 è stata creata utilizzando BioRender.
Materials
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
References
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557 (2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756 (2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T., Dijke, P. T., Heldin, C. -. H. . Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. , 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989 (2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980 (2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58 (2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012)
- Application Note 13: HUVECs under perfusion. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019)
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051 (2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965 (2020).

