Visualização e Quantificação de TGFβ/BMP/SMAD Sinalizando em diferentes condições de estresse da tesoura de fluidos usando o ensaio de proximidade-ligação-assay
Summary
Aqui, estabelecemos um protocolo para visualizar e analisar simultaneamente múltiplos complexos de SMAD utilizando o ensaio de ligadura de proximidade (PLA) em células endoteliais expostas a condições patológicas e fisiológicas de estresse da tesoura de fluidos.
Abstract
Transformando fator de crescimento β (TGFβ)/Proteína Morfogenética Óssea (BMP) a sinalização é fortemente regulada e equilibrada durante o desenvolvimento e homeostase do sistema de vasculatura Portanto, a desregulamentação nesta via de sinalização resulta em patologias vasculares graves, como hipertensão arterial pulmonar, hemorrha pneumética hereditária e atherosclerosis. As células endoteliais (CE), como a camada mais interna dos vasos sanguíneos, estão constantemente expostas ao estresse da tesoura de fluidos (SS). Padrões anormais de SS fluido têm sido mostrados para melhorar a sinalização TGFβ/BMP, que, juntamente com outros estímulos, induzem aterogenese. Em relação a isso, atheroprone, baixo laminar SS foi encontrado para melhorar a sinalização TGFβ/BMP enquanto atheroprotetonte, alto laminar SS, diminui essa sinalização. Para analisar eficientemente a ativação dessas vias, projetamos um fluxo de trabalho para investigar a formação de complexos de fatores de transcrição sob ss de baixo laminar e condições de SS de alta laminar usando um sistema de bomba pneumática comercialmente disponível e ensaio de ligadura de proximidade (PLA).
A sinalização ativa de TGFβ/BMP requer a formação de complexos SMAD trimericos constituídos por dois SMADs regulatórios (R-SMAD); SMAD2/3 e SMAD1/5/8 para sinalização TGFβ e BMP, respectivamente) com um mediador comum SMAD (co-SMAD; SMAD4). Utilizando PLA visando diferentes subunidades do complexo trimerico SMAD, ou seja, R-SMAD/co-SMAD ou R-SMAD/R-SMAD, a formação de complexos ativos de fator de transcrição SMAD pode ser medida quantitativa e espacialmente usando microscopia de fluorescência.
O uso de slides de fluxo com 6 pequenos canais paralelos, que podem ser conectados em série, permite a investigação do fator de transcrição formação e inclusão dos controles necessários.
O fluxo de trabalho aqui explicado pode ser facilmente adaptado para estudos que visam a proximidade de SMADs a outros fatores de transcrição ou para complexos de fator de transcrição que não sejam SMADs, em diferentes condições de SS fluidos. O fluxo de trabalho aqui apresentado mostra uma maneira rápida e eficaz de estudar a sinalização TGFβ/BMP induzida pelo fluido em CEs, tanto quantitativa quanto espacialmente.
Introduction
Proteínas dos fatores transformadores de crescimento beta (TGFβ) superfamília são citocinas pleiotrópicos com uma variedade de membros, incluindo TGFβs, proteínas morfogenéticas ósseas (BMPs) e Activins1,2. A ligação ligante induz a formação de oligômeros receptores que levam à fosforilação e, assim, ativação do SMAD regulatório citomúmico (R-SMAD). Dependendo da subfamo de ligantes, diferentes R-SMADs são ativados1,2. Enquanto TGFβs e Activins induzem principalmente fosforilação de SMAD2/3, os BMPs induzem a fosforilação SMAD1/5/8. No entanto, há evidências acumuladas de que os BMPs e TGFβs/Activins também ativam R-SMADs da respectiva outra subfamo, em um processo denominado como ‘sinalização lateral’3,4,5,6,7,8 e que existem complexos SMAD mistos compostos por ambos, SMAD1/5 e SMAD2/3, membros3,9 . Dois R-SMADs ativados formam posteriormente complexos triméricos com o mediador comum SMAD4. Esses complexos de fator de transcrição são então capazes de translocar para o núcleo e regular a transcrição dos genes-alvo. Os SMADs podem interagir com uma variedade de diferentes co-ativadores e co-repressores transcricionais, levando à diversificação das possibilidades de regular genes-alvo10. A desregulamentação da sinalização SMAD tem sérias implicações em uma variedade de doenças. De acordo com isso, a sinalização TGFβ/BMP desequilibrada pode levar a patologias vasculares graves, como hipertensão arterial pulmonar, telangiectasia hemorrágica hereditária ou aterosclerose3,11,12,13,14.
As células endoteliais (CE) formam a camada mais interna dos vasos sanguíneos e são, portanto, expostas ao estresse da cisalhamento (SS), uma força de atrito exercida pelo fluxo viscoso do sangue. Curiosamente, os CEs residentes nas partes da vasculatura, que são expostos a altos níveis de uniforme, laminar SS, são mantidos em um estado homeostático e quiescente. Em contraste, as CES que experimentam SS baixas e não uniformes, por exemplo, em bifurcações ou na menor curvatura do arco aórtico, são proliferativas e ativam vias inflamatórias15. Por sua vez, os locais de ECs disfuncionais são propensos a desenvolver aterosclerose. Curiosamente, os CES nessas áreas de atheroprone exibem níveis aberrantemente altos de SMAD2/3 ativados e SMAD1/516,17,18. Nesse contexto, verificou-se que a sinalização TGFβ/BMP aprimorada foi um evento inicial no desenvolvimento de lesões ateroscleróticas19 e a interferência na sinalização de BMP foi encontrada para reduzir significativamente a inflamação vascular, a formação de atheroma e calcificação associada20.
O Ensaio de Ligadura de Proximidade (PLA) é uma técnica bioquímica para estudar interações proteína-proteína em situ21,22. Ele se baseia na especificidade de anticorpos de diferentes espécies que podem ligar proteínas-alvo de interesse, permitindo detecção altamente específica de interações proteicas endógenas a um nível unicelular. Aqui, os anticorpos primários têm que se ligar ao seu epítope alvo a uma distância inferior a 40 nm para permitir a detecção23. Portanto, o PLA é muito benéfico em relação às abordagens tradicionais de co-imunoprecipitação, onde vários milhões de células são necessárias para detectar interações proteicas endógenas. No PLA, anticorpos secundários específicos da espécie, covalentemente ligados a fragmentos de DNA (denominados sondas Plus e Minus), ligam os anticorpos primários e se as proteínas de interesse interagirem, as sondas Plus e Minus se aproximam. O DNA é ligado na etapa seguinte e a amplificação do círculo de rolamento do DNA circular é possível. Durante a amplificação, oligonucleotídeos complementares rotulados fluorescente se ligam ao DNA sintetizado, permitindo que essas interações proteicas sejam visualizadas pela microscopia de fluorescência convencional.
O protocolo descrito aqui permite que os cientistas comparem quantitativamente o número de complexos ativos de transcrição SMAD em condições de SS atheroprotetor e atheroprone in vitro usando PLA. O SS é gerado através de um sistema de bomba pneumática programável que é capaz de gerar fluxo direcional laminar de níveis definidos e permite aumentos stepwise das taxas de fluxo. Este método permite a detecção de interações entre SMAD1/5 ou SMAD2/3 com SMAD4, bem como complexos mistos-R-SMAD. Ele pode ser facilmente expandido para analisar interações de SMADs com co-reguladores transcricionais ou para complexos de fatores de transcrição que não sejam SMADs. A Figura 1 mostra os principais passos do protocolo apresentado abaixo.
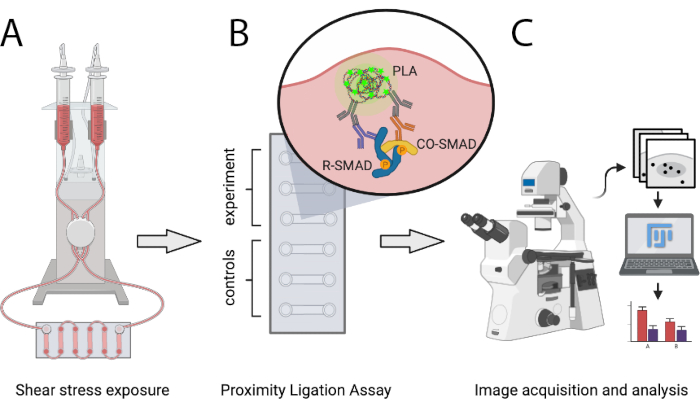
Figura 1: Representação esquemática do protocolo descrito. (A) As células semeadas em slides de 6 canais são expostas ao estresse da cisalhamento com um sistema de bomba pneumática. (B) As células fixas são utilizadas para o experimento PLA ou para condições de controle. (C) As imagens dos experimentos pla são adquiridas com um microscópio de fluorescência e são analisadas por meio do software de análise ImageJ. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O protocolo baseado em PLA descrito aqui oferece uma maneira eficiente de determinar a proximidade de duas proteínas (por exemplo, sua interação direta) em CEs expostas ao estresse de tesoura com resolução quantitativa e espacial. Usando slides de fluxo com múltiplos canais paralelos, várias interações proteicas diferentes podem ser examinadas ao mesmo tempo em células sob condições mecânicas idênticas. Em contraste, os sistemas de câmara de fluxo de construção personalizada geralmente fazem uso de um ú…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos à Dra. Maria Reichenbach e ao Dr. Christian Hiepen pelo apoio ao sistema de escoamento e Eleanor Fox e Yunyun Xiao por lerem criticamente o manuscrito. P-L.M. foi financiado pela International Max Planck Research School IMPRS-Biology and Computation (IMPRS-BAC). PK recebeu financiamento pelo DFG-SFB1444. A Figura 1 foi criada usando BioRender.
Materials
| µ-Slide VI 0.4 | ibidi | 80606 | 6-channel slide |
| Ammonium Chloride | Carl Roth | K298.1 | Quenching |
| Bovine Serum Albumin | Carl Roth | 8076.4 | Blocking |
| DAPI | Sigma Aldrich/ Merck | D9542 | Stain DNA/Nuclei |
| DPBS | PAN Biotech | P04-53500 | PBS |
| Duolink In Situ Detection Reagents Green | Sigma Aldrich/ Merck | DUO92014 | PLA kit containing Ligase, ligation buffer, polymerase and amplification buffer (with green labeled oligonucleotides) |
| Duolink In Situ PLA Probe Anti-Mouse MINUS | Sigma Aldrich/ Merck | DUO92004 | MINUS probe |
| Duolink In Situ PLA Probe Anti-Rabbit PLUS | Sigma Aldrich/ Merck | DUO92002 | PLUS probe |
| Duolink In Situ Wash Buffers, Fluorescence | Sigma Aldrich/ Merck | DUO82049 | PLA wash buffers A and B |
| Endothelial Cell Growth Supplement | Corning | supplement for medium (ECGS) | |
| Fetal calf Serum | supplement for medium | ||
| FIJI | Image Analysis software | ||
| Formaldehyde solution 4% buffered | KLINIPATH/VWR | VWRK4186.BO1 | PFA |
| Full medium | M199 basal medium +20 % FCS +1 % P/S + 2 nM L-Glu + 25 µg/mL Hep + 50 µg/mL ECGS | ||
| Gelatin from porcine skin, Type A | Sigma Aldrich | G2500 | Use 0.1% in PBS for coating of flow channels |
| GraphPad Prism v.7 | GarphPad | Statistical Program used for the Plots and statistical calculations | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma Aldrich | H4784-250MG | supplement for medium (Hep) |
| HUVECs | |||
| ibidi Mounting Medium | ibidi | 50001 | Liquid mounting medium |
| ibidi Pump System | ibidi | 10902 | pneumatic pump |
| Leica TCS SP8 | Leica | confocal microscope | |
| L-Glutamin 200mM | PAN Biotech | P04-80100 | supplement for medium (L-Glu) |
| Medium 199 | Sigma Aldrich | M2154 | Base medium |
| mouse anti- SMAD1 Antibody | Abcam | ab53745 | Suited for PLA |
| mouse anti- SMAD2/3 Antibody | BD Bioscience | 610843 | Not suited for PLA in combination with CST 9515 |
| mousee anti- SMAD4 Antibody | Sanata Cruz Biotechnology | sc-7966 | Suited for PLA |
| Penicillin 10.000U/ml /Streptomycin 10mg/ml | PAN Biotech | P06-07100 | supplement for medium (P/S) |
| Perfusion Set WHITE | ibidi | 10963 | Tubings used for 1 dyn/cm2 |
| Perfusion Set YELLOW and GREEN | ibidi | 10964 | Tubings used for 30 dyn/cm2 |
| rabbit anti- phospho SMAD1/5 Antibody | Cell Signaling Technologies | 9516 | Suited for PLA |
| rabbit anti- SMAD2/3 XP Antibody | Cell Signaling Technologies | 8685 | Suited for PLA |
| rabbit anti- SMAD4 Antibody | Cell Signaling Technologies | 9515 | Not suited for PLA in combination with BD 610843 |
| Serial Connector for µ-Slides | ibidi | 10830 | serial connection tubes |
| Triton X-100 | Carl Roth | 6683.1 | Permeabilization |
References
- Yadin, D., Knaus, P., Mueller, T. D. Structural insights into BMP receptors: Specificity, activation and inhibition. Cytokine and Growth Factor Reviews. 27, 13-34 (2016).
- Sieber, C., Kopf, J., Hiepen, C., Knaus, P. Recent advances in BMP receptor signaling. Cytokine and Growth Factor Reviews. 20 (5-6), 343-355 (2009).
- Hiepen, C., et al. BMPR2 acts as a gatekeeper to protect endothelial cells from increased TGFβ responses and altered cell mechanics. PLoS Biology. 17 (12), 3000557 (2019).
- Hildebrandt, S., et al. ActivinA induced SMAD1/5 Signaling in an iPSC derived EC model of Fibrodysplasia Ossificans Progressiva (FOP) can be rescued by the drug candidate saracatinib. Stem Cell Reviews and Reports. , (2021).
- Goumans, M. J., et al. Balancing the activation state of the endothelium via two distinct TGF-beta type I receptors. The EMBO Journal. 21 (7), 1743-1753 (2002).
- Goumans, M. J., et al. Activin receptor-like kinase (ALK)1 is an antagonistic mediator of lateral TGFbeta/ALK5 signaling. Molecular Cell. 12 (4), 817-828 (2003).
- Daly, A. C., Randall, R. A., Hill, C. S. Transforming growth factor beta-induced Smad1/5 phosphorylation in epithelial cells is mediated by novel receptor complexes and is essential for anchorage-independent growth. Molecular and Cellular Biology. 28 (22), 6889-6902 (2008).
- Ramachandran, A., et al. TGF-β uses a novel mode of receptor activation to phosphorylate SMAD1/5 and induce epithelial-to-mesenchymal transition. eLife. 7, 31756 (2018).
- Flanders, K. C., et al. Brightfield proximity ligation assay reveals both canonical and mixed transforming growth factor-β/bone morphogenetic protein Smad signaling complexes in tissue sections. The Journal of Histochemistry and Cytochemistry : The Official Journal of The Histochemistry Society. 62 (12), 846-863 (2014).
- Miyazono, K., Maeda, S., Imamura, T., Dijke, P. T., Heldin, C. -. H. . Smad Signal Transduction: Smads in Proliferation, Differentiation and Disease. , 277-293 (2006).
- Goumans, M. J., Zwijsen, A., Ten Dijke, P., Bailly, S. Bone morphogenetic proteins in vascular homeostasis and disease. Cold Spring Harbor Perspectives in Biology. 10 (2), 031989 (2018).
- Cai, J., Pardali, E., Sánchez-Duffhues, G., ten Dijke, P. BMP signaling in vascular diseases. FEBS Letters. 586 (14), 1993-2002 (2012).
- Cunha, S. I., Magnusson, P. U., Dejana, E., Lampugnani, M. G. Deregulated TGF-β/BMP signaling in vascular malformations. Circulation research. 121 (8), 981-999 (2017).
- MacCarrick, G., et al. Loeys-Dietz syndrome: a primer for diagnosis and management. Genetics in Medicine : An Official Journal of the American College of Medical Genetics. 16 (8), 576-587 (2014).
- Baeyens, N., Bandyopadhyay, C., Coon, B. G., Yun, S., Schwartz, M. A. Endothelial fluid shear stress sensing in vascular health and disease. The Journal of Clinical Investigation. 126 (3), 821-828 (2016).
- Min, E., et al. Activation of Smad 2/3 signaling by low shear stress mediates artery inward remodeling. bioRxiv. , 691980 (2019).
- Zhou, J., et al. BMP receptor-integrin interaction mediates responses of vascular endothelial Smad1/5 and proliferation to disturbed flow. Journal of Thrombosis and Haemostasis. 11 (4), 741-755 (2013).
- Zhou, J., et al. Force-specific activation of Smad1/5 regulates vascular endothelial cell cycle progression in response to disturbed flow. Proceedings of the National Academy of Sciences of the United States of America. 109 (20), 7770-7775 (2012).
- van Dijk, R. A., et al. Visualizing TGF-β and BMP signaling in human atherosclerosis: A histological evaluation based on Smad activation. Histology and Histopathology. 27 (3), 387-396 (2012).
- Derwall, M., et al. Inhibition of bone morphogenetic protein signaling reduces vascular calcification and atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32 (3), 613-622 (2012).
- Fredriksson, S., et al. Protein detection using proximity-dependent DNA ligation assays. Nature Biotechnology. 20 (5), 473-477 (2002).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature Methods. 3 (12), 995-1000 (2006).
- Alam, M. S. Proximity Ligation Assay (PLA). Current Protocols in Immunology. 123 (1), 58 (2018).
- Application Note 03: Growing Cells in µ-Channels. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN03_Growing_cells.pdf (2012)
- Application Note 13: HUVECs under perfusion. ibidi Available from: https://ibidi.com/img/cms/support/AN/AN13_HUVECs_under_perfusion.pdf (2019)
- ibidi. Application Note 31: Instructions µ-Slide VI 0.4. ibidi. , (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Reichenbach, M., et al. Differential impact of fluid shear stress and YAP/TAZ on BMP/TGF-β induced osteogenic target genes. Advanced Biology. 5 (2), 2000051 (2021).
- Hiepen, C., Mendez, P. L., Knaus, P. It takes two to tango: Endothelial TGFβ/BMP signaling crosstalk with mechanobiology. Cells. 9 (9), 1965 (2020).

