Extraktion und Reinigung von FAHD1-Protein aus Schweineniere und Mausleber
Summary
Dieses Protokoll beschreibt, wie das domänenhaltige Fumarylacetoacetat-Hydrolase-haltige Protein 1 (FAHD1) aus Schweineniere und Mausleber extrahiert werden kann. Die aufgeführten Methoden können an andere Proteine von Interesse angepasst und für andere Gewebe modifiziert werden.
Abstract
Fumarylacetoacetathydrolase-Domänen-haltiges Protein 1 (FAHD1) ist das erste identifizierte Mitglied der FAH-Superfamilie in Eukaryoten und wirkt als Oxalacetat-Decarboxylase in Mitochondrien. Dieser Artikel stellt eine Reihe von Methoden zur Extraktion und Reinigung von FAHD1 aus Schweineniere und Mausleber vor. Abgedeckte Methoden sind die Ionenaustauschchromatographie mit schneller Proteinflüssigkeitschromatographie (FPLC), die präparative und analytische Gelfiltration mit FPLC und proteomische Ansätze. Nach der Gesamtproteinextraktion wurden die Ammoniumsulfatfällung und die Chromatographie des Ionenaustauschs untersucht, und FAHD1 wurde über eine sequentielle Strategie unter Verwendung der Ionenaustausch- und Größenausschlusschromatographie extrahiert. Dieser repräsentative Ansatz kann an andere Proteine von Interesse angepasst werden (in signifikanten Mengen exprimiert) und für andere Gewebe modifiziert werden. Gereinigtes Protein aus Gewebe kann die Entwicklung hochwertiger Antikörper und/oder potenter und spezifischer pharmakologischer Inhibitoren unterstützen.
Introduction
Das eukaryotische FAH-domänenhaltige Protein 1 (FAHD1) wirkt als bifunktionelle Oxalacetat (OAA)-Decarboxylase (ODx)1 und Acylpyruvathydrolase (ApH)2. Es ist in Mitochondrien 2 lokalisiert und gehört zur breiten FAH-Superfamilie der Enzyme 1,2,3,4,5,6. Während seine ApH-Aktivität nur von geringer Relevanz ist, ist die ODx-Aktivität von FAHD1 an der Regulation des TCA-Zyklusflusses 1,7,8,9 beteiligt. OAA wird nicht nur für die zentrale Citratsynthase-Reaktion im Tricarbonsäurezyklus benötigt, sondern wirkt auch als kompetitiver Inhibitor der Succinat-Dehydrogenase als Teil des Elektronentransportsystems und als kataplerotischer Metabolit. Die Herunterregulierung der FAHD1-Genexpression in menschlichen Nabelvenendothelzellen (HUVEC) führte zu einer signifikanten Verringerung der Zellproliferation10 und einer signifikanten Hemmung des mitochondrialen Membranpotentials, verbunden mit einem gleichzeitigen Wechsel zur Glykolyse. Das Arbeitsmodell bezieht sich auf den mitochondrialen Dysfunktions-assoziierten Seneszenz (MiDAS)11-ähnlichen Phänotyp 8, bei dem die mitochondrialen OAA-Spiegel durch die FAHD1-Aktivität 1,8,9 streng reguliert werden.
Rekombinantes Protein ist leichter durch Expression und Reinigung von Bakterien12 als von Gewebe zu erhalten. Ein in Bakterien exprimiertes Protein kann jedoch durch mögliches Fehlen posttranslationaler Modifikationen verzerrt sein oder einfach problematisch sein (d. H. Aufgrund von Plasmidverlust, bakteriellen Stressreaktionen, verzerrten / ungeformten Disulfidbindungen, keiner oder schlechter Sekretion, Proteinaggregation, proteolytischer Spaltung usw.). Für bestimmte Anwendungen muss Protein aus Zelllysat oder Gewebe gewonnen werden, um solche Modifikationen einzuschließen und/oder mögliche Artefakte auszuschließen. Gereinigtes Protein aus Gewebe unterstützt die Entwicklung hochwertiger Antikörper und/oder potenter und spezifischer pharmakologischer Inhibitoren für ausgewählte Enzyme, wie z.B. für FAHD113.
Dieses Manuskript stellt eine Reihe von Methoden zur Extraktion und Reinigung von FAHD1 aus Schweineniere und Mausleber vor. Die beschriebenen Methoden erfordern eine schnelle Proteinflüssigkeitschromatographie (FPLC), verwenden aber ansonsten gängige Laborgeräte. Alternative Methoden können an anderer Stellegefunden werden 14,15,16,17. Nach der Gesamtproteinextraktion umfasst das vorgeschlagene Protokoll eine Testphase, in der Teilprotokolle für die Ammoniumsulfatfällung und die Chromatographie des Ionenaustauschs diskutiert werden (Abbildung 1). Nach der Definition dieser Subprotokolle wird das interessierende Protein über eine sequentielle Strategie unter Verwendung von Ionenaustausch und Größenausschlusschromatographie mit FPLC extrahiert. Basierend auf diesen Richtlinien kann das endgültige Protokoll individuell für andere Proteine von Interesse angepasst werden.
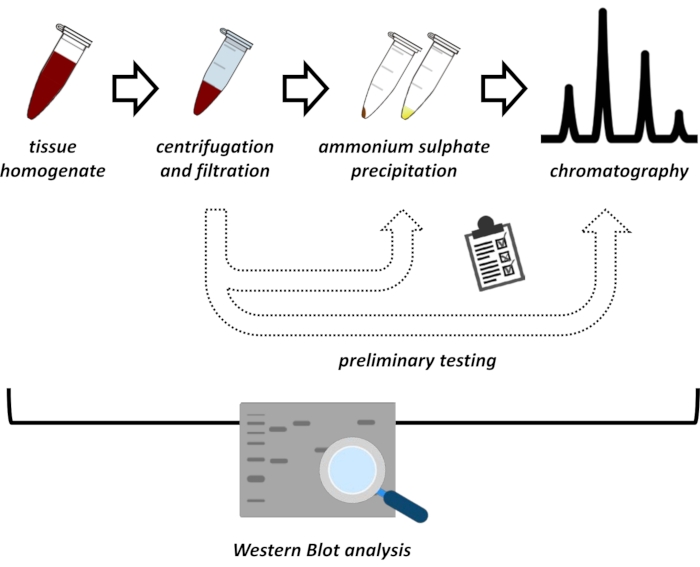
Abbildung 1: Die Gesamtstrategie dieses Protokolls. Von oben nach unten: Protein wird aus Geweben extrahiert. Gewebehomogenat wird hergestellt, zentrifugiert und filtriert. Für jedes Paar von überstehenden und aus Pellets gewonnenen Proben müssen Tests zur Ammoniumsulfatfällung und zur Ionenaustauschchromatographie (FPLC) durchgeführt werden, um optimale Bedingungen zu untersuchen. Nach der Festlegung dieser Subprotokolle kann das Protein durch ein sequentielles Verfahren der Ammoniumsulfatfällung, der Ionenaustauschchromatographie und der repetitiven Größenausschlusschromatographie (FPLC) bei unterschiedlichen pH- und Salzkonzentrationen extrahiert werden. Alle Schritte müssen von Western Blot kontrolliert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Kritische Schritte im Protokoll
Die Einhaltung gemeinsamer Richtlinien für den Umgang mit Proteinen ist unerlässlich, wie z.B. die Arbeit auf Eis und bei moderaten pH- und Salzbedingungen. Die Verwendung von Proteasehemmern ist für die Methode von Vorteil, während die Verwendung von Proteasom-Inhibitoren dringend empfohlen wird. Das Einfrieren und Auftauen der Probe kann immer zu einer Proteinausfällung (zumindest teilweise) führen, daher sollte jedes aufgetaute Aliquot des anfänglichen Protein…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren sind sehr dankbar für die technische Unterstützung durch Ayse Öztürk und Eva Albertini. Mäuse, die zur Erzeugung von Lebergewebe verwendet wurden, wurden unter der Aufsicht von Univ.-Doz gepflegt. Dr. Pidder Jansen-Dürr (Institut für Biomedizinische Alternsforschung an der Universität Innsbruck, Rennweg 10, 6020 Innsbruck, Österreich).
Materials
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | – | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | – | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | – | – | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | – | – | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 – a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily – A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).

