Generazione di podociti derivati dal paziente da biopsie cutanee
Summary
Questo manoscritto descrive un protocollo in due fasi per generare podociti specifici del paziente dai fibroblasti dermici attraverso la riprogrammazione episomiale in cellule staminali pluripotenti indotte dall’uomo (hiPSC) e la successiva differenziazione in podociti.
Abstract
I podociti sono cellule epiteliali situate sul sito urinario della barriera di filtrazione glomerulare che contribuiscono alla funzione di filtro selettivo del glomerulo. Le mutazioni nei geni podocita specifici possono causare glomerulosclerosi focale segmentale (FSGS) e i podociti sono colpiti anche in molte altre nefropatie primarie e secondarie. A causa della loro natura differenziata, i modelli di coltura cellulare primaria sono limitati per i podociti. Pertanto, vengono utilizzate comunemente cellule condizionatamente immortalate. Tuttavia, questi podociti condizionatamente immortalizzati (ciPodocytes) hanno diverse limitazioni: le cellule possono dedifferenziarsi in coltura, specialmente quando raggiungono la confluenza, e diversi marcatori specifici del podocita sono solo leggermente o non espressi affatto. Ciò mette in discussione l’uso dei ciPodociti e la loro applicabilità per la portata fisiologica, fisiopatologica e clinica. Qui, descriviamo un protocollo per la generazione di podociti umani, inclusi podociti specifici del paziente, da una biopsia cutanea mediante riprogrammazione episomiale dei fibroblasti dermici in hiPSC e successiva differenziazione in podociti. Questi podociti assomigliano molto meglio ai podociti in vivo in termini di caratteristiche morfologiche, come lo sviluppo dei processi del piede e l’espressione del marcatore specifico del podocita. Infine, ma ancora meno importante, queste cellule mantengono le mutazioni dei pazienti, risultando in un modello ex vivo migliorato per studiare le malattie dei podociti e le potenziali sostanze terapeutiche in un approccio individualizzato.
Introduction
I podociti sono cellule epiteliali renali post-mitotiche specializzate che formano la barriera di filtrazione glomerulare del rene insieme alla membrana basale glomerulare (GBM), alle cellule endoteliali glomerulari e al glicocalice. Fenotipicamente, i podociti sono costituiti da un corpo cellulare e da estensioni primarie della membrana guidate da microtubuli, nonché estensioni secondarie chiamate processi del piede 1,2. La barriera di filtrazione glomerulare che filtra l’urina dal sangue è costruita con endotelio fenestrato, GBM e un tipo specializzato di giunzione intercellulare che collega i processi del piede podocita vicini, chiamato diaframma a fessura dei podoctyes3. In condizioni di salute, le proteine più grandi dell’albumina vengono trattenute dalla barriera di filtrazione a causa delle loro dimensioni e carica4.
È noto che le mutazioni nei geni citoscheletrici o podociti specifici, così come i fattori circolanti che influenzano le vie di segnalazione dei podociti, inducono effacement, distacco o apoptosi del podocita con conseguente proteinuria e sclerosi glomerulare. In particolare, il riarrangiamento citoscheletrico, i cambiamenti nella polarità del podocita o il danneggiamento dei processi del piede con una perdita associata delle giunzioni a fessura sono fondamentali5. A causa del loro stato terminale differenziato, i podociti difficilmente possono essere sostituiti dopo il distacco del GBM. Tuttavia, se i podociti sono attaccati al GBM, possono ancora recuperare dall’effacement e riformare i processi interdigitati del piede 6,7,8. Un’ulteriore comprensione degli eventi che portano al danno da podocita in vari disturbi glomerulari può fornire nuovi obiettivi terapeutici che aiuteranno a sviluppare trattamenti per queste malattie. Il danno da podocita è un segno distintivo di diverse malattie glomerulari, tra cui la glomerulosclerosi focale segmentale (FSGS), la nefropatia diabetica, la malattia a cambiamento minimo e la glomerulonefropatia membranosa, che richiedono modelli affidabili di podocita ex vivo per studiare i meccanismi patologici e i potenziali approcci terapeutici per queste malattie 9,10. I podociti possono essere studiati ex vivo mediante coltura cellulare primaria classica basata sull’isolamento dei glomeruli mediante setacciatura differenziale11. Tuttavia, a causa dello stato terminalmente differenziato con limitata capacità di proliferazione, la maggior parte dei ricercatori utilizza linee cellulari di ciPodociti di topo o umani che esprimono varianti sensibili alla temperatura del grande antigene T SV40. In alternativa, i ciPodociti sono isolati da topi transgenici che ospitano il gene immortale SV40 Tag 1,12.
I cipotociti proliferano a 33 °C, ma entrano in arresto della crescita e iniziano a differenziarsi a 37 °C13,14. Va tenuto presente che i dati sperimentali ottenuti con queste cellule devono essere interpretati con una certa cautela, poiché le cellule sono generate utilizzando un’inserzione genica innaturale15. Poiché queste cellule ospitano un gene immortale, la fisiologia cellulare è alterata a causa della proliferazione in corso12. Le linee cellulari di podocite generate da questo approccio sono state recentemente messe in discussione, poiché i ciPodociti di topo, uomo e ratto esprimono meno del 5% di sinaptopodina e nefrrina a livello proteico, così come NPHS1 e NPHS2 a livello di mRNA rispetto all’espressione glomerulare16. Inoltre, la maggior parte delle linee cellulari di podocita non esprime nefrrina17,18. Chittiprol et al. hanno anche descritto una differenza significativa nella motilità cellulare e nelle risposte alla puromicina e alla doxorubicina nei ciPodocytes16. I podociti possono essere trovati nelle urine dopo il distacco dal GBM in diverse malattie glomerulari 19,20,21,22. I podociti urinari vitali possono essere coltivati ex vivo per un massimo di 2-3 settimane, ma la maggior parte delle cellule subisce l’apoptosi23,24. È interessante notare che i podociti non si trovano solo nelle urine di pazienti con malattia glomerulare ma anche nelle urine di soggetti sani, molto probabilmente quando sono senescenti, di nuovo con un limitato potenziale di replicazione in coltura24. Inoltre, il numero di podociti di derivazione urinaria è limitato e le cellule si dedifferenziano in coltura, mostrano meno processi del piede, cambiano morfologia e, soprattutto, hanno una capacità di proliferazione limitata. L’espressione dei geni podocit-specifici è assente, scompare entro poche settimane o varia tra questi cloni cellulari. Alcune cellule positive per il marcatore podocita specifico hanno co-espresso il marker di cellule epiteliali tubulari o miofibroblasti e cellule mesangiali, il che suggerisce la dedifferenziazione e/o la transdifferenziazione dei podociti urinari in coltura24,25.
Recentemente, è stata descritta la generazione di linee cellulari di ciPodociti derivate dall’urina di pazienti e volontari sani mediante trasduzione con un antigene T di grandi dimensioni SV40 termosensibile e hTERT26. È stata rilevata l’espressione di mRNA per sinaptopodina, nestina e proteina associata a CD2, ma l’mRNA della podocina era assente in tutti i cloni. Oltre ai problemi con i podociti urinari, queste cellule contengono anche il gene immortalizzante inserito, con conseguenti svantaggi discussi sopra.
Al contrario, le cellule staminali pluripotenti indotte umane (hiPSC) hanno un’enorme capacità di auto-rinnovarsi e differenziarsi in più tipi di cellule in condizioni appropriate. È stato dimostrato in precedenza che le hiPSC possono servire come fonte quasi illimitata di podociti27,28.
Qui viene descritto un protocollo in due fasi per generare podociti specifici per il paziente da fibroblasti dermici di biopsie cutanee con successiva riprogrammazione episomiale in hiPSC e una differenziazione finale in podociti derivati da hiPSC (Figura 1).
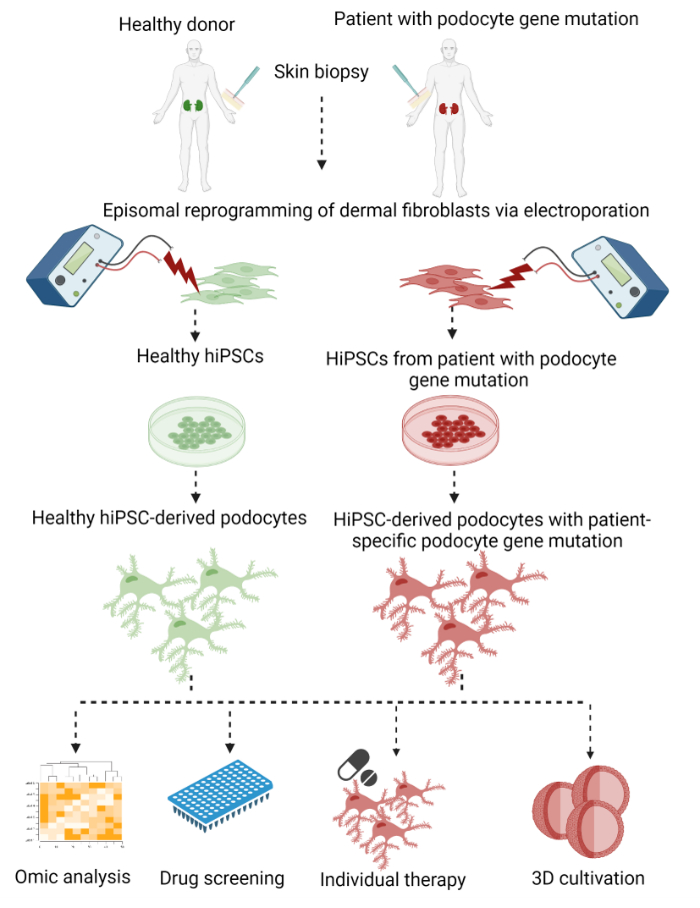
Figura 1: Protocollo per generare podociti derivati dall’hiPSC specifici per il paziente. Panoramica grafica del protocollo per generare podociti paziente-specifici da fibroblasti dermici di una biopsia cutanea mediante riprogrammazione in hiPSCs e differenziazione in podociti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Come primo passo, i fibroblasti dermici somatici sono stati superati da una biopsia cutanea e riprogrammati in hiPSCs utilizzando un metodo privo di integrazione mediante elettroporazione con plasmidi che esprimono i fattori di trascrizione OCT3/4, KLF4, SOX2 e c-MYC 29,30,31. Le colonie di hiPSC emergenti sono state successivamente selezionate ed ampliate. La differenziazione è iniziata con l’induzione della linea mesodermica mediante l’attivazione della via di segnalazione WNT, seguita dalla generazione di cellule progenitrici del nefrone che erano ancora in grado di proliferare. Infine, le cellule sono state differenziate in podociti. In questa procedura, abbiamo modificato e combinato protocolli precedentemente pubblicati per la riprogrammazione episomiale per la generazione di hiPSCs da Bang et al.32 e Okita et al.33, così come un protocollo per la differenziazione di hiPSCs in podociti di Musah et al.28,34,35.
Infatti, i podociti generati dal nostro protocollo avevano un fenotipo più vicino ai podociti in vivo, per quanto riguarda lo sviluppo di una rete distinta di processi primari e secondari del piede e l’espressione di marcatori podocita specifici, come sinaptopodina, podocina e nefrina. Con l’uso di podociti derivati da hiPSC, il background genetico del paziente viene mantenuto durante la riprogrammazione e la differenziazione. Ciò consente la modellizzazione della malattia podocita specifica del paziente e la scoperta di potenziali sostanze terapeutiche ex vivo in un numero di cellule quasi illimitato. Inoltre, questo protocollo è minimamente invasivo, economico, eticamente accettabile e può facilitare nuove strade per lo sviluppo di farmaci.
Protocol
Representative Results
Discussion
Questo protocollo basato su colture cellulari combina la riprogrammazione episomiale dei fibroblasti dermici umani in hiPSC specifiche del paziente e la successiva differenziazione in podociti derivati dall’hiPSC. Questo ci permette di studiare le alterazioni correlate alla mutazione dei podociti di pazienti con malattia glomerulare genetica per quanto riguarda il danno da podocita. Il protocollo per riprogrammare i fibroblasti dermici con un metodo privo di integrazione mediante elettroporazione è adattato dal lavoro pubblicato di Bang et al.32 e Okita et al.33. Il protocollo per differenziare i podociti dalle hiPSC è adattato dal protocollo pubblicato da Musah et al.28,34,35. Sono già disponibili pubblicazioni che descrivono la generazione di podociti da hiPSCs 27,34,35. Tuttavia, il protocollo fornito qui è ottimizzato e meno costoso per quanto riguarda la differenziazione delle hiPSC in podociti. Rispetto al protocollo pubblicato da Musah et al., abbiamo testato questo protocollo su diversi reagenti di rivestimento, come vitronectina, laminina seta-511 e matrice di membrana basale solubilizzata. Le concentrazioni di vitronectina e laminina seta-511 potrebbero essere ridotte a 2,5 μg/mL invece di 5 μg/mL 28,34,35. Inoltre, è stato possibile ridurre le concentrazioni di BMP7 e activina A, due fattori di crescita molto costosi, del 50%, da 100 ng / mL a 50 ng / mL.
Ciò consente una differenziazione meno costosa. Le cellule progenitrici del nefrone dal giorno 7 stavano ancora proliferando e la possibilità di congelamento era stata mostrata prima. Abbiamo espanso queste celle dopo lo scongelamento e prima della differenziazione finale in terreno di base contenente il mezzo Eagle modificato di Dulbecco (DMEM) e B27 per diversi giorni, riducendo ulteriormente i costi. Oltre alle fasi di differenziazione, questo protocollo descrive la crescita dei fibroblasti dalle biopsie cutanee con successiva generazione di hiPSC paziente-specifiche tramite riprogrammazione episomiale. La combinazione di questi due metodi consente la generazione di podociti specifici per il paziente. Pertanto, qui viene fornito un protocollo passo-passo completo per generare podociti derivati dall’hiPSC specifici per il paziente che non è stato descritto prima in modo così dettagliato.
Poiché il protocollo generale include diversi tipi di cellule, è fondamentale caratterizzare i tipi di cellule generate in diversi passaggi. Le cellule sono in coltura per un lungo periodo di tempo, quindi il controllo di qualità dovrebbe essere eseguito in diversi passaggi. Quando si lavora con hiPSC, è necessaria l’alimentazione quotidiana, nonché il monitoraggio del comportamento cellulare e della morfologia. La sterilità dei mezzi di differenziazione deve essere garantita dalla sterilizzazione del filtro attraverso un filtro da 0,2 μm. L’intero protocollo, dalla biopsia cutanea ai podociti derivati dall’hiPSC, richiede diversi mesi, ma è possibile congelare le cellule in fasi distinte del processo. I fibroblasti, i cloni hiPSC selezionati e le cellule progenitrici proliferative del nefrone dopo 7 giorni nel mezzo di differenziazione dei progenitori del nefrone possono essere congelati e può essere generata una banca cellulare funzionante.
Anche se i podociti sani derivati dall’hiPSC sviluppano una rete distinta di processi primari e secondari del piede (Figura 5A,B) ed esprimono il tipico marcatore specifico del podocita (Figura 6A-C), i caratteristici diaframmi a fessura, come si vedono in vivo, sono difficili da imitare nei classici modelli di coltura cellulare bidimensionale. Inoltre, la comunicazione intercellulare con altri tipi di cellule glomerulari non è possibile in questo contesto di monocoltura.
A causa del loro stato differenziato terminale e della mancanza di capacità di proliferazione, è difficile studiare i podociti ex vivo. Con l’aiuto di podociti primari condizionatamente immortalanti, è possibile superare questa limitazione con l’inserimento di un interruttore termosensibile, risultando in un modello di coltura cellulare in cui le cellule proliferano a 33 °C e si differenziano a 37 °C13,14. Sebbene questi ciPodociti abbiano un alto potenziale per la ricerca sui podociti, ci sono limitazioni, come la mancanza di espressione dei marcatori, la morfologia sdifferenziata e la mancata formazione dei processi del piede15,16.
La differenziazione dei podociti da cellule somatiche derivate dal paziente consente la generazione e il confronto di podociti malati con cellule di controllo sane ex vivo. Questo ci permette di studiare il danno podocita dovuto a mutazioni nei geni specifici del podocita. Inoltre, lavorare con le hiPSC ha il potenziale per creare modelli tridimensionali di malattia da coltura cellulare, o meglio organoidi43,44. La co-coltura di podociti derivati dall’hiPSC con altre cellule glomerulari, come le cellule endoteliali glomerulari o le cellule mesangiali, potrebbe portare a nuove intuizioni sulla comunicazione intercellulare nella salute e nella malattia glomerulare.
Inoltre, la caratterizzazione e il trattamento dei podociti paziente-specifici possono essere eseguiti ex vivo in analisi ad alta produttività. L’approccio individualizzato apre l’opportunità di studiare nuovi bersagli terapeutici per mutazioni specifiche e di eseguire la medicina individualizzata in futuro.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato finanziato dal Centro interdisciplinare per la ricerca clinica (IZKF) dell’Università Friedrich-Alexander Erlangen-Nürnberg con il numero di sovvenzione M4-IZKF-F009 assegnato a Janina Müller-Deile, e dal Bundesministerium für Bildung und Forschung (BMBF) con il nome di progetto STOP-FSGS-Speed Translation-Oriented Progress to Treat FSGS, numero di sovvenzione 01GM2202D assegnato a Janina Müller-Deile. Ringraziamo Annalena Kraus per il supporto nello scattare immagini SEM.
Materials
| 0.2 µm sterile filter | Rotilab | P668.1 | for sterilization of differentiation medium |
| all-trans retinoic acid | Stem Cell Technologies | 72262 | supplement for differentiation |
| B27 supplement (50 x), serum free | Gibco | 17504044 | supplement for serum-free differentiation medium |
| BG iMatrix-511 Silk | biogems | RL511S | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Bovine serum albumin (BSA) | Roth | 8076.4 | |
| CELLSTAR Filter Cap Cell Culture Flasks, T75, 250 mL | Greiner bio-one | 82050-856 | cell culture plastics suitable for fibroblast culture |
| CHIR99021 (5 mg) | Sigma-Aldrich | 252917-06-9 | supplement for differentiation |
| Corning Matrigel hESC qualified matrix | Corning | 354277 | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture (solubilized basement membrane matrix) |
| countess Cell Counting Chamber Slides | Invitrogen | C10283 | to count cells |
| countess II FL Automated Cell Counter | Invitrogen | to count cells | |
| cryoPure tubes, 2 ml, QuickSeal screw cap, white | Sarstedt | 72380 | cryovials for freezing of cells |
| dimethyl sulfoxide (DMSO) | Roth | A994.1 | for fibroblast freezing medium |
| DMEM/F12 (1:1) (1 x) | Gibco | 11320074 | basic medium for differentiation |
| DMEM/F12 + Glutamax | Gibco | 10565018 | basic medium for fibroblast medium |
| EVOS M5000 Imaging System | Thermo Fisher Scientific | AMF5000 | phase contrast microscope |
| fetal bovine serum premium, inactivated (FCS) | PAN Biotech | P301902 | serum for fibroblast medium, fibroblast freezing medium and podocyte maintenance medium |
| fisherbrand Electroporation Cuvettes Plus, 4 mm gap, 800 µL capacity, sterile | Fisherbrand | FB104 | cuvette used for electroporation/episomal reprogramming of fibroblasts (4mm gap) |
| fluoromount-G Mounting Medium, with DAPI | Invitrogen | 00-4959-52 | mounting medium containing dapi |
| gauge needle (0.6 x 30 mm) | BD Microlance3 | 300700 | for separation of hiPSC colonies into small pieces |
| human Recombinant Activin A Protein | 78001.1 | Stem cell technologies | supplement for differentiation |
| human recombinant bone morphogenetic protein 7 (BMP7) | Peprotech | 120-03P | supplement for differentiation |
| human VEGF-165 Recombinant Protein | Thermo Scientific | PHC9394 | supplement for differentiation |
| insulin-transferrin-selenium (ITS -G) (100 x) | Gibco | 41400045 | supplement for podocyte maintenance medium |
| LB medium | Roth | X964.1 | for sterility test of hiPSC culture |
| lookOut Mycoplasma PCR Detection Kit | Sigma Aldrich | MP0035-1KT | commercial mycoplasma detection kit |
| microscope slides | Diagonal GmbH & Co.KG | 21,102 | |
| microtube 1.5 mL | Sarstedt | 72706400 | |
| mTeSR1 Complete Kit | Stem Cell Technologies | 85850 | basic medium for serum-free hiPSC culture medium |
| nalgene freezing container Mr.Frosty | Roth | AC96.1 | to ensure optimal freezing conditions |
| normal goat serum | abcam | ab 7481 | for preincubation solution and antibody diluent |
| nunc 24 well plates | Thermo Scientific | 142485 | cell culture plastics suitable for hiPSC culture |
| nunc 48 well plates | Thermo Scientific | 152640 | cell culture plastics suitable for hiPSC culture |
| nunc 6 well plates | Thermo Scientific | 140685 | cell culture plastics suitable for hiPSC culture |
| nunc EasYDish Dishes 100 mm | Thermo Scientific | 150466 | cell culture plastics suitable for hiPSC culture |
| nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Scientific | 167008 | cell culture plastics suitable for hiPSC culture |
| nutriFreez D10 Cryopreservation Medium | Sartorius | 05-713-1E | serum-free cryopreservation medium for cryopreservation of hiPSC and nephron progenitor cells |
| Opti-MEM | Gibco | 11058021 | electroporation medium |
| pCXLE-hMLN | Addgene | #27079 | plasmid for episomal reprogramming |
| pCXLE-hOCT3/4 plasmid | Addgene | #27077 | plasmid for episomal reprogramming |
| pCXLE-hSK plasmid | Addgene | #27078 | plasmid for episomal reprogramming |
| penicillin-streptomycin | Sigma-Aldrich | P4333-100ML | to avoid bacterial contamination |
| plastic coverslips | Sarstedt | 83.1840.002 | for immunofluorescent stainings of hiPSCs and hiPSC-derived podocytes |
| ROTI Histofix | Roth | P087.3 | commercial paraformaldehyde (4 %) for fixation of cells |
| RPMI 1640 + L-Glutamine | Gibco | 21875034 | basic medium for podocyte maintenance medium |
| staining chamber StainTray Black lid | Roth | HA51.1 | |
| stemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | enzymatic cell detachment solution used for dissociation of hiPSCs |
| sterile phosphate buffered saline (PBS) (1 x) | Gibco | 14190094 | used for washing and coating |
| sterile water | Roth | T1432 | |
| syringe without needle 20 mL | BD Plastipak | 300629 | to filter sterilize differentiation medium |
| TC dish 100 mm | Sarstedt | 8,33,902 | sterile cell culture plastics used for cutting the skin biopsy and fibroblast culture |
| TC dish 35 mm | Sarstedt | 8,33,900 | sterile cell culture plastics used for outgrowing fibroblasts from skin biopsy |
| triton X 100 | Roth | 3051.3 | for preincubation solution |
| trypan Blue Stain (0.4 %) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | to count cells |
| trypsin-EDTA (10 x) | Biowest | X0930-100 | dissociation reagent used for fibroblasts and nephron progenitor cells |
| tube 15 mL | Greiner bio-one | 188271-N | |
| tube 50 mL | Greiner bio-one | 227261 | |
| vitronectin ACF | Sartorius | 05-754-0002 | extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Y-27632 dihydrochloride (10 mg) | Tocris | 1254 | to avoid apoptosis of hiPSCs during splitting |
| Primary antibodies | |||
| OCT4 | Stem Cell Technologies | 60093.1 | pluripotency marker, dilution 1:200 |
| SSEA-4 | Stem Cell Technologies | 60062FI.1 | pluripotency marker, dilution 1:100 |
| Ki67 | Abcam | ab15580 | proliferation marker, dilution 1:300 |
| synaptopodin | Proteintech | 21064-1-AP | podocyte-specific marker, dilution 1:200 |
| nephrin | Progen | GP-N2 | podocyte-specific marker, dilution 1:25 |
| podocin | proteintech | 20384-1-AP | podocyte-specific marker, dilution 1:100 |
| Secondary antibodies | |||
| goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21435 | secondary anditbody, dilution 1:1000 |
| alexa Fluor 647 Goat Anti-Rabbit SFX Kit, highly cross-adsorbed | Invitrogen | A31634 | secondary anditbody, dilution 1:1000 |
| donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A21206 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21422 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11001 | secondary anditbody, dilution 1:1000 |
References
- Mundel, P., et al. Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines. Experimental Cell Research. 236 (1), 248-258 (1997).
- Grgic, I., et al. Imaging of podocyte foot processes by fluorescence microscopy. Journal of the American Society of Nephrology. 23 (5), 785-791 (2012).
- Grahammer, F., Schell, C., Huber, T. B. The podocyte slit diaphragm-from a thin grey line to a complex signalling hub. Nature Reviews Nephrology. 9 (10), 587-598 (2013).
- Deen, W. M., Lazzara, M. J., Myers, B. D. Structural determinants of glomerular permeability. American Journal of Physiology. Renal Physiology. 281 (4), F579-F596 (2001).
- Schell, C., Huber, T. B. The evolving complexity of the podocyte cytoskeleton. Journal of the American Society of Nephrology. 28 (11), 3166-3174 (2017).
- Muller-Deile, J., Schiffer, M. Podocyte directed therapy of nephrotic syndrome-can we bring the inside out. Pediatric Nephrology. 31 (3), 393-405 (2016).
- Boehlke, C., et al. Hantavirus infection with severe proteinuria and podocyte foot-process effacement. American Journal of Kidney Diseases. 64 (3), 452-456 (2014).
- Schiffer, M., et al. Pharmacological targeting of actin-dependent dynamin oligomerization ameliorates chronic kidney disease in diverse animal models. Nature Medicine. 21 (6), 601-609 (2015).
- Kopp, J. B., et al. Podocytopathies. Nature Reviews. Disease Primers. 6 (1), 68 (2020).
- Wiggins, R. C. The spectrum of podocytopathies: a unifying view of glomerular diseases. Kidney International. 71 (12), 1205-1214 (2007).
- Mundel, P., Reiser, J., Kriz, W. Induction of differentiation in cultured rat and human podocytes. Journal of the American Society of Nephrology. 8 (5), 697-705 (1997).
- Jat, P. S., et al. Direct derivation of conditionally immortal cell lines from an H-2Kb-tsA58 transgenic mouse. Proceedings of the National Academy of Sciences. 88 (12), 5096-5100 (1991).
- Saleem, M. A., et al. A conditionally immortalized human podocyte cell line demonstrating nephrin and podocin expression. Journal of the American Society of Nephrology. 13 (3), 630-638 (2002).
- Eto, N., et al. Podocyte protection by darbepoetin: preservation of the cytoskeleton and nephrin expression. Kidney International. 72 (4), 455-463 (2007).
- Krtil, J., Platenik, J., Kazderova, M., Tesar, V., Zima, T. Culture methods of glomerular podocytes. Kidney & Blood Pressure Research. 30 (3), 162-174 (2007).
- Chittiprol, S., Chen, P., Petrovic-Djergovic, D., Eichler, T., Ransom, R. F. Marker expression, behaviors, and responses vary in different lines of conditionally immortalized cultured podocytes. American Journal of Physiology. Renal Physiology. 301 (3), F660-F671 (2011).
- Shih, N. Y., et al. CD2AP localizes to the slit diaphragm and binds to nephrin via a novel C-terminal domain. The American Journal of Pathology. 159 (6), 2303-2308 (2001).
- Yan, K., Khoshnoodi, J., Ruotsalainen, V., Tryggvason, K. N-linked glycosylation is critical for the plasma membrane localization of nephrin. Journal of the American Society of Nephrology. 13 (5), 1385-1389 (2002).
- Sir Elkhatim, R., Li, J. Y., Yong, T. Y., Gleadle, J. M. Dipping your feet in the water: podocytes in urine. Expert Review of Molecular Diagnostics. 14 (4), 423-437 (2014).
- Camici, M. Urinary detection of podocyte injury. Biomedicine & Pharmacotherapy. 61 (5), 245-249 (2007).
- Muller-Deile, J., et al. Overexpression of preeclampsia induced microRNA-26a-5p leads to proteinuria in zebrafish. Scientific Reports. 8 (1), 3621 (2018).
- Schenk, H., et al. Removal of focal segmental glomerulosclerosis (FSGS) factor suPAR using CytoSorb. Journal of Clinical Apheresis. 32 (6), 444-452 (2017).
- Petermann, A., Floege, J. Podocyte damage resulting in podocyturia: a potential diagnostic marker to assess glomerular disease activity. Nephron. Clinical Practice. 106 (2), c61-c66 (2007).
- Vogelmann, S. U., Nelson, W. J., Myers, B. D., Lemley, K. V. Urinary excretion of viable podocytes in health and renal disease. American Journal of Physiology. Renal Physiology. 285 (1), F40-F48 (2003).
- Petermann, A. T., et al. Podocytes that detach in experimental membranous nephropathy are viable. Kidney International. 64 (4), 1222-1231 (2003).
- Sakairi, T., et al. Conditionally immortalized human podocyte cell lines established from urine. American Journal of Physiology. Renal Physiology. 298 (3), F557-F567 (2010).
- Rauch, C., et al. Differentiation of human iPSCs into functional podocytes. PLoS One. 13 (9), e0203869 (2018).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1, 0069 (2017).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2 (12), 3081-3089 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Teshigawara, R., Cho, J., Kameda, M., Tada, T. Mechanism of human somatic reprogramming to iPS cell. Laboratory Investigation. 97 (10), 1152-1157 (2017).
- Bang, J. S., et al. Optimization of episomal reprogramming for generation of human induced pluripotent stem cells from fibroblasts. Animal Cells and Systems. 22 (2), 132-139 (2018).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8 (5), 409-412 (2011).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Vangipuram, M., Ting, D., Kim, S., Diaz, R., Schule, B. Skin punch biopsy explant culture for derivation of primary human fibroblasts. Journal of Visualized Experiments. (77), e3779 (2013).
- Hoffding, M. K., Hyttel, P. Ultrastructural visualization of the Mesenchymal-to-Epithelial Transition during reprogramming of human fibroblasts to induced pluripotent stem cells. Stem Cell Research. 14 (1), 39-53 (2015).
- Bharathan, S. P., et al. Systematic evaluation of markers used for the identification of human induced pluripotent stem cells. Biology Open. 6 (1), 100-108 (2017).
- Scholzen, T., Gerdes, J. The Ki-67 protein: from the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Vaz, I. M., et al. Chromosomal aberrations after induced pluripotent stem cells reprogramming. Genetics and Molecular Biology. 44 (3), 20200147 (2021).
- Reiser, J., Altintas, M. M. Podocytes. F1000Research. 5, 114 (2016).
- Ohmori, T., et al. Impaired NEPHRIN localization in kidney organoids derived from nephrotic patient iPS cells. Scientific Reports. 11 (1), 3982 (2021).
- Morizane, R., Bonventre, J. V. Generation of nephron progenitor cells and kidney organoids from human pluripotent stem cells. Nature Protocols. 12 (1), 195-207 (2017).

