Cilt Biyopsilerinden Hasta Kaynaklı Podositlerin Üretimi
Summary
Bu makalede, dermal fibroblastlardan hastaya özgü podositlerin epizomal yeniden programlanması yoluyla insan kaynaklı pluripotent kök hücrelere (hiPSC’ler) ve ardından podositlere farklılaşması için iki aşamalı bir protokol açıklanmaktadır.
Abstract
Podositler, glomerüler filtrasyon bariyerinin idrar bölgesinde oturan ve glomerulusun seçici filtre fonksiyonuna katkıda bulunan epitel hücreleridir. Podosit spesifik genlerdeki mutasyonlar fokal segmental glomerüloskleroza (FSGS) neden olabilir ve podositler diğer birçok primer ve sekonder nefropatide de etkilenir. Farklılaşmış doğaları nedeniyle, birincil hücre kültürü modelleri podositler için sınırlıdır. Bu nedenle, yaygın olarak şartlı olarak ölümsüzleştirilmiş hücreler kullanılır. Bununla birlikte, bu şartlı olarak ölümsüzleştirilmiş podositlerin (siPodositler) birkaç sınırlaması vardır: hücreler, özellikle akıcılığa ulaştıklarında, kültürde farklılaşabilir ve birkaç podosit spesifik belirteç, ya sadece hafifçe ifade edilir ya da hiç ifade edilmez. Bu da siPodositlerin kullanımını ve fizyolojik, patofizyolojik ve klinik erişim için uygulanabilirliklerini sorgulamaktadır. Burada, dermal fibroblastların hiPSC’lere epizomal olarak yeniden programlanması ve ardından podositlere farklılaşması yoluyla deri punch biyopsisinden hastaya özgü podositler de dahil olmak üzere insan podositlerinin üretilmesi için bir protokol açıklanmaktadır. Bu podositler, ayak süreçlerinin gelişimi ve podosit spesifik belirtecin ekspresyonu gibi morfolojik özellikler açısından in vivo podositlere çok daha iyi benzemektedir. Son olarak, ancak daha da önemlisi, bu hücreler hastaların mutasyonlarını korur ve podosit hastalıklarını ve potansiyel terapötik maddeleri bireyselleştirilmiş bir yaklaşımla incelemek için geliştirilmiş bir ex vivo model ile sonuçlanır.
Introduction
Podositler, glomerüler bazal membran (GBM), glomerüler endotel hücreleri ve glikokaliks ile birlikte böbreğin glomerüler filtrasyon bariyerini oluşturan özelleşmiş, post-mitotik renal epitel hücreleridir. Fenotipik olarak, podositler bir hücre gövdesi ve birincil, mikrotübül tahrikli membran uzantılarının yanı sıra ayak işlemleri 1,2 adı verilen ikincil uzantılardan oluşur. İdrarı kandan filtreleyen glomerüler filtrasyon bariyeri, fenestrated endotel, GBM ve podoktyes3’ün yarık diyaframı olarak adlandırılan komşu podosit ayak süreçlerini birbirine bağlayan özel bir hücreler arası kavşak türünden yapılmıştır. Sağlıklı koşullar altında, albüminden daha büyük proteinler, büyüklükleri ve yükleri4 nedeniyle filtrasyon bariyerinden tutulur.
Sitoiskelet veya podosit spesifik genlerdeki mutasyonların yanı sıra podosit sinyal yollarını etkileyen dolaşım faktörlerinin, podosit effacement, dekolmanı veya apoptozu indüklediği ve proteinüri ve glomerüler skleroz ile sonuçlandığı bilinmektedir. Özellikle, sitoiskeletin yeniden düzenlenmesi, podosit polaritesindeki değişiklikler veya yarık kavşakların kaybı ile ilişkili ayak süreçlerinin hasarı çok önemlidir5. Ölümcül olarak farklılaşmış durumları nedeniyle, podositler GBM’nin ayrılmasından sonra zorlukla değiştirilebilir. Bununla birlikte, podositler GBM’ye bağlanırsa, yine de efffacement’tan kurtulabilir veayak süreçlerini 6,7,8 ile değiştirebilirler. Çeşitli glomerüler bozukluklarda podosit hasarına yol açan olayların daha iyi anlaşılması, bu hastalıklar için tedavilerin geliştirilmesine yardımcı olacak yeni terapötik hedefler sağlayabilir. Podosit hasarı, fokal segmental glomerüloskleroz (FSGS), diyabetik nefropati, minimal değişiklik hastalığı ve membranöz glomerülonefropati gibi farklı glomerüler hastalıkların ayırt edici özelliğidir ve bu hastalıkların patolojik mekanizmalarını ve potansiyel tedavi yaklaşımlarını incelemek için güvenilir podosit ex vivo modelleri gerektirir 9,10. Podositler, diferansiyel eleme ile glomerüllerin izolasyonuna dayanan klasik primer hücre kültürü ile ex vivo olarak incelenebilir11. Bununla birlikte, sınırlı proliferasyon kapasitesine sahip terminal olarak farklılaşmış durum nedeniyle, çoğu araştırmacı SV40 büyük T antijeninin sıcaklığa duyarlı varyantlarını eksprese eden fare veya insan siPodosit hücre hatlarını kullanır. Alternatif olarak, siPodositler, SV40 Tag ölümsüzleştirici gen 1,12’yi barındıran transgenik farelerden izole edilir.
SiPodositler 33 ° C’de çoğalır, ancak büyüme durmasına girer ve 37 ° C’de farklılaşmaya başlar13,14. Bu hücrelerle elde edilen deneysel verilerin, hücreler doğal olmayan bir gen yerleştirme15 kullanılarak üretildiğinden, belirli bir dikkatle yorumlanması gerektiği unutulmamalıdır. Bu hücreler ölümsüzleştirici bir gen barındırdığından, devam eden proliferasyon nedeniyle hücresel fizyoloji değişir12. Bu yaklaşımla üretilen podosit hücre hatları son zamanlarda sorgulanmıştır, çünkü fare, insan ve sıçan siPodositleri, protein düzeyinde sinaptopodin ve nefrinin% 5’inden azını, ayrıca glomerüler ekspresyon16’ya kıyasla mRNA seviyesinde NPHS1 ve NPHS2’yi ifade etmektedir. Dahası, çoğu podosit hücre çizgisi nefrin17,18 eksprese etmez. Chittiprol ve ark. ayrıca siPodositlerde hücre motilitesinde ve puromisin ve doksorubisin yanıtlarında anlamlı bir fark tanımlamışlardır16. Podositler, farklı glomerüler hastalıklarda GBM’den ayrıldıktan sonra idrarda bulunabilir 19,20,21,22. Canlı üriner podositler 2-3 haftaya kadar ex vivo olarak yetiştirilebilir, ancak çoğu hücre apoptoz23,24’e maruz kalır. İlginçtir ki, podositler sadece glomerüler hastalığı olan hastaların idrarında değil, aynı zamanda sağlıklı deneklerin idrarında, büyük olasılıkla yaşlandıklarında da bulunur – yine kültür24’te sınırlı bir replikasyon potansiyeline sahiptir. Ayrıca, idrar kaynaklı podosit sayısı sınırlıdır ve hücreler kültürde farklılaşır, daha az ayak süreci gösterir, morfolojiyi değiştirir ve en önemlisi sınırlı proliferasyon kapasitesine sahiptir. Podosit spesifik genlerin ekspresyonu yoktur, birkaç hafta içinde kaybolur veya bu hücre klonları arasında değişir. Podosit spesifik belirteç için pozitif olan bazı hücreler, tübüler epitel hücrelerinin veya miyofibroblastların ve mezangial hücrelerin belirtecini birlikte eksprese ettiler, bu da kültürlü üriner podositlerin dediferansiyasyonunu ve / veya transdiferansiyasyonunu düşündürmektedir24,25.
Son zamanlarda, hastaların ve sağlıklı gönüllülerin idrarından elde edilen siPodosit hücre hatlarının ısıya duyarlı SV40 büyük T antijeni ve hTERT ile transdüksiyon yoluyla üretilmesi tanımlanmıştır26. Sinaptopodin, nestin ve CD2 ile ilişkili protein için mRNA ekspresyonu tespit edildi, ancak podosin mRNA tüm klonlarda yoktu. İdrar podositleri ile ilgili sorunlara ek olarak, bu hücreler aynı zamanda yerleştirilen ölümsüzleştirici geni de içerir ve bu da yukarıda tartışılan dezavantajlara neden olur.
Buna karşılık, insan kaynaklı pluripotent kök hücreler (hiPSC’ler), uygun koşullar altında kendini yenilemek ve çoklu hücre tiplerine farklılaşmak için büyük bir kapasiteye sahiptir. HiPSC’lerin neredeyse sınırsız bir podosit kaynağı olarak hizmet edebileceği daha önce gösterilmiştir27,28.
Burada, deri punch biyopsilerinin dermal fibroblastlarından hastaya özgü podositler üretmek için iki aşamalı bir protokol, daha sonra hiPSC’lere epizomal yeniden programlama ve hiPSC türevi podositlere son bir farklılaşma açıklanmaktadır (Şekil 1).
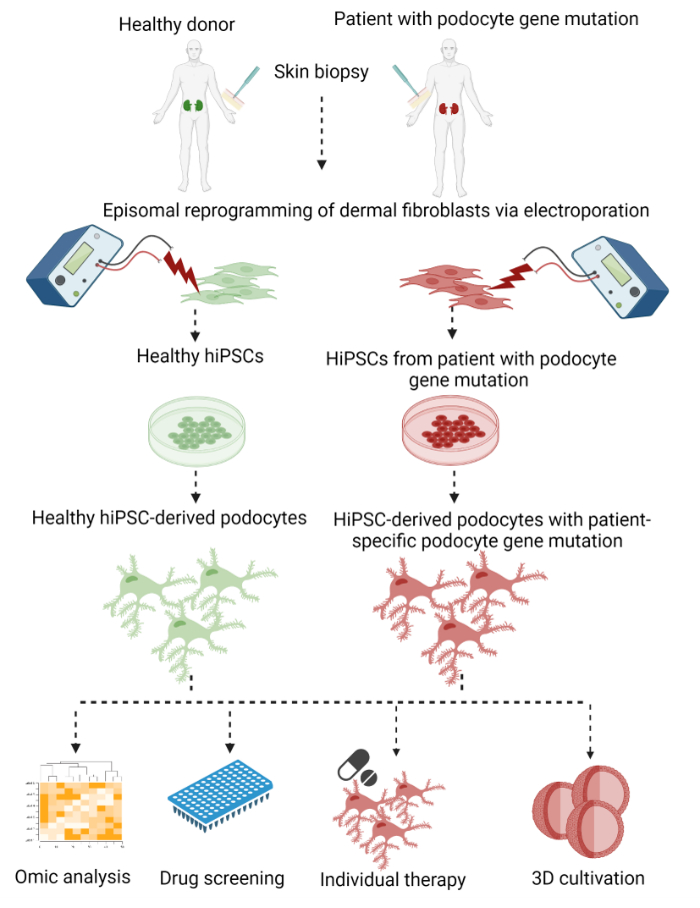
Şekil 1: Hastaya özgü hiPSC türevi podositler üretmek için protokol. Bir deri biyopsisinin dermal fibroblastlarından hastaya özgü podositler üretmek için protokole grafiksel genel bakış, hiPSC’lere yeniden programlanarak ve podositlere farklılaşarak. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
İlk adım olarak, somatik dermal fibroblastlar deri punch biyopsisinden büyütüldü ve OCT3/4, KLF4, SOX2 ve c-MYC29,30,31 transkripsiyon faktörlerini eksprese eden plazmidlerle elektroporasyon yoluyla entegrasyonsuz bir yöntem kullanılarak hiPSC’lere yeniden programlandı. Ortaya çıkan hiPSC kolonileri daha sonra seçildi ve genişletildi. Farklılaşma, WNT sinyal yolunun aktivasyonu ile mezodermal soyun indüksiyonu ile başladı, bunu hala çoğalabilen nefron progenitör hücrelerin oluşumu izledi. Son olarak, hücreler podositlere farklılaştırıldı. Bu prosedürde, Bang ve ark.32 ve Okita ve ark.33 tarafından hiPSC’lerin oluşturulması için epizomal yeniden programlama için daha önce yayınlanmış protokolleri ve ayrıca Musah ve ark.28,34,35 tarafından hiPSC’lerin podositlere farklılaştırılması için bir protokolü değiştirdik ve birleştirdik.
Gerçekten de, protokolümüz tarafından üretilen podositler, primer ve sekonder ayak süreçlerinin ayrı bir ağının gelişimi ve sinaptopodin, podosin ve nefrin gibi podositlere özgü belirteçlerin ekspresyonu ile ilgili olarak in vivo podositlere daha yakın bir fenotipe sahipti. HiPSC türevi podositlerin kullanımıyla, hastanın genetik arka planı yeniden programlama ve farklılaşma sırasında korunur. Bu, hastaya özgü podosit hastalığının modellenmesini ve potansiyel terapötik maddelerin ex vivo olarak neredeyse sınırsız sayıda hücre sayısında keşfedilmesini sağlar. Dahası, bu protokol minimal invaziv, uygun maliyetli, etik olarak kabul edilebilir ve ilaç geliştirme için yeni yollar kolaylaştırabilir.
Protocol
Representative Results
Discussion
Bu hücre kültürü tabanlı protokol, insan dermal fibroblastlarının hastaya özgü hiPSC’lere epizomal yeniden programlanmasını ve daha sonra hiPSC türevli podositlere farklılaşmasını birleştirir. Bu, podosit hasarı ile ilgili genetik glomerüler hastalığı olan hastalardan podositlerin mutasyona bağlı değişikliklerini incelememizi sağlar. Dermal fibroblastları elektroporasyon yoluyla entegrasyonsuz bir yöntemle yeniden programlama protokolü, Bang ve ark.32 ve Okita ve ark.33’ün yayınlanmış çalışmalarından uyarlanmıştır. Podositleri hiPSC’lerden ayırma protokolü, Musah ve ark.28,34,35’in yayınlanan protokolünden uyarlanmıştır. HiPSC’lerdenpodosit üretimini açıklayan yayınlar zaten mevcuttur 27,34,35. Bununla birlikte, burada sağlanan protokol, hiPSC’lerin podositlere farklılaşması konusunda optimize edilmiş ve daha ucuzdur. Musah ve ark.’nın yayınladığı protokolle karşılaştırıldığında, bu protokolü vitronektin, laminin ipek-511 ve çözünür bazal membran matrisi gibi farklı kaplama reaktifleri üzerinde test ettik. Vitronektin ve laminin silk-511 konsantrasyonları 5 μg / mL 28,34,35 yerine 2,5 μg / mL’ye düşürülebilir. Ayrıca, BMP7 ve aktivin A-iki çok pahalı büyüme faktörü konsantrasyonlarını-% 50 oranında, 100 ng / mL’den 50 ng / mL’ye düşürmek mümkün olmuştur.
Bu, daha ucuz farklılaşma sağlar. 7. günden itibaren nefron progenitör hücreleri hala çoğalıyordu ve donma olasılığı daha önce gösterilmişti. Bu hücreleri çözüldükten sonra ve Dulbecco’nun modifiye Eagle besiyeri (DMEM) ve B27’yi içeren bazik ortamda son farklılaşmadan önce birkaç gün boyunca genişlettik ve maliyetleri daha da düşürdük. Farklılaşma adımlarına ek olarak, bu protokol fibroblastların deri biyopsilerinden sonraki nesil hastaya özgü hiPSC’lerle epizomal yeniden programlama yoluyla büyümesini tanımlar. Bu iki yöntemin kombinasyonu hastaya özgü podositlerin üretilmesini sağlar. Bu nedenle, hastaya özgü hiPSC türevli podositler üretmek için daha önce bu kadar ayrıntılı olarak tanımlanmamış eksiksiz bir adım adım protokol burada sağlanmıştır.
Genel protokol birkaç farklı hücre tipi içerdiğinden, üretilen hücre tiplerini farklı adımlarda karakterize etmek çok önemlidir. Hücreler uzun süre kültürdedir, bu nedenle kalite kontrol farklı pasajlarda yapılmalıdır. HiPSC’lerle çalışırken, günlük beslenmenin yanı sıra hücre davranışı ve morfoloji izlemesi de gereklidir. Farklılaştırma ortamının sterilitesi, 0,2 μm’lik bir filtre aracılığıyla filtre sterilizasyonu ile sağlanmalıdır. Cilt biyopsisinden hiPSC türevi podositlere kadar tüm protokol birkaç ay sürer, ancak hücreleri işlemin farklı aşamalarında dondurmak mümkündür. Nefron progenitör farklılaşma ortamında 7 gün sonra fibroblastlar, seçilmiş hiPSC klonları ve proliferatif nefron progenitör hücreleri dondurulabilir ve çalışan bir hücre bankası oluşturulabilir.
HiPSC türevli sağlıklı podositler ayrı bir birincil ve sekonder ayak süreçleri ağı geliştirse de (Şekil 5A,B) ve tipik podosit spesifik belirteci eksprese etse de (Şekil 6A-C), in vivo olarak görüldüğü gibi karakteristik yarık diyaframların klasik iki boyutlu hücre kültürü modellerinde taklit edilmesi zordur. Dahası, diğer glomerüler hücre tipleriyle hücreler arası iletişim bu mono-kültür ortamında mümkün değildir.
Terminal farklılaşmış durumları ve proliferasyon kapasitesinin olmaması nedeniyle, podositleri ex vivo olarak incelemek zordur. Koşullu olarak ölümsüzleştirilen birincil podositlerin yardımıyla, ısıya duyarlı bir anahtarın yerleştirilmesiyle bu sınırlamanın üstesinden gelmek mümkündür, bu da hücrelerin 33 ° C’de çoğaldığı ve 37 ° C’de farklılaştığı bir hücre kültürü modeli ile sonuçlanır13,14. Bu siPodositler podosit araştırması için yüksek potansiyele sahip olsalar da, belirteç ekspresyonunun eksikliği, farklılaşmamış morfoloji ve ayak süreçlerinin oluşturulamaması gibi sınırlamalar vardır15,16.
Podositlerin hasta kaynaklı somatik hücrelerden farklılaşması, hastalıklı podositlerin ex vivo sağlıklı kontrol hücreleri ile üretilmesini ve karşılaştırılmasını sağlar. Bu, podosit spesifik genlerdeki mutasyonlara bağlı podosit hasarını incelememizi sağlar. Ayrıca, hiPSC’lerle çalışmak, üç boyutlu hücre kültürü hastalık modelleri, daha doğrusu organoidler43,44 oluşturma potansiyeline sahiptir. HiPSC türevli podositlerin glomerüler endotel hücreleri veya mezangial hücreler gibi diğer glomerüler hücrelerle birlikte kültürlenmesi, sağlık ve glomerüler hastalıkta hücreler arası iletişim konusunda yeni anlayışlara yol açabilir.
Ayrıca, hastaya özgü podositlerin karakterizasyonu ve tedavisi yüksek verim analizinde ex vivo olarak gerçekleştirilebilir. Bireyselleştirilmiş yaklaşım, spesifik mutasyonlar için yeni terapötik hedefleri araştırma ve gelecekte bireyselleştirilmiş tıp yapma fırsatı sunmaktadır.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma, Friedrich-Alexander Üniversitesi Erlangen-Nürnberg Disiplinlerarası Klinik Araştırma Merkezi (IZKF) tarafından Janina Müller-Deile’ye verilen M4-IZKF-F009 hibe numarası ve Janina Müller-Deile’ye verilen 01GM2202D hibe numarası ile STOP-FSGS-Speed Translation-Oriented Progress to Treat FSGS proje adı altında Bundesministerium für Bildung und Forschung (BMBF) tarafından finanse edilmiştir. Annalena Kraus’a SEM görüntülerinin çekilmesindeki desteği için teşekkür ederiz.
Materials
| 0.2 µm sterile filter | Rotilab | P668.1 | for sterilization of differentiation medium |
| all-trans retinoic acid | Stem Cell Technologies | 72262 | supplement for differentiation |
| B27 supplement (50 x), serum free | Gibco | 17504044 | supplement for serum-free differentiation medium |
| BG iMatrix-511 Silk | biogems | RL511S | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Bovine serum albumin (BSA) | Roth | 8076.4 | |
| CELLSTAR Filter Cap Cell Culture Flasks, T75, 250 mL | Greiner bio-one | 82050-856 | cell culture plastics suitable for fibroblast culture |
| CHIR99021 (5 mg) | Sigma-Aldrich | 252917-06-9 | supplement for differentiation |
| Corning Matrigel hESC qualified matrix | Corning | 354277 | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture (solubilized basement membrane matrix) |
| countess Cell Counting Chamber Slides | Invitrogen | C10283 | to count cells |
| countess II FL Automated Cell Counter | Invitrogen | to count cells | |
| cryoPure tubes, 2 ml, QuickSeal screw cap, white | Sarstedt | 72380 | cryovials for freezing of cells |
| dimethyl sulfoxide (DMSO) | Roth | A994.1 | for fibroblast freezing medium |
| DMEM/F12 (1:1) (1 x) | Gibco | 11320074 | basic medium for differentiation |
| DMEM/F12 + Glutamax | Gibco | 10565018 | basic medium for fibroblast medium |
| EVOS M5000 Imaging System | Thermo Fisher Scientific | AMF5000 | phase contrast microscope |
| fetal bovine serum premium, inactivated (FCS) | PAN Biotech | P301902 | serum for fibroblast medium, fibroblast freezing medium and podocyte maintenance medium |
| fisherbrand Electroporation Cuvettes Plus, 4 mm gap, 800 µL capacity, sterile | Fisherbrand | FB104 | cuvette used for electroporation/episomal reprogramming of fibroblasts (4mm gap) |
| fluoromount-G Mounting Medium, with DAPI | Invitrogen | 00-4959-52 | mounting medium containing dapi |
| gauge needle (0.6 x 30 mm) | BD Microlance3 | 300700 | for separation of hiPSC colonies into small pieces |
| human Recombinant Activin A Protein | 78001.1 | Stem cell technologies | supplement for differentiation |
| human recombinant bone morphogenetic protein 7 (BMP7) | Peprotech | 120-03P | supplement for differentiation |
| human VEGF-165 Recombinant Protein | Thermo Scientific | PHC9394 | supplement for differentiation |
| insulin-transferrin-selenium (ITS -G) (100 x) | Gibco | 41400045 | supplement for podocyte maintenance medium |
| LB medium | Roth | X964.1 | for sterility test of hiPSC culture |
| lookOut Mycoplasma PCR Detection Kit | Sigma Aldrich | MP0035-1KT | commercial mycoplasma detection kit |
| microscope slides | Diagonal GmbH & Co.KG | 21,102 | |
| microtube 1.5 mL | Sarstedt | 72706400 | |
| mTeSR1 Complete Kit | Stem Cell Technologies | 85850 | basic medium for serum-free hiPSC culture medium |
| nalgene freezing container Mr.Frosty | Roth | AC96.1 | to ensure optimal freezing conditions |
| normal goat serum | abcam | ab 7481 | for preincubation solution and antibody diluent |
| nunc 24 well plates | Thermo Scientific | 142485 | cell culture plastics suitable for hiPSC culture |
| nunc 48 well plates | Thermo Scientific | 152640 | cell culture plastics suitable for hiPSC culture |
| nunc 6 well plates | Thermo Scientific | 140685 | cell culture plastics suitable for hiPSC culture |
| nunc EasYDish Dishes 100 mm | Thermo Scientific | 150466 | cell culture plastics suitable for hiPSC culture |
| nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Scientific | 167008 | cell culture plastics suitable for hiPSC culture |
| nutriFreez D10 Cryopreservation Medium | Sartorius | 05-713-1E | serum-free cryopreservation medium for cryopreservation of hiPSC and nephron progenitor cells |
| Opti-MEM | Gibco | 11058021 | electroporation medium |
| pCXLE-hMLN | Addgene | #27079 | plasmid for episomal reprogramming |
| pCXLE-hOCT3/4 plasmid | Addgene | #27077 | plasmid for episomal reprogramming |
| pCXLE-hSK plasmid | Addgene | #27078 | plasmid for episomal reprogramming |
| penicillin-streptomycin | Sigma-Aldrich | P4333-100ML | to avoid bacterial contamination |
| plastic coverslips | Sarstedt | 83.1840.002 | for immunofluorescent stainings of hiPSCs and hiPSC-derived podocytes |
| ROTI Histofix | Roth | P087.3 | commercial paraformaldehyde (4 %) for fixation of cells |
| RPMI 1640 + L-Glutamine | Gibco | 21875034 | basic medium for podocyte maintenance medium |
| staining chamber StainTray Black lid | Roth | HA51.1 | |
| stemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | enzymatic cell detachment solution used for dissociation of hiPSCs |
| sterile phosphate buffered saline (PBS) (1 x) | Gibco | 14190094 | used for washing and coating |
| sterile water | Roth | T1432 | |
| syringe without needle 20 mL | BD Plastipak | 300629 | to filter sterilize differentiation medium |
| TC dish 100 mm | Sarstedt | 8,33,902 | sterile cell culture plastics used for cutting the skin biopsy and fibroblast culture |
| TC dish 35 mm | Sarstedt | 8,33,900 | sterile cell culture plastics used for outgrowing fibroblasts from skin biopsy |
| triton X 100 | Roth | 3051.3 | for preincubation solution |
| trypan Blue Stain (0.4 %) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | to count cells |
| trypsin-EDTA (10 x) | Biowest | X0930-100 | dissociation reagent used for fibroblasts and nephron progenitor cells |
| tube 15 mL | Greiner bio-one | 188271-N | |
| tube 50 mL | Greiner bio-one | 227261 | |
| vitronectin ACF | Sartorius | 05-754-0002 | extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Y-27632 dihydrochloride (10 mg) | Tocris | 1254 | to avoid apoptosis of hiPSCs during splitting |
| Primary antibodies | |||
| OCT4 | Stem Cell Technologies | 60093.1 | pluripotency marker, dilution 1:200 |
| SSEA-4 | Stem Cell Technologies | 60062FI.1 | pluripotency marker, dilution 1:100 |
| Ki67 | Abcam | ab15580 | proliferation marker, dilution 1:300 |
| synaptopodin | Proteintech | 21064-1-AP | podocyte-specific marker, dilution 1:200 |
| nephrin | Progen | GP-N2 | podocyte-specific marker, dilution 1:25 |
| podocin | proteintech | 20384-1-AP | podocyte-specific marker, dilution 1:100 |
| Secondary antibodies | |||
| goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21435 | secondary anditbody, dilution 1:1000 |
| alexa Fluor 647 Goat Anti-Rabbit SFX Kit, highly cross-adsorbed | Invitrogen | A31634 | secondary anditbody, dilution 1:1000 |
| donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A21206 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21422 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11001 | secondary anditbody, dilution 1:1000 |
References
- Mundel, P., et al. Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines. Experimental Cell Research. 236 (1), 248-258 (1997).
- Grgic, I., et al. Imaging of podocyte foot processes by fluorescence microscopy. Journal of the American Society of Nephrology. 23 (5), 785-791 (2012).
- Grahammer, F., Schell, C., Huber, T. B. The podocyte slit diaphragm-from a thin grey line to a complex signalling hub. Nature Reviews Nephrology. 9 (10), 587-598 (2013).
- Deen, W. M., Lazzara, M. J., Myers, B. D. Structural determinants of glomerular permeability. American Journal of Physiology. Renal Physiology. 281 (4), F579-F596 (2001).
- Schell, C., Huber, T. B. The evolving complexity of the podocyte cytoskeleton. Journal of the American Society of Nephrology. 28 (11), 3166-3174 (2017).
- Muller-Deile, J., Schiffer, M. Podocyte directed therapy of nephrotic syndrome-can we bring the inside out. Pediatric Nephrology. 31 (3), 393-405 (2016).
- Boehlke, C., et al. Hantavirus infection with severe proteinuria and podocyte foot-process effacement. American Journal of Kidney Diseases. 64 (3), 452-456 (2014).
- Schiffer, M., et al. Pharmacological targeting of actin-dependent dynamin oligomerization ameliorates chronic kidney disease in diverse animal models. Nature Medicine. 21 (6), 601-609 (2015).
- Kopp, J. B., et al. Podocytopathies. Nature Reviews. Disease Primers. 6 (1), 68 (2020).
- Wiggins, R. C. The spectrum of podocytopathies: a unifying view of glomerular diseases. Kidney International. 71 (12), 1205-1214 (2007).
- Mundel, P., Reiser, J., Kriz, W. Induction of differentiation in cultured rat and human podocytes. Journal of the American Society of Nephrology. 8 (5), 697-705 (1997).
- Jat, P. S., et al. Direct derivation of conditionally immortal cell lines from an H-2Kb-tsA58 transgenic mouse. Proceedings of the National Academy of Sciences. 88 (12), 5096-5100 (1991).
- Saleem, M. A., et al. A conditionally immortalized human podocyte cell line demonstrating nephrin and podocin expression. Journal of the American Society of Nephrology. 13 (3), 630-638 (2002).
- Eto, N., et al. Podocyte protection by darbepoetin: preservation of the cytoskeleton and nephrin expression. Kidney International. 72 (4), 455-463 (2007).
- Krtil, J., Platenik, J., Kazderova, M., Tesar, V., Zima, T. Culture methods of glomerular podocytes. Kidney & Blood Pressure Research. 30 (3), 162-174 (2007).
- Chittiprol, S., Chen, P., Petrovic-Djergovic, D., Eichler, T., Ransom, R. F. Marker expression, behaviors, and responses vary in different lines of conditionally immortalized cultured podocytes. American Journal of Physiology. Renal Physiology. 301 (3), F660-F671 (2011).
- Shih, N. Y., et al. CD2AP localizes to the slit diaphragm and binds to nephrin via a novel C-terminal domain. The American Journal of Pathology. 159 (6), 2303-2308 (2001).
- Yan, K., Khoshnoodi, J., Ruotsalainen, V., Tryggvason, K. N-linked glycosylation is critical for the plasma membrane localization of nephrin. Journal of the American Society of Nephrology. 13 (5), 1385-1389 (2002).
- Sir Elkhatim, R., Li, J. Y., Yong, T. Y., Gleadle, J. M. Dipping your feet in the water: podocytes in urine. Expert Review of Molecular Diagnostics. 14 (4), 423-437 (2014).
- Camici, M. Urinary detection of podocyte injury. Biomedicine & Pharmacotherapy. 61 (5), 245-249 (2007).
- Muller-Deile, J., et al. Overexpression of preeclampsia induced microRNA-26a-5p leads to proteinuria in zebrafish. Scientific Reports. 8 (1), 3621 (2018).
- Schenk, H., et al. Removal of focal segmental glomerulosclerosis (FSGS) factor suPAR using CytoSorb. Journal of Clinical Apheresis. 32 (6), 444-452 (2017).
- Petermann, A., Floege, J. Podocyte damage resulting in podocyturia: a potential diagnostic marker to assess glomerular disease activity. Nephron. Clinical Practice. 106 (2), c61-c66 (2007).
- Vogelmann, S. U., Nelson, W. J., Myers, B. D., Lemley, K. V. Urinary excretion of viable podocytes in health and renal disease. American Journal of Physiology. Renal Physiology. 285 (1), F40-F48 (2003).
- Petermann, A. T., et al. Podocytes that detach in experimental membranous nephropathy are viable. Kidney International. 64 (4), 1222-1231 (2003).
- Sakairi, T., et al. Conditionally immortalized human podocyte cell lines established from urine. American Journal of Physiology. Renal Physiology. 298 (3), F557-F567 (2010).
- Rauch, C., et al. Differentiation of human iPSCs into functional podocytes. PLoS One. 13 (9), e0203869 (2018).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1, 0069 (2017).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2 (12), 3081-3089 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Teshigawara, R., Cho, J., Kameda, M., Tada, T. Mechanism of human somatic reprogramming to iPS cell. Laboratory Investigation. 97 (10), 1152-1157 (2017).
- Bang, J. S., et al. Optimization of episomal reprogramming for generation of human induced pluripotent stem cells from fibroblasts. Animal Cells and Systems. 22 (2), 132-139 (2018).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8 (5), 409-412 (2011).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Vangipuram, M., Ting, D., Kim, S., Diaz, R., Schule, B. Skin punch biopsy explant culture for derivation of primary human fibroblasts. Journal of Visualized Experiments. (77), e3779 (2013).
- Hoffding, M. K., Hyttel, P. Ultrastructural visualization of the Mesenchymal-to-Epithelial Transition during reprogramming of human fibroblasts to induced pluripotent stem cells. Stem Cell Research. 14 (1), 39-53 (2015).
- Bharathan, S. P., et al. Systematic evaluation of markers used for the identification of human induced pluripotent stem cells. Biology Open. 6 (1), 100-108 (2017).
- Scholzen, T., Gerdes, J. The Ki-67 protein: from the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Vaz, I. M., et al. Chromosomal aberrations after induced pluripotent stem cells reprogramming. Genetics and Molecular Biology. 44 (3), 20200147 (2021).
- Reiser, J., Altintas, M. M. Podocytes. F1000Research. 5, 114 (2016).
- Ohmori, T., et al. Impaired NEPHRIN localization in kidney organoids derived from nephrotic patient iPS cells. Scientific Reports. 11 (1), 3982 (2021).
- Morizane, R., Bonventre, J. V. Generation of nephron progenitor cells and kidney organoids from human pluripotent stem cells. Nature Protocols. 12 (1), 195-207 (2017).

