피부 생검에서 환자 유래 Podocytes의 생성
Summary
이 원고는 인간 유도 만능 줄기 세포(hiPSC)로의 에피솜 재프로그래밍과 후속 족세포로의 분화를 통해 진피 섬유아세포에서 환자 특이적 족세포를 생성하는 2단계 프로토콜을 설명합니다.
Abstract
Podocytes는 사구체의 선택적 필터 기능에 기여하는 사구체 여과 장벽의 요로 부위에 있는 상피 세포입니다. 족세포 특이적 유전자의 돌연변이는 국소 분절 사구체 경화증(FSGS)을 유발할 수 있으며 족세포는 다른 많은 원발성 및 이차성 신병증에서도 영향을 받습니다. 이들의 분화된 특성으로 인해, 일차 세포 배양 모델은 족세포에 대해 제한적이다. 따라서 일반적으로 조건부로 불멸화 된 세포가 사용됩니다. 그러나, 이러한 조건부로 불멸화 된 족세포 (ciPodocytes)는 몇 가지 한계를 갖는다 : 세포는 배양에서 탈분화 될 수 있으며, 특히 합류도에 도달 할 때, 그리고 몇몇 족세포 특이 적 마커는 약간만 또는 전혀 발현되지 않는다. 이것은 ciPodocytes의 사용과 생리학적, 병태생리학적 및 임상적 도달 가능성에 의문을 제기합니다. 여기에서 우리는 피부 섬유아세포를 hiPSC로 에피솜 재프로그래밍하고 후속 족세포로 분화하여 피부 펀치 생검에서 환자 특이적 족세포를 포함한 인간 족세포 생성을 위한 프로토콜을 설명합니다. 이러한 족세포는 발 과정의 발달 및 족세포 특이적 마커의 발현과 같은 형태학적 특성 측면에서 생체 내 족세포와 훨씬 더 유사합니다. 마지막으로, 그러나 중요한 것은 이러한 세포가 환자의 돌연변이를 유지하여 개별화된 접근 방식으로 족세포 질환 및 잠재적인 치료 물질을 연구하기 위한 개선된 생체 외 모델을 제공한다는 것입니다.
Introduction
Podocytes는 사구체 기저막(GBM), 사구체 내피 세포 및 글리코칼릭스와 함께 신장의 사구체 여과 장벽을 형성하는 특수화된 유사분열 후 신장 상피 세포입니다. 표현형적으로, 족세포는 세포체와 1차, 미세소관 구동 막 확장뿐만 아니라 발 과정 1,2라고 하는 2차 확장으로 구성됩니다. 혈액에서 소변을 걸러내는 사구체 여과 장벽은 천공 내피, GBM 및 podoctyes3의 슬릿 다이어프램이라고 하는 인접한 족세포 발 돌기를 연결하는 특수한 유형의 세포간 접합부로 구성됩니다. 건강한 조건에서 알부민보다 큰 단백질은 크기와 전하로 인해 여과 장벽에서 유지됩니다4.
세포골격 또는 족세포 특이적 유전자의 돌연변이 및 족세포 신호 전달 경로에 영향을 미치는 순환 인자는 족세포 소실, 박리 또는 세포자멸사멸을 유도하여 단백뇨 및 사구체 경화증을 유발하는 것으로 알려져 있습니다. 특히, 세포골격 재배열, 족세포 극성의 변화 또는 슬릿 접합부의 손실과 관련된 발 돌기의 손상이 중추적인역할을 한다 5. 말기 분화 된 상태로 인해, 족세포는 GBM의 분리 후에 거의 대체 될 수 없다. 그러나, 족세포가 GBM에 부착되어 있다면, 그들은 여전히 소실로부터 회복 될 수 있고 interdigitating foot processes 6,7,8을 개혁 할 수있다. 다양한 사구체 장애에서 족세포 손상을 유발하는 사건에 대한 추가 이해는 이러한 질병에 대한 치료법 개발에 도움이 될 새로운 치료 표적을 제공할 수 있습니다. Podocyte 손상은 국소 분절 사구체 경화증(FSGS), 당뇨병성 신병증, 최소 변화 질환 및 막 사구체신병증을 포함한 다양한 사구체 질환의 특징이며, 이러한 질병에 대한 병리학적 메커니즘 및 잠재적 치료 접근법을 연구하기 위해 신뢰할 수 있는 족세포 생체 외 모델이 필요합니다 9,10. Podocytes는 차등 체질에 의한 사구체의 분리에 기초한 고전적인 1차 세포 배양에 의해 생체 외에서 연구될 수 있다11. 그러나, 제한된 증식 능력을 갖는 말기 분화 상태로 인해, 대부분의 연구자들은 SV40 거대 T 항원의 온도에 민감한 변이체를 발현하는 마우스 또는 인간 ciPodocyte 세포주를 사용한다. 대안적으로, ciPodocytes는 SV40 태그 불멸화 유전자 1,12를 보유하는 형질전환 마우스로부터 분리된다.
CiPodocytes는 33 °C에서 증식하지만, 성장 정지에 들어가 37 °C에서 분화를 시작한다13,14. 이러한 세포로 얻은 실험 데이터는 세포가 부자연스러운 유전자 삽입(15)을 사용하여 생성되기 때문에 어느 정도 주의해서 해석되어야 한다는 점을 명심해야 한다. 이 세포들은 불멸화 유전자를 가지고 있기 때문에, 지속적인 증식으로 인해 세포 생리학이 변화된다12. 이 접근법에 의해 생성된 Podocyte 세포주는 마우스, 인간 및 쥐 ciPodocytes가 사구체 발현16과 비교하여 mRNA 수준에서 NPHS1 및 NPHS2뿐만 아니라 단백질 수준에서 시냅토포딘 및 네프린의 5% 미만을 발현하기 때문에 최근에 의문이 제기되었습니다. 또한, 대부분의 족세포 세포주는 네프린17,18을 발현하지 않습니다. Chittiprol et al. 또한 ciPodocytes에서 세포 운동성과 퓨로마이신과 독소루비신에 대한 반응의 유의미한 차이를 설명했다16. Podocytes는 다른 사구체 질환 19,20,21,22에서 GBM에서 분리 된 후 소변에서 발견 될 수 있습니다. 생존 가능한 요족세포는 생체 외에서 최대 2-3주 동안 배양할 수 있지만 대부분의 세포는 세포자멸사를 겪습니다23,24. 흥미롭게도, 족세포는 사구체 질환 환자의 소변뿐만 아니라 건강한 피험자의 소변에서도 발견되며, 배양물에서 복제 가능성이 제한적인 노화 상태일 가능성이 높다24. 또한, 소변 유래 족세포 수는 제한되어 있고, 세포는 배양에서 탈분화되고, 발 과정이 적고, 형태가 변화하며, 가장 중요한 것은 제한된 증식 능력을 갖는다는 것입니다. 족세포 특이적 유전자의 발현은 부재하거나, 몇 주 이내에 사라지거나, 이러한 세포 클론 간에 다양합니다. 족세포 특이적 마커에 대해 양성인 일부 세포는 관상 상피 세포 또는 근섬유아세포와 간질 세포의 마커를 공동 발현했으며, 이는 배양된 요족세포의 탈분화 및/또는 형질전환을 시사한다24,25.
최근, 온도 민감성 SV40 거대 T 항원 및 hTERT로 형질도입에 의해 환자 및 건강한 자원자의 소변으로부터 유래된 ciPodocyte 세포주의 생성이 기술되었다26. 시냅토포딘, 네스틴 및 CD2 관련 단백질에 대한 mRNA 발현은 검출되었지만, 포도신 mRNA는 모든 클론에서 없었다. 비뇨기 족 세포의 문제 외에도,이 세포들은 또한 삽입 된 불멸화 유전자를 포함하고있어 위에서 논의한 단점을 초래합니다.
대조적으로, 인간 유도 만능 줄기 세포(hiPSC)는 적절한 조건에서 자가 재생 및 여러 세포 유형으로 분화할 수 있는 엄청난 능력을 가지고 있습니다. hiPSC가 족세포의 거의 무제한적인 공급원 역할을 할 수 있다는 것이 이전에 밝혀졌습니다27,28.
여기에서는 피부 펀치 생검의 진피 섬유아세포에서 환자 특이적 족세포를 생성하고 후속 에피솜을 hiPSC로 재프로그래밍하고 hiPSC 유래 족세포로의 최종 분화를 설명하는 2단계 프로토콜이 설명됩니다(그림 1).
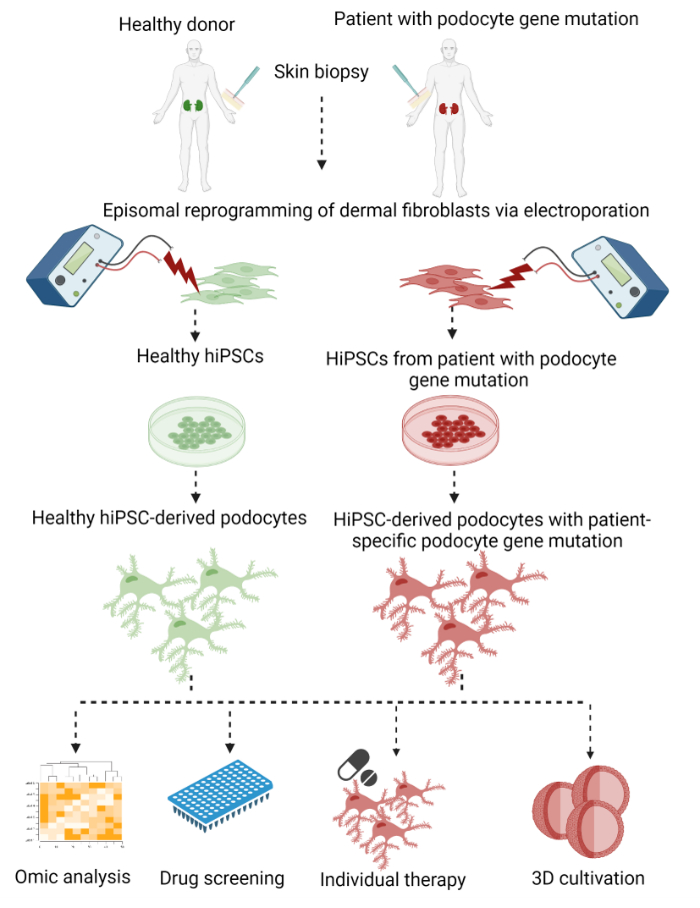
그림 1: 환자 특이적 hiPSC 유래 족세포를 생성하는 프로토콜. hiPSC로 재프로그래밍하고 족세포로 분화하여 피부 생검의 진피 섬유아세포에서 환자 특이적 족세포를 생성하는 프로토콜의 그래픽 개요. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
첫 번째 단계로, 체세포 진피 섬유아세포는 피부 펀치 생검에서 성장하여 전사 인자 OCT3/4, KLF4, SOX2 및 c-MYC 29,30,31을 발현하는 플라스미드로 전기천공에 의한 통합이 없는 방법을 사용하여 hiPSC로 재프로그래밍되었습니다. 이후 발생하는 hiPSC 콜로니를 선택하고 확장했습니다. 분화는 WNT 신호 전달 경로의 활성화에 의한 중배엽 계통의 유도로 시작되었고, 이어서 여전히 증식할 수 있는 네프론 전구 세포의 생성이 뒤따랐습니다. 마지막으로, 세포를 족세포로 분화시켰다. 이 절차에서 우리는 Bang et al.32 및 Okita et al.33에 의해 hiPSC 생성을 위한 에피솜 재프로그래밍을 위해 이전에 발표된 프로토콜과 Musah et al.28,34,35에 의해 hiPSC를 족세포로 분화하기 위한 프로토콜을 수정하고 결합했습니다.
실제로, 우리의 프로토콜에 의해 생성된 족세포는 1차 및 2차 발 과정의 뚜렷한 네트워크의 발달과 시냅토포딘, 포도신 및 네프린과 같은 족세포 특이적 마커의 발현과 관련하여 생체 내 족세포에 더 가까운 표현형을 가졌습니다. hiPSC 유래 족세포를 사용하여 환자의 유전적 배경이 재프로그래밍 및 분화 중에 유지됩니다. 이를 통해 환자 특이적 족세포 질환 모델링과 거의 무제한의 세포 수에서 생체 외 에서 잠재적인 치료 물질을 발견할 수 있습니다. 또한, 이 프로토콜은 최소 침습적이고, 비용 효율적이며, 윤리적으로 수용 가능하며, 약물 개발을 위한 새로운 길을 촉진할 수 있습니다.
Protocol
Representative Results
Discussion
이 세포 배양 기반 프로토콜은 인간 진피 섬유아세포의 에피솜 재프로그래밍을 환자 특이적 hiPSC로 재프로그래밍하고 이후 hiPSC 유래 족세포로 분화하는 것을 결합합니다. 이를 통해 족세포 손상과 관련하여 유전적 사구체 질환이 있는 환자의 족세포의 돌연변이 관련 변화를 연구할 수 있습니다. 전기천공에 의한 무통합 방법으로 진피 섬유아세포를 재프로그래밍하는 프로토콜은 Bang et al.32 및 Okita et al.33의 발표된 연구에서 채택되었습니다. 족세포를 hiPSC와 구별하기 위한 프로토콜은 Musah et al.28,34,35의 공개된 프로토콜에서 채택되었습니다. hiPSC 27,34,35에서 족세포의 생성을 설명하는 간행물이 이미 있습니다. 그러나 여기에 제공된 프로토콜은 hiPSC를 족세포로 분화하는 것과 관련하여 최적화되고 저렴합니다. Musah et al.에서 발표한 프로토콜과 비교하여 비트로넥틴, 라미닌 실크-511 및 가용화된 기저막 매트릭스와 같은 다양한 코팅 시약에서 이 프로토콜을 테스트했습니다. 비트로넥틴과 라미닌 실크-511의 농도는 5 μg/mL 대신2.5 μg/mL로 감소될 수 있습니다 28,34,35. 또한, 매우 비싼 두 가지 성장 인자인 BMP7과 액티빈 A의 농도를 100ng/mL에서 50ng/mL로 50% 감소시킬 수 있었습니다.
이를 통해 더 저렴한 차별화가 가능합니다. 7일째부터 네프론 전구 세포는 여전히 증식하고 있었고, 동결의 가능성은 이전에 나타났다. 우리는 해동 후 최종 분화 전에 Dulbecco의 변형 된 Eagle 배지 (DMEM)와 B27을 포함하는 염기성 배지에서 며칠 동안 이러한 세포를 확장하여 비용을 더욱 줄였습니다. 분화 단계 외에도 이 프로토콜은 에피솜 재프로그래밍을 통해 환자 특이적 hiPSC의 후속 생성과 함께 피부 생검에서 섬유아세포의 성장을 설명합니다. 이 두 가지 방법의 조합은 환자 특이적 족세포의 생성을 가능하게 합니다. 따라서, 이전에 상세히 설명되지 않았던 환자 특이적 hiPSC 유래 족세포를 생성하기 위한 완전한 단계별 프로토콜이 여기에 제공된다.
전체 프로토콜에는 여러 가지 다른 세포 유형이 포함되기 때문에 생성된 세포 유형을 서로 다른 단계에서 특성화하는 것이 중요합니다. 세포는 오랜 기간 동안 배양되므로 품질 관리는 다른 계대에서 수행되어야 합니다. hiPSC로 작업할 때는 세포 행동 및 형태 모니터링뿐만 아니라 일일 공급이 필요합니다. 분화 배지의 무균성은 0.2μm 필터를 통한 필터 멸균으로 보장되어야 합니다. 피부 생검에서 hiPSC 유래 족세포에 이르기까지 전체 프로토콜은 몇 개월이 걸리지만 과정의 뚜렷한 단계에서 세포를 동결시킬 수 있습니다. 섬유아세포, 선별된 hiPSC 클론 및 증식성 네프론 전구세포를 네프론 전구체 분화 배지에서 7일 후에 동결시킬 수 있고, 작동하는 세포 은행을 생성할 수 있다.
hiPSC 유래의 건강한 족세포는 1차 및 2차 발 과정의 뚜렷한 네트워크를 개발하고(그림 5A, B) 전형적인 족세포 특이적 마커(그림 6A-C)를 발현하지만, 생체 내에서 볼 수 있듯이 특징적인 슬릿 다이어프램은 고전적인 2차원 세포 배양 모델에서 모방하기 어렵습니다. 또한, 다른 사구체 세포 유형과의 세포 간 통신은 이 단일 배양 환경에서 불가능합니다.
말단 분화 상태와 증식 능력의 부족으로 인해 생체 외에서 족세포를 연구하는 것은 어렵습니다. 조건부로 불멸화하는 일차 족세포의 도움으로 온도감응성 스위치를 삽입하여 이러한 한계를 극복할 수 있으며, 그 결과 세포가 33°C에서 증식하고 37°C에서 분화하는 세포 배양 모델이 생성됩니다13,14. 이러한 ciPodocytes는 족세포 연구에 대한 높은 잠재력을 가지고 있지만, 마커 발현의 부족, 탈분화 형태 및 발 과정 형성 실패와 같은 한계가 있습니다15,16.
환자 유래 체세포에서 족세포를 분화하면 생체 외에서 병에 걸린 족세포를 생성하고 건강한 조절 세포와 비교할 수 있습니다. 이를 통해 족세포 특이적 유전자의 돌연변이로 인한 족세포 손상을 연구할 수 있습니다. 또한, hiPSC로 작업하면 3차원 세포 배양 질환 모델 또는 오가노이드를 생성할 수 있는 잠재력이 있습니다43,44. hiPSC 유래 족세포를 사구체 내피 세포 또는 간질 세포와 같은 다른 사구체 세포와 공동 배양하면 건강 및 사구체 질환에서 세포 간 통신에 관한 새로운 통찰력을 얻을 수 있습니다.
또한, 환자 특이적 족세포의 특성화 및 치료는 고처리량 분석에서 생체 외 에서 수행될 수 있습니다. 개별화된 접근 방식은 특정 돌연변이에 대한 새로운 치료 표적을 조사하고 미래에 개별화된 의학을 수행할 수 있는 기회를 제공합니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 Friedrich-Alexander University Erlangen-Nürnberg의 Interdisciplinary Center for Clinical Research(IZKF)에서 Janina Müller-Deile에게 부여된 보조금 번호 M4-IZKF-F009와 Bundesministerium für Bildung und Forshung(BMBF)에서 프로젝트 이름 STOP-FSGS-Speed Translation-Oriented Progress to Treat FSGS, 보조금 번호 01GM2202D로 Janina Müller-Deile에게 주어졌습니다. SEM 이미지 촬영을 지원해 주신 Annalena Kraus에게 감사드립니다.
Materials
| 0.2 µm sterile filter | Rotilab | P668.1 | for sterilization of differentiation medium |
| all-trans retinoic acid | Stem Cell Technologies | 72262 | supplement for differentiation |
| B27 supplement (50 x), serum free | Gibco | 17504044 | supplement for serum-free differentiation medium |
| BG iMatrix-511 Silk | biogems | RL511S | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Bovine serum albumin (BSA) | Roth | 8076.4 | |
| CELLSTAR Filter Cap Cell Culture Flasks, T75, 250 mL | Greiner bio-one | 82050-856 | cell culture plastics suitable for fibroblast culture |
| CHIR99021 (5 mg) | Sigma-Aldrich | 252917-06-9 | supplement for differentiation |
| Corning Matrigel hESC qualified matrix | Corning | 354277 | additional option of extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture (solubilized basement membrane matrix) |
| countess Cell Counting Chamber Slides | Invitrogen | C10283 | to count cells |
| countess II FL Automated Cell Counter | Invitrogen | to count cells | |
| cryoPure tubes, 2 ml, QuickSeal screw cap, white | Sarstedt | 72380 | cryovials for freezing of cells |
| dimethyl sulfoxide (DMSO) | Roth | A994.1 | for fibroblast freezing medium |
| DMEM/F12 (1:1) (1 x) | Gibco | 11320074 | basic medium for differentiation |
| DMEM/F12 + Glutamax | Gibco | 10565018 | basic medium for fibroblast medium |
| EVOS M5000 Imaging System | Thermo Fisher Scientific | AMF5000 | phase contrast microscope |
| fetal bovine serum premium, inactivated (FCS) | PAN Biotech | P301902 | serum for fibroblast medium, fibroblast freezing medium and podocyte maintenance medium |
| fisherbrand Electroporation Cuvettes Plus, 4 mm gap, 800 µL capacity, sterile | Fisherbrand | FB104 | cuvette used for electroporation/episomal reprogramming of fibroblasts (4mm gap) |
| fluoromount-G Mounting Medium, with DAPI | Invitrogen | 00-4959-52 | mounting medium containing dapi |
| gauge needle (0.6 x 30 mm) | BD Microlance3 | 300700 | for separation of hiPSC colonies into small pieces |
| human Recombinant Activin A Protein | 78001.1 | Stem cell technologies | supplement for differentiation |
| human recombinant bone morphogenetic protein 7 (BMP7) | Peprotech | 120-03P | supplement for differentiation |
| human VEGF-165 Recombinant Protein | Thermo Scientific | PHC9394 | supplement for differentiation |
| insulin-transferrin-selenium (ITS -G) (100 x) | Gibco | 41400045 | supplement for podocyte maintenance medium |
| LB medium | Roth | X964.1 | for sterility test of hiPSC culture |
| lookOut Mycoplasma PCR Detection Kit | Sigma Aldrich | MP0035-1KT | commercial mycoplasma detection kit |
| microscope slides | Diagonal GmbH & Co.KG | 21,102 | |
| microtube 1.5 mL | Sarstedt | 72706400 | |
| mTeSR1 Complete Kit | Stem Cell Technologies | 85850 | basic medium for serum-free hiPSC culture medium |
| nalgene freezing container Mr.Frosty | Roth | AC96.1 | to ensure optimal freezing conditions |
| normal goat serum | abcam | ab 7481 | for preincubation solution and antibody diluent |
| nunc 24 well plates | Thermo Scientific | 142485 | cell culture plastics suitable for hiPSC culture |
| nunc 48 well plates | Thermo Scientific | 152640 | cell culture plastics suitable for hiPSC culture |
| nunc 6 well plates | Thermo Scientific | 140685 | cell culture plastics suitable for hiPSC culture |
| nunc EasYDish Dishes 100 mm | Thermo Scientific | 150466 | cell culture plastics suitable for hiPSC culture |
| nunc MicroWell 96-Well, Nunclon Delta-Treated, Flat-Bottom Microplate | Thermo Scientific | 167008 | cell culture plastics suitable for hiPSC culture |
| nutriFreez D10 Cryopreservation Medium | Sartorius | 05-713-1E | serum-free cryopreservation medium for cryopreservation of hiPSC and nephron progenitor cells |
| Opti-MEM | Gibco | 11058021 | electroporation medium |
| pCXLE-hMLN | Addgene | #27079 | plasmid for episomal reprogramming |
| pCXLE-hOCT3/4 plasmid | Addgene | #27077 | plasmid for episomal reprogramming |
| pCXLE-hSK plasmid | Addgene | #27078 | plasmid for episomal reprogramming |
| penicillin-streptomycin | Sigma-Aldrich | P4333-100ML | to avoid bacterial contamination |
| plastic coverslips | Sarstedt | 83.1840.002 | for immunofluorescent stainings of hiPSCs and hiPSC-derived podocytes |
| ROTI Histofix | Roth | P087.3 | commercial paraformaldehyde (4 %) for fixation of cells |
| RPMI 1640 + L-Glutamine | Gibco | 21875034 | basic medium for podocyte maintenance medium |
| staining chamber StainTray Black lid | Roth | HA51.1 | |
| stemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | enzymatic cell detachment solution used for dissociation of hiPSCs |
| sterile phosphate buffered saline (PBS) (1 x) | Gibco | 14190094 | used for washing and coating |
| sterile water | Roth | T1432 | |
| syringe without needle 20 mL | BD Plastipak | 300629 | to filter sterilize differentiation medium |
| TC dish 100 mm | Sarstedt | 8,33,902 | sterile cell culture plastics used for cutting the skin biopsy and fibroblast culture |
| TC dish 35 mm | Sarstedt | 8,33,900 | sterile cell culture plastics used for outgrowing fibroblasts from skin biopsy |
| triton X 100 | Roth | 3051.3 | for preincubation solution |
| trypan Blue Stain (0.4 %) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | to count cells |
| trypsin-EDTA (10 x) | Biowest | X0930-100 | dissociation reagent used for fibroblasts and nephron progenitor cells |
| tube 15 mL | Greiner bio-one | 188271-N | |
| tube 50 mL | Greiner bio-one | 227261 | |
| vitronectin ACF | Sartorius | 05-754-0002 | extracellular matrix reagent used in coating solution to coat cell culture plastics suitable for hiPSC culture |
| Y-27632 dihydrochloride (10 mg) | Tocris | 1254 | to avoid apoptosis of hiPSCs during splitting |
| Primary antibodies | |||
| OCT4 | Stem Cell Technologies | 60093.1 | pluripotency marker, dilution 1:200 |
| SSEA-4 | Stem Cell Technologies | 60062FI.1 | pluripotency marker, dilution 1:100 |
| Ki67 | Abcam | ab15580 | proliferation marker, dilution 1:300 |
| synaptopodin | Proteintech | 21064-1-AP | podocyte-specific marker, dilution 1:200 |
| nephrin | Progen | GP-N2 | podocyte-specific marker, dilution 1:25 |
| podocin | proteintech | 20384-1-AP | podocyte-specific marker, dilution 1:100 |
| Secondary antibodies | |||
| goat anti-Guinea Pig IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21435 | secondary anditbody, dilution 1:1000 |
| alexa Fluor 647 Goat Anti-Rabbit SFX Kit, highly cross-adsorbed | Invitrogen | A31634 | secondary anditbody, dilution 1:1000 |
| donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A21206 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen | A21422 | secondary anditbody, dilution 1:1000 |
| goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | Invitrogen | A11001 | secondary anditbody, dilution 1:1000 |
References
- Mundel, P., et al. Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines. Experimental Cell Research. 236 (1), 248-258 (1997).
- Grgic, I., et al. Imaging of podocyte foot processes by fluorescence microscopy. Journal of the American Society of Nephrology. 23 (5), 785-791 (2012).
- Grahammer, F., Schell, C., Huber, T. B. The podocyte slit diaphragm-from a thin grey line to a complex signalling hub. Nature Reviews Nephrology. 9 (10), 587-598 (2013).
- Deen, W. M., Lazzara, M. J., Myers, B. D. Structural determinants of glomerular permeability. American Journal of Physiology. Renal Physiology. 281 (4), F579-F596 (2001).
- Schell, C., Huber, T. B. The evolving complexity of the podocyte cytoskeleton. Journal of the American Society of Nephrology. 28 (11), 3166-3174 (2017).
- Muller-Deile, J., Schiffer, M. Podocyte directed therapy of nephrotic syndrome-can we bring the inside out. Pediatric Nephrology. 31 (3), 393-405 (2016).
- Boehlke, C., et al. Hantavirus infection with severe proteinuria and podocyte foot-process effacement. American Journal of Kidney Diseases. 64 (3), 452-456 (2014).
- Schiffer, M., et al. Pharmacological targeting of actin-dependent dynamin oligomerization ameliorates chronic kidney disease in diverse animal models. Nature Medicine. 21 (6), 601-609 (2015).
- Kopp, J. B., et al. Podocytopathies. Nature Reviews. Disease Primers. 6 (1), 68 (2020).
- Wiggins, R. C. The spectrum of podocytopathies: a unifying view of glomerular diseases. Kidney International. 71 (12), 1205-1214 (2007).
- Mundel, P., Reiser, J., Kriz, W. Induction of differentiation in cultured rat and human podocytes. Journal of the American Society of Nephrology. 8 (5), 697-705 (1997).
- Jat, P. S., et al. Direct derivation of conditionally immortal cell lines from an H-2Kb-tsA58 transgenic mouse. Proceedings of the National Academy of Sciences. 88 (12), 5096-5100 (1991).
- Saleem, M. A., et al. A conditionally immortalized human podocyte cell line demonstrating nephrin and podocin expression. Journal of the American Society of Nephrology. 13 (3), 630-638 (2002).
- Eto, N., et al. Podocyte protection by darbepoetin: preservation of the cytoskeleton and nephrin expression. Kidney International. 72 (4), 455-463 (2007).
- Krtil, J., Platenik, J., Kazderova, M., Tesar, V., Zima, T. Culture methods of glomerular podocytes. Kidney & Blood Pressure Research. 30 (3), 162-174 (2007).
- Chittiprol, S., Chen, P., Petrovic-Djergovic, D., Eichler, T., Ransom, R. F. Marker expression, behaviors, and responses vary in different lines of conditionally immortalized cultured podocytes. American Journal of Physiology. Renal Physiology. 301 (3), F660-F671 (2011).
- Shih, N. Y., et al. CD2AP localizes to the slit diaphragm and binds to nephrin via a novel C-terminal domain. The American Journal of Pathology. 159 (6), 2303-2308 (2001).
- Yan, K., Khoshnoodi, J., Ruotsalainen, V., Tryggvason, K. N-linked glycosylation is critical for the plasma membrane localization of nephrin. Journal of the American Society of Nephrology. 13 (5), 1385-1389 (2002).
- Sir Elkhatim, R., Li, J. Y., Yong, T. Y., Gleadle, J. M. Dipping your feet in the water: podocytes in urine. Expert Review of Molecular Diagnostics. 14 (4), 423-437 (2014).
- Camici, M. Urinary detection of podocyte injury. Biomedicine & Pharmacotherapy. 61 (5), 245-249 (2007).
- Muller-Deile, J., et al. Overexpression of preeclampsia induced microRNA-26a-5p leads to proteinuria in zebrafish. Scientific Reports. 8 (1), 3621 (2018).
- Schenk, H., et al. Removal of focal segmental glomerulosclerosis (FSGS) factor suPAR using CytoSorb. Journal of Clinical Apheresis. 32 (6), 444-452 (2017).
- Petermann, A., Floege, J. Podocyte damage resulting in podocyturia: a potential diagnostic marker to assess glomerular disease activity. Nephron. Clinical Practice. 106 (2), c61-c66 (2007).
- Vogelmann, S. U., Nelson, W. J., Myers, B. D., Lemley, K. V. Urinary excretion of viable podocytes in health and renal disease. American Journal of Physiology. Renal Physiology. 285 (1), F40-F48 (2003).
- Petermann, A. T., et al. Podocytes that detach in experimental membranous nephropathy are viable. Kidney International. 64 (4), 1222-1231 (2003).
- Sakairi, T., et al. Conditionally immortalized human podocyte cell lines established from urine. American Journal of Physiology. Renal Physiology. 298 (3), F557-F567 (2010).
- Rauch, C., et al. Differentiation of human iPSCs into functional podocytes. PLoS One. 13 (9), e0203869 (2018).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1, 0069 (2017).
- Takahashi, K., Okita, K., Nakagawa, M., Yamanaka, S. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2 (12), 3081-3089 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Teshigawara, R., Cho, J., Kameda, M., Tada, T. Mechanism of human somatic reprogramming to iPS cell. Laboratory Investigation. 97 (10), 1152-1157 (2017).
- Bang, J. S., et al. Optimization of episomal reprogramming for generation of human induced pluripotent stem cells from fibroblasts. Animal Cells and Systems. 22 (2), 132-139 (2018).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8 (5), 409-412 (2011).
- Musah, S., Dimitrakakis, N., Camacho, D. M., Church, G. M., Ingber, D. E. Directed differentiation of human induced pluripotent stem cells into mature kidney podocytes and establishment of a Glomerulus Chip. Nature Protocols. 13 (7), 1662-1685 (2018).
- Burt, M., Bhattachaya, R., Okafor, A. E., Musah, S. Guided differentiation of mature kidney podocytes from human induced pluripotent stem cells under chemically defined conditions. Journal of Visualized Experiments. (161), e61299 (2020).
- Vangipuram, M., Ting, D., Kim, S., Diaz, R., Schule, B. Skin punch biopsy explant culture for derivation of primary human fibroblasts. Journal of Visualized Experiments. (77), e3779 (2013).
- Hoffding, M. K., Hyttel, P. Ultrastructural visualization of the Mesenchymal-to-Epithelial Transition during reprogramming of human fibroblasts to induced pluripotent stem cells. Stem Cell Research. 14 (1), 39-53 (2015).
- Bharathan, S. P., et al. Systematic evaluation of markers used for the identification of human induced pluripotent stem cells. Biology Open. 6 (1), 100-108 (2017).
- Scholzen, T., Gerdes, J. The Ki-67 protein: from the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Sun, X., Kaufman, P. D. Ki-67: more than a proliferation marker. Chromosoma. 127 (2), 175-186 (2018).
- Vaz, I. M., et al. Chromosomal aberrations after induced pluripotent stem cells reprogramming. Genetics and Molecular Biology. 44 (3), 20200147 (2021).
- Reiser, J., Altintas, M. M. Podocytes. F1000Research. 5, 114 (2016).
- Ohmori, T., et al. Impaired NEPHRIN localization in kidney organoids derived from nephrotic patient iPS cells. Scientific Reports. 11 (1), 3982 (2021).
- Morizane, R., Bonventre, J. V. Generation of nephron progenitor cells and kidney organoids from human pluripotent stem cells. Nature Protocols. 12 (1), 195-207 (2017).

