단일 핵 멀티옴 분석을 위한 고품질 뇌 및 골수 핵 준비
Summary
single-cell/single-nuclei transcriptomics 및 multi-omics의 성공은 세포/핵의 품질에 크게 좌우됩니다. 따라서 조직에서 세포/핵을 분리하고 정제하는 것은 고도로 표준화되어야 합니다. 이 프로토콜은 다운스트림 단일 핵 다중체 분석을 위해 뇌와 골수에서 핵을 준비하는 방법을 설명합니다.
Abstract
단일 세포 분석은 단일 세포 분해능으로 치료 또는 감염에 대한 개별 세포 반응의 가변성을 평가해야 하는 생물학적 과정의 복잡성을 밝히기 위해 선택되는 접근 방식이 되었습니다.
지난 10년 동안 단세포 분자 프로파일링을 위한 많은 기술이 개발되었으며 여러 전용 기술이 상용화되었습니다. 10X Genomics 액적 기반 단일 세포 프로파일링은 전사체 및 다중 오믹 단일 세포 프로파일링에 즉시 사용할 수 있는 시약을 제공하는 광범위한 기술입니다. 이 기술에는 단일 세포 및 단일 핵 RNA 염기서열 분석(각각 scRNA-Seq 및 snRNA-Seq), scATAC-Seq, 단일 세포 면역 프로파일링(BCR/TCR 염기서열 분석) 및 멀티옴을 위한 워크플로우가 포함됩니다. 후자는 동일한 세포에서 나오는 전사 정보(scRNA-Seq)와 후성유전학적 정보(scATAC-Seq)를 결합합니다.
조직에서 분리되고 이러한 접근 방식으로 분석되는 단일 세포 또는 단일 핵 현탁액의 품질(생존력, 무결성, 순도)은 고품질 데이터를 생성하는 데 매우 중요합니다. 따라서 시료 전처리 프로토콜은 각 생물학적 조직의 특성에 맞게 조정되어야 하며 고품질 세포 및 핵 현탁액의 생성을 보장해야 합니다.
이 기사에서는 다운스트림 멀티오메 10X 유전체학 파이프라인을 위한 뇌 및 골수 샘플을 준비하기 위한 두 가지 프로토콜에 대해 설명합니다. 프로토콜은 단계적으로 수행되며 조직 해리, 세포 분류, 핵 분리 및 세포 분할 및 바코드, 라이브러리 준비 및 염기서열분석을 위한 출발 물질로 사용되는 준비된 핵 현탁액의 품질 관리를 다룹니다. 이러한 표준화된 프로토콜은 고품질 핵 라이브러리와 강력하고 신뢰할 수 있는 데이터를 생성합니다.
Introduction
수년 동안 단일 세포 기술은 생물학적 과정 분석의 황금 표준이었습니다. 처음에는 현미경, 유세포 분석 및 유사한 분석을 통한 단일 세포 표현형으로 제한되었습니다. 단일 세포 분석의 돌파구는 단일 세포 분자 프로파일링, 특히 개별 세포의 전체 전사체를 특성화할 수 있는 단일 세포 RNA 염기서열 분석(scRNA-Seq)을 위한 접근 방식의 개발과 함께 이루어졌습니다. 매우 강력한 scRNA-Seq는 특정 조건 및 시점에서 세포의 전사 상태에 대한 정보를 생성합니다. 그러나 전사를 유도하는 유전자 조절이나 시간이 지남에 따라 발생하는 분자 변형에 대한 가시성은 제공하지 않습니다. 이러한 한계를 극복하기 위해 동일한 세포 1,2,3,4에서 여러 요인과 과정을 분석할 수 있는 단일 세포 다중 오믹스 분석법 개발에 많은 노력을 기울였습니다. 단일 세포 내에서 두 가지 양식에 대한 최초의 성공적인 측정은 CITE-Seq 접근법5에서 다중 표면 단백질 발현 패턴을 개별 세포의 전체 전사체와 연결하는 것을 통해 이루어졌습니다. 보다 최근의 진화는 유전자 발현과 염색질 접근성(염기서열분석을 사용한 Transposase-Accessible Chromatin 분석, ATAC-Seq)을 결합하여 동일한 세포(예: sci-CAR)에서 전사체 및 후성유전체 양식을 동시에 포착합니다6. 전사체학을 세포 표현형 또는 동일한 세포의 후성유전학적 변화와 연관시킬 수 있는 최초의 상용 솔루션은 10X Genomics에서 나왔습니다.
단세포 분자 프로파일링을 위한 실험은 다음 단계를 포함한다: (1) 단세포 현탁액의 조직 해리 또는 준비; (2) 세포 정제 및/또는 핵 분리; (3) 분할 및 바코드; (4) 도서관 건설 및 품질 관리; (5) 차세대 염기서열분석; (6) 데이터 분석. 단계 (3)-(6)은 사용된 기술에 따라 크게 다를 수 있지만 초기 단계는 일반적으로 모든 기술에 공통적입니다. 준비된 세포/핵 현탁액의 품질은 실험의 전반적인 결과를 결정합니다. 조직의 유형에 따라 고품질 단세포/핵 현탁액을 얻는 것이 어려울 수 있습니다. 심장, 근육, 뇌, 폐, 장 등과 같은 일부 조직의 특이성으로 인해 분자 분석을 위한 고품질 핵 생성을 보장하기 위해 각 유형의 시료에 적합한 조직 파괴 및 핵 분리 방법이 필요합니다 7,8,9,10 . 조직 파괴 방법 및 해리 프로토콜은 기계적, 효소적(예: 콜라겐 분해 효소와 DNase의 혼합) 또는 이 둘의 조합일 수 있으며 수동으로 또는 기기(예: Qiagen DSC-400, gentleMACS)로 수행할 수 있습니다.
단세포 기술은 생물의학 연구를 위한 선택 도구가 되었습니다. 신경생물학에서 뇌의 세포 다양성과 기능의 복잡성은 희귀 세포 집단의 시각화와 이질성을 평가하기 위해 고해상도 및 고처리량 분석을 필요로 합니다 11,12,13,14. 개별 세포의 세포 정체성과 유전자 조절 메커니즘을 연결하면 뇌 발달 및 생리학에 대한 통찰력을 얻을 수 있습니다. 또 다른 예는 단일 세포 분석에 크게 의존하는 감염성, 자가면역 또는 암 질환의 맥락에서 면역 반응에 대한 연구입니다. 면역 세포 subset의 이질성과 그 활성의 복잡성 및 다른 세포 유형과의 상호 작용으로 인해 면역 반응의 기전을 해독하기 위해서는 단일 세포 분해능이 필요합니다. 면역 세포는 골수에서 유래하며, 조혈 전구 세포는 골수를 벗어나 말초의 집으로 이동하기 전에 단계적 과정을 통해 세포 표면 마커를 획득하고 잃는 점진적인 분화 세포로 구성됩니다. 단일 세포 분석을 통해 세포 발달 단계의 미세한 특성 분석이 가능합니다. 이는 단일 세포 표현형을 통해 달성할 수 있으며, 일반적으로 다중 파라미터 유세포 분석으로 수행됩니다. 그러나, 단일세포 전사체 서명은 전구세포 아형의 보다 정확한 식별을 나타내는 것으로 나타났는데, 이는 이들 세포가 서로 떨어지는 클러스터로 분포되어 있기 때문에 거친 세포 표면 마커 접근법15을 사용할 때 오식별될 수 있기 때문입니다. 점점 더 많은 연구에서 조혈모세포와 전구세포(HSPC)가 다양한 약제에 노출되어 면역체계의 장기적 반응성에 상당한 영향을 미칠 수 있는 후성유전학적 변형이 밝혀지고 있습니다 16,17,18,19. 새로운 다중 오믹스 기술을 통해 단일 세포 분해능으로 이러한 프로세스를 연구할 수 있습니다.
세포 및 핵 분리를 위한 많은 프로토콜이 뇌(11,20,21,22) 및 골수 샘플(23,24)에 대해 기술되어 있다. 실험적 변동성으로 인한 편향을 최소화하려면 공동 단세포 전사체 및 후성유전체 염기서열분석을 위해 최적화된 단핵항체 전처리 프로토콜을 검증하여 단세포 다중생물 분석의 재현성을 보장해야 합니다.
여기에서는 다운스트림 단일 세포 멀티옴 분석을 위한 (1) 신선 냉동 뇌 조직 및 (2) 신선 골수 HSPC에서 핵 준비를 위한 두 가지 강력한 프로토콜이 설명되어 있습니다(그림 1).
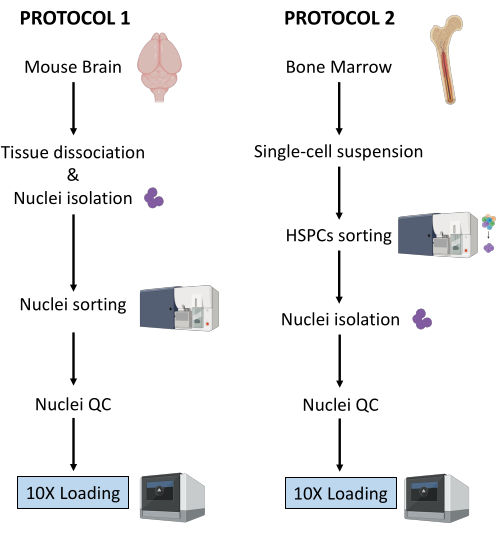
그림 1: 신선 냉동 뇌 및 골수 조직에서 핵 분리를 위한 프로토콜의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
고품질 세포 또는 핵 현탁액의 준비는 단일 세포 또는 단일 핵 RNA-Seq 및 단일 세포 다중 오믹 분석의 성공에 매우 중요합니다 29,30,31. 여기에서는 뇌와 골수라는 두 가지 유형의 조직에서 다중종 분석을 위한 샘플 준비 및 핵 분리를 위한 프로토콜을 설명했습니다.
이 논문에 기술된 뇌 프로토콜은 갓 얼어붙은 뇌 조직에서 고품질 핵을 회수할 수 있게 해줍니다. 여기에는 동결 조직 파괴, 핵 분리, 핵 정제 및 준비된 물질의 품질 관리 단계가 포함됩니다. 뇌 조직은 다양한 세포 유형으로 구성되어 있으며, 조직 해리 및 핵 분리 절차는 초기 조직에 존재하는 세포 집단의 비율을 보존해야 합니다. 여기서, 용해 완충액 조성 및 배양 시간은 조직을 구성하는 모든 세포 집단의 완전하고 부드러운 용해가 가능하도록 최적화되었습니다.
골수 HSPC 프로토콜은 이질적인 세포 현탁액에서 관심 세포 집단을 분리하기 위해 실험 시작 시 한 가지 추가 단계가 필요하기 때문에 다소 다릅니다. 신선한 조직을 채취한 후 적혈구를 용해하고 관심 세포 하위 집합에 대해 샘플을 농축합니다. 표적 세포를 용해하고, 핵을 분리하고, 준비된 물질의 품질을 제어합니다.
10X Genomics는 다양한 조직에서 핵 분리를 위해 검증된 여러 프로토콜을 제공합니다32,33. 이 회사는 또한 검증된 조직으로부터 핵을 분리하기 위한 간단한 파이프라인을 갖춘 핵 분리 키트를 상용화한다34. 그러나 이러한 프로토콜은 특정 샘플의 특성을 조정하기 위해 추가 최적화가 필요합니다. 예를 들어 낮은 셀 입력으로 작업해야 하는 샘플이 있습니다. 이러한 샘플의 경우 가장 어려운 단계는 샘플을 세척할 수 있을 만큼 엄격하고 세포/핵 손실을 방지할 수 있을 만큼 부드러워야 하는 원심분리입니다. 여기에 설명된 프로토콜을 통해 당사는 이 두 가지 요구 사항 간의 미세한 균형을 찾기 위해 단일 세포 멀티옴 ATAC + GEX 염기서열분석(CG000365 – Rev C)27을 위한 10X Genomics Proven Protocol – Nuclei Isolation을 채택했습니다. 분류된 HSPC에서 핵을 준비하는 예에서 입증된 바와 같이, 당사는 샘플의 품질에 영향을 미치지 않으면서 핵 회수율을 개선했습니다.
또 다른 과제는 핵 분리를 위해 정제된 세포를 용해하는 단계입니다. 더 가혹한 용해 조건과 더 긴 배양 시간은 핵을 손상시켜 염기서열분석 데이터의 품질에 영향을 미칠 수 있습니다. 그림 5 는 용해 완충액을 사용한 다양한 배양 시간에 골수 샘플의 대표적인 핵 이미징을 보여주며 세포 용해에 따라 핵의 상태가 얼마나 다를 수 있는지 보여줍니다. HSPC의 예에서, 우리는 3분 용해가 건강해 보이는 온전한 핵의 비율이 가장 높고 손상된 핵의 비율이 가장 낮은 조건으로 식별되었습니다. 용해 배양 시간은 각각의 새로운 유형의 시료에 맞게 최적화되어야 합니다.
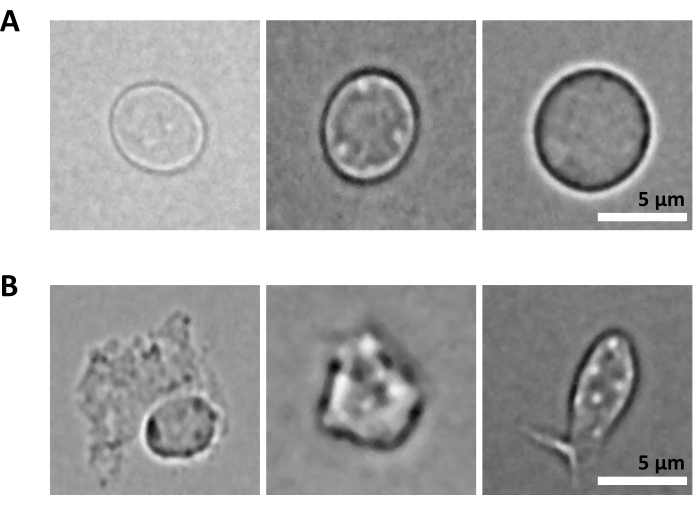
그림 5: 현미경에 의한 핵 품질 관리. (A)는 온전하고 (B)는 손상된 핵이 있는 쥐 골수에서 분리된 핵의 대표적인 명시야 이미지입니다. 눈금 막대 5 μm. 이미지는 40x ELWD NA 0.60 대물렌즈와 1.5x 디지털 줌을 사용하여 도립 현미경으로 촬영했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 연구에서 자세히 설명된 두 프로토콜 모두 고처리량 FACS 기기로 표적 세포 또는 핵을 정제하는 데 의존합니다. 이 단계는 세포의 희귀 하위 집합이 이종 현탁액에서 분리되어야 하는 단일 세포/핵 준비 프로토콜에 매우 중요합니다. HSPC 분류를 위해 여기에 표시된 예에서와 같이 이러한 경우, 관심 세포 집단에서 “게이팅”을 활성화하기 위해 고차원 유세포 분석 패널이 필요할 수 있습니다. 분류는 매우 빠르고 정확하여 분류된 세포 subset의 순도가 95% 이상입니다. 이 접근법은 세포 현탁액을 최대 70psi의 압력에 노출시키며, 따라서 세포막의 파열을 유발할 수 있기 때문에 깨지기 쉬운 세포(예: 수지상 세포, 호중구)의 분류에 제한될 수 있습니다. 이러한 경우 자기 분류, 차세대 기기(예: CellenOne, Cellenion; MACSQuant Tyto, Miltenyi)35,36 또는 액적 기반 시스템(예: ODIN, Sensific)37. 그럼에도 불구하고, 몇 분이 아닌 몇 시간 동안 지속되는 세포 분류와 함께 이러한 기술의 느린 분류 속도는 Multiome 및 큰 세포 수 분석을 기반으로 하는 기타 단일 세포 응용 분야를 위한 생존 가능한 세포 준비에 이러한 접근 방식을 적용하는 데 있어 강력한 제한 요소입니다.
조직에서 분리된 핵의 정제를 위해 FACS는 처리량과 분리된 물질의 순도로 인해 선택되는 방법입니다. 핵은 압력에 민감하지 않으며, 여과된 조직 분리물은 세포 분류기를 통해 쉽게 정제할 수 있습니다. 실험실에 FACS 기기가 장착되어 있지 않은 경우 효율성은 다소 떨어지지만 충분히 좋은 다른 대안이 있습니다. 예를 들어 초원심분리 또는 음파를 사용하여 크기 차이에 따라 입자를 분리하는 MARS(Applied Cell)와 같은 소형 장비의 사용이 있습니다. 세포/핵 현탁액의 소수성 특성을 사용하는 CURIOX 층류 와셔; 또는 세포의 물리적 특성(공중 부양)에 의존하여 파편에서 세포를 분리하는 LEVITAS bio.
여기에서는 다운스트림 Multiome 프로토콜에 대해 많은 수의 핵과 최상의 순도를 얻기 위한 프로토콜에 대해 설명합니다. FACS 분류 및 반복적인 원심분리 단계는 초기 물질의 상당한 손실을 초래합니다. 이러한 이유로, 우리가 여기에 기술하는 뇌로부터의 핵 준비를 위한 프로토콜에서, FACS 분류 후 적어도 500,000개의 핵의 수집을 초래하기 위해 충분히 풍부한 출발 물질이 필요하다. 이 기준이 일치하지 않는 경우 대체 프로토콜을 적용해야 합니다. 희귀 세포 집단 또는 작은 조직 절편으로 작업할 때 사용 가능한 초기 물질의 양이 제한 요인이 될 수 있습니다. 이 문제를 해결하기 위해 (a) 용해량을 줄이고, (b) 세척량을 줄이고, (c) 원심분리 시간이 연장된 단일 세척을 사용하여 낮은 세포 입력 핵 분리를 위한 10X Genomics 프로토콜에 표시된 대로 회수율을 개선함으로써 핵 회수를 개선할 수 있습니다. 저함량 물질의 멀티오믹 분석의 경우, 훨씬 적은 수의 입력 샘플이 필요한 scNMT, SNARE-seq 및 Paired-seq38 과 같은 플레이트 기반 애플리케이션을 고려하는 것이 좋습니다.
요약하면, 다운스트림 멀티옴 분석을 위해 뇌와 골수 HSPC에서 핵을 준비하기 위한 두 가지 강력한 프로토콜에 대해 설명했습니다. 이러한 프로토콜은 제기된 과학적 질문에 관계없이 이 두 가지 유형의 조직에서 고품질 단일 핵 현탁액을 필요로 하는 모든 과학 프로젝트에 적용할 수 있습니다. 우리 그룹은 다양한 표적 유전자의 비활성화에 따른 뇌 발달 연구와 신경 질환의 맥락에서 면역 반응 연구에 뇌핵 분리 프로토콜을 적용해 왔습니다. 우리는 면역 체계 구축에 다양한 조혈 하위 집단의 참여를 해독하기 위해 골수 핵 분리 프로토콜을 사용하고 있습니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ana Jeemin Choi는 파스퇴르 파리 대학교(PPU) 국제 박사 프로그램의 급여를 지원받았습니다.
Materials
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) |
BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
References
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781 (2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555 (2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317 (2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. . Joint profiling of chromatin accessibility and gene expression in thousands of single cells. 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq.Journal of Visualized Experiments. JoVE. 162, 61542 (2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375 (2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694 (2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), (2022).
- Lau, S. -. F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer’s disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer’s disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer’s disease. Acta Neuropathologica Communications. 10 (1), (2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190 (2018).
- Christ, A., et al. diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634 (2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer’s risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944 (2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487 (2021).
- . 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide. Document Number CG000338 Rev F. At. , (2022).
- J, , et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. 168, 61941 (2021).
- . . 10X Genomics 10X Genomics Demonstrated Protocol – Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 – Rev C). At. , (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), (2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), (2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology. , 1-9 (1935).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), (2022).
- . . 10X Genomics 10X Genomics Demonstrated Protocol – Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 – Rev E). At. , (2022).
- . 10X Genomics 10X Genomics Demonstrated Protocol – Nuclei Isolation from Complex Tissues for Single Cell Multiome. ATAC + Gene Expression Sequencing. (CG000375 – Rev C). At. , (2022).
- . . 10X Genomics 10X Genomics – Chromium Nuclei Isolation Kit (CG000505 – Rev A). AT. , (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091 (2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. 9 (2), 0348-0321 (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).

