Dreidimensionales Bioprinting von humanen iPSC-abgeleiteten Neuron-Astrozyten-Kokulturen für Screening-Anwendungen
Summary
In dieser Arbeit stellen wir ein Protokoll zur Herstellung von 3D-biogedruckten Kokulturen von iPSC-abgeleiteten Neuronen und Astrozyten vor. Dieses Kokulturmodell, das in einem Hydrogel-Gerüst im 96- oder 384-Well-Format erzeugt wurde, zeigt eine hohe Post-Print-Viabilität und ein Neuritenwachstum innerhalb von 7 Tagen und zeigt die Expression von Reifemarkern für beide Zelltypen.
Abstract
Damit ein Zellmodell für das Wirkstoff-Screening geeignet ist, muss das System die Anforderungen an Durchsatz und Homogenität erfüllen und gleichzeitig eine effiziente Entwicklungszeit haben. Viele veröffentlichte 3D-Modelle erfüllen diese Kriterien jedoch nicht. Dies schränkt daher ihren Nutzen in frühen Anwendungen in der Arzneimittelforschung ein. Dreidimensionaler (3D) Biodruck ist eine neuartige Technologie, die auf die Entwicklung von 3D-Modellen angewendet werden kann, um die Entwicklungszeit zu verkürzen, die Standardisierung zu erhöhen und den Durchsatz zu erhöhen. In dieser Arbeit stellen wir ein Protokoll zur Entwicklung von 3D-biogedruckten Kokulturmodellen von humanen induzierten pluripotenten Stammzellen (iPSC) abgeleiteten glutamatergen Neuronen und Astrozyten vor. Diese Kokulturen sind eingebettet in eine Hydrogel-Matrix aus bioaktiven Peptiden, extrazellulären Matrixproteinen (ECM) in voller Länge und mit einer physiologischen Steifigkeit von 1,1 kPa. Das Modell kann schnell in 96-Well- und 384-Well-Formaten etabliert werden und erzeugt eine durchschnittliche Post-Print-Viabilität von 72 %. Das Verhältnis von Astrozyten zu Neuronen in diesem Modell beträgt 1:1,5, was innerhalb des physiologischen Bereichs für das menschliche Gehirn liegt. Diese 3D-biogedruckten Zellpopulationen zeigen auch die Expression reifer neuronaler Zelltypmarker und das Wachstum von Neuriten- und Astrozytenprojektionen innerhalb von 7 Tagen nach der Kultur. Daher eignet sich dieses Modell für die Analyse mit Zellfarbstoffen und Immunfärbetechniken sowie für Neuritenauswuchs-Assays. Die Fähigkeit, diese physiologisch repräsentativen Modelle in großem Maßstab herzustellen, macht sie ideal für den Einsatz in Screening-Assays mit mittlerem bis hohem Durchsatz für neurowissenschaftliche Ziele.
Introduction
Die Erforschung von Erkrankungen des zentralen Nervensystems (ZNS) in der Arzneimittelforschung wird ausgeweitet1. Für viele weit verbreitete ZNS-Erkrankungen wie Epilepsie, Schizophrenie und Alzheimer gibt es jedoch noch keine heilenden Behandlungen 2,3,4. Der Mangel an wirksamen Therapeutika bei ZNS-Erkrankungen kann zumindest teilweise auf einen Mangel an genauen In-vitro-Modellen des Gehirns zurückgeführt werden5. Dies hat zu einer translationalen Lücke zwischen aktuellen In-vitro-Modellen und In-vivo-Daten und einem daraus resultierenden Engpass in den Forschungsbemühungen geführt.
Angetrieben durch diese translationale Lücke hat die Entwicklung neuartiger 3D-Zellmodelle in den letzten Jahren deutlich zugenommen, darunter neuronale Organoide, Neurosphäroide und Gerüst-basierte Modelle6. Die 3D-Struktur dieser Modelle hilft bei der Rekapitulation der neuronalen Mikroumgebung, einschließlich biomechanischer Belastungen, Zell-Zell-Kontakte und der extrazellulären Matrix des Gehirns (EZM)7. Die Gehirn-EZM ist ein dynamisches Element der Neurophysiologie, das den Raum zwischen neuronalen Zelltypen einnimmt, einschließlich Neuronen, Astrozyten, Oligodendrozyten und der neurovaskulären Einheit7. Es hat sich gezeigt, dass die Rekapitulation der EZM des Gehirns die neuronale Morphologie und das neuronale Feuern beeinflusst, und viele komplexe 3D-Modelle des Gehirns haben die Ablagerung von EZM-Proteinen durch neuronale Zelltypengezeigt 8,9,10,11. Gerüstbasierte Modelle bestehen aus reifen neuronalen Kokulturen, die in einer porösen synthetischen oder biologischen Hydrogelmatrix suspendiert sind, die das Gehirn-ECMdarstellt 12. Im Gegensatz zu Organoid- und Sphäroidsystemen ermöglichen Gerüst-basierte 3D-Modelle die Anpassung der vorhandenen ECM-Proteine und haben den zusätzlichen Vorteil, dass die Hydrogelsteifigkeit so eingestellt werden kann, dass biomechanische Spannungen nachgeahmt werdenkönnen 13,14.
Obwohl eine überwältigende Mehrheit der neuronalen 3D-Modelle eine erhöhte Rekapitulation der Mikroumgebung des Gehirns zeigt, sind nicht alle Modelle für die Implementierung von Anwendungen in der Arzneimittelforschung gut geeignet15. Damit ein 3D-Modell in industrielle Prozesse implementiert werden kann, muss das System die Durchsatzanforderungen für Siebanwendungen erfüllen und eine relativ kurze Entwicklungszeit haben16. 3D-Bioprinting ist eine neuartige Technologie, die das Potenzial bietet, 3D-Gerüst-basierte neuronale Modelle mit schneller Entwicklungszeit, erhöhtem Durchsatz und höherer Präzision zu erstellen und gleichzeitig die durch menschliches Versagen verursachte Variabilität zu beseitigen17. Dieses Protokoll präsentiert ein 3D-Kokulturmodell von humanen iPSC-abgeleiteten glutamatergen Neuronen und Astrozyten in einem Hydrogel-Gerüst. Dieses Hydrogel-Gerüst enthält physiologisch repräsentative bioaktive Peptide (RGD, IKVAV, YIGSR) und ECM-Proteine in einer mimetischen biomechanischen Steifigkeit. Zu diesen EZM-Proteinen in voller Länge gehören Laminin-211 und Hyaluronsäure, die im menschlichen Kortex reichlich vorhanden sind, mit einer Steifigkeit von 1,1 kPa in Übereinstimmung mit In-vivo-Messungen 18. Dieses Modell wurde mit einem 3D-Biodrucker in einem 96-Well- oder 384-Well-Plattenformat erstellt, das für die Screening-Analyse mit bildgebenden Verfahren mit Zellfarbstoffen und Antikörpern sowie Neuriten-Auswuchsassays geeignet ist. Die Zellen zeigen innerhalb von 7 Tagen nach der Kultur eine Expression von Markern des neuronalen Zelltyps und das Wachstum von Neuriten- und astrozytären Projektionen. Daher wird dieses Protokoll die Methodik zur Entwicklung eines neuronalen 3D-Kokulturmodells mit hohem Durchsatz für den Einsatz in der Arzneimittelforschung vorstellen.
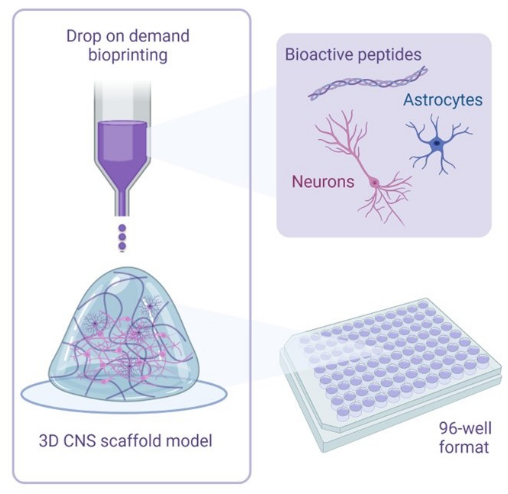
Abbildung 1: Illustrativer Überblick über die Methodik, die für den 3D-Biodruck von Kokulturen verwendet wird. Menschliche iPSC-abgeleitete Neuronen und Astrozyten werden mit Aktivator- und Biotintenlösungen kombiniert, die bioaktive Peptide enthalten, und werden mithilfe der Drop-on-Demand-Bioprinting-Technologie auf Hydrogel-Gerüste in 96-Well- oder 384-Well-Formaten biogedruckt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Der Bedarf an genauen Modellen des ZNS war noch nie so hoch wie heute, und die Einschränkungen zweidimensionaler (2D) traditioneller Zellkulturmodelle haben in den letzten Jahren zu einer Generation komplexer ZNS-Modelle geführt19. Viele komplexe 3D-Modelle, die Interaktionen zwischen neuronalen Zelltypen und der EZM darstellen, weisen jedoch Einschränkungen auf, die die Anwendung dieser Modelle in industriellen Prozessen verhindern würden 6,20,21. In diesem Protokoll entwickeln wir ein 3D-Kokulturmodell von humanen iPSC-abgeleiteten Neuronen und Astrozyten, das darauf abzielt, einige dieser Einschränkungen mithilfe der 3D-Bioprinting-Technologie zu lösen, um ein bioaktives Hydrogel-Gerüst in 96-Well- und 384-Well-Formaten herzustellen.
Die Methodik für die Entwicklung dieser Modelle wurde durch die Plattenkarten-Designsoftware, automatisch generierte Druckprotokolle und den geführten Druckprozess des Biodruckers vereinfacht. Aufgrund der Empfindlichkeit der empfindlichen iPSC-abgeleiteten Zelltypen, die in diesem Protokoll verwendet werden, ist jedoch bei den folgenden kritischen Schritten beim Auftauen und bei der Kultur Vorsicht geboten. Erstens hat die Einbeziehung des ROCK-Inhibitors (ROCKi) mehrere Vorteile während des gesamten Bioprinting-Prozesses und während der frühen Kultur. Das Auftauen der Zellen ist ein kritischer Punkt, an dem die Neuronen eine Stressreaktion erfahren können, und unsachgemäße Auftauprotokolle können die Überlebenschancen verringern22. In der Regel wird empfohlen, Zellen aufzutauen, Medien hinzuzufügen und die Zellen so effizient wie möglich auf Inkubatortemperatur zu bringen23. Während des in diesem Protokoll beschriebenen Bioprinting-Prozesses ist es jedoch notwendig, dass Neuronen und Astrozyten in einer Aktivatorlösung anstelle von Medien resuspendiert werden und die Zellen bis zum Ende des Drucklaufs (bis zu 30 Minuten nach dem Auftauen) nicht über Raumtemperatur angehoben werden. Daher ist die Zugabe von ROCKi zu den Medien unmittelbar nach dem Auftauen und die Einbeziehung während der beiden Zentrifugationsschritte (Schritte 2.1-2.7 und 1.3.15-1.3.20) zwingend erforderlich, um die Zellstresswege zu hemmen, was zu niedrigeren Lebensfähigkeitsniveaus führenwürde 24. Darüber hinaus wurde gezeigt, dass ROCKi das Wachstum von Neuriten fördert und die neuronale Reifung verbessert25. Somit wird die ROCKi-Supplementierung für 48 Stunden nach dem Bioprinting fortgesetzt. Es ist jedoch zwingend erforderlich, die ROCKi-Supplementierung nach 48 h zu entfernen, um ein vollständiges Abwaschen während des nachfolgenden Medienwechsels zu gewährleisten, bevor die Zellen für den Assay verwendet werden.
Ein weiterer Schritt, der kritische Aufmerksamkeit erfordert, ist das Hinzufügen von Medien nach dem Druck und der Medienwechsel (Schritte 2.8-2.13). Das biogedruckte Hydrogel-Gerüst hat eine äquivalente biomechanische Steifigkeit von nur 1,1 kPa, was der grauen Substanz entspricht. Wie in Schritt 2.10 beschrieben, ist es wichtig, während der Medienzugabe und -aspiration vorsichtig in die Seite des Wells zu pipettieren, um Störungen zu vermeiden. Dies ist besonders relevant für 384-Well-Platten, bei denen der Gelspiegel einen höheren Anteil am Gesamtvolumen der Wells einnimmt. Diese Methode sollte auch in 2D-Kontrollwellen verwendet werden, um das Anheben von Kanten von Zellen und das Scheren von Neuritenauswüchsen zu verhindern. Die Autoren möchten auch die Bedeutung der sterilen Technik innerhalb des Bioprinters hervorheben, die mit der gleichen Vorsicht behandelt werden sollte wie eine Biosicherheitswerkbank, die für iPSC-abgeleitete Zellkulturen verwendet wird. Dazu gehören die sterile Filterung von 70 % EtOH und dH2O, die bei den Grünlicht- und Druckverfahren verwendet werden, das Halten der Deckel auf den Kartuschen und Platten, während die Hände in den Bioprinter hinein- und herausbewegt werden, und die Dekontamination von Oberflächen im Biodrucker mit 70%igen Ethanoltüchern vor und nach dem Druck.
Das biogedruckte Hydrogel-Gerüst, das aus Biotinten- und Aktivatorlösungen besteht und für die Entwicklung dieses Modells ausgewählt wurde, wurde aus einer Reihe von Biotinten und Aktivatorlösungen ausgewählt, die von Inventia Life Science für den Einsatz im RASTRUM-Biodrucker entwickelt wurden. Laminin und Hyaluronsäure wurden aufgrund ihrer Rolle bei der axonalen Führung, der Synapsenbildung und der Bildung des perineuronalen Netzes als Moleküle identifiziert, die für die iPSC-abgeleitete neuronale Reifung relevant sind26,27. Darüber hinaus wurde eine biomechanische Steifigkeit von 1,1 kPa gewählt, da Hydrogele mit geringerer Dichte nachweislich ein besseres Neuritenwachstum aus Neuronen ermöglichen12. Wenn Änderungen am Protokoll vorgenommen werden, indem Neuronen und Astrozyten verwendet werden, die intern oder von einem anderen kommerziellen Anbieter differenziert wurden, wird empfohlen, einen Matrixauswahltest durchzuführen, um das unterstützendste Hydrogel-Gerüstzu bestimmen 15. Darüber hinaus muss möglicherweise auch die Zelldichte optimiert werden, wenn Änderungen an den Zellquellen vorgenommen werden, um eine optimale Lebensfähigkeit zu gewährleisten und eine Überfüllung der Hydrogele zu verhindern. Für alle Modifikationen und Fehlerbehebungen im Zusammenhang mit der Bioprinter-Funktion empfehlen die Autoren, sich an die Hersteller zu wenden und auf Herstellerprotokolle zu verweisen.
Das ZNS enthält ein breites Spektrum an neuronalen Subtypen und Gliazellen, die alle in verschiedenen Hirnnischen existieren und spezifische Rollen spielen, die zur neuronalen Funktion beitragen28. Im Rahmen dieses breiten Umfangs repräsentiert dieses Modell nur die beiden am häufigsten vorkommenden Zelltypen (Astrozyten und exzitatorische glutamaterge Neuronen). Wichtige Zelltypen wie Mikroglia, Oligodendrozyten und Blut-Hirn-Schranken-bildende Endothelzellen werden in diesem System ausgelassen. Der Einschluss von Mikroglia könnte für Neuroimmuninteraktionen von Bedeutung sein, und Oligodendrozyten könnten bei Krankheiten, die die zentrale Myelinisierung betreffen, von Interesse sein. Zusätzlich zu ihrer Rolle in der Pathologie scheiden Zellen wie Endothelzellen, die die Blut-Hirn-Schranke bilden, arzneimittelmetabolisierende Enzyme aus, was die Verwendung dieses Modells für pharmakokinetische Assays beeinflussen könnte29. Eine weitere Einschränkung des Modells könnte das Verhältnis von Astrozyten zu Neuronen sein; Das Verhältnis von Astrozyten zu Neuronen variiert stark zwischen den Hirnregionen, wobei die empfohlenen Werte zwischen 1:1 und 1:3 liegen30,31. Dieses Modell hat ein ungefähres Verhältnis von 1:1,5 Astrozyten zu Neuronen; Daher ist dieses Modell möglicherweise nicht von Relevanz für das Modell von Gehirnbereichen, in denen Astrozyten häufiger vorhanden sind, wie z. B. in Bereichen der weißen Substanz30.
In den letzten Jahren wurden weitere Protokolle zur Entwicklung von 3D-biogedruckten Kokulturmodellen veröffentlicht. In einer Veröffentlichung von Sullivan et al. aus dem Jahr 2021 wurde ein 3D-biogedrucktes neuronales Modell mit iPSC-abgeleiteten neuronalen Vorläuferzellen vorgestellt, das im Vergleich zu 2D-Kulturen eine hohe Lebensfähigkeit und Verbesserung der neuronalen Funktion nach dem Druck aufweist32. In diesem Protokoll wurden jedoch neurale Vorläuferzellen als Zellquelle verwendet und 4 Wochen lang in Kultur gehalten. In diesem Protokoll wurden kommerziell erhältliche glutamaterge Neuronen und Astrozyten aus iPSC verwendet. Auf diese Weise kann in nur 7 Tagen ein 3D-Netzwerk aus kokultivierten Zellen aufgebaut werden. Wie die Analyse des Neuritenwachstums zeigt, beginnt das Neuritenwachstum innerhalb von 24 Stunden und setzt sich während des gesamten Zeitraums von 156 Stunden, für den das Zellwachstum überwacht wurde, linear fort. Die schnelle Etablierung dieser Netzwerke kann zum Teil auf die Verwendung von glutamatergen Neuronen zurückgeführt werden, die eine optimierte Doxycyclin-induzierbare Genexpression von NGN2 verwenden, die die Expression reifer neuronaler Subtypmarker innerhalb von 7 Tagen zeigt, selbst in 2D-Kultur33. Die Verkürzung dieser Wachstumsperiode mit dieser Technik ist wichtig für die Implementierung von Modellen in der biopharmazeutischen Industrie, da die Assay-Entwicklung eine schnelle Abwicklung und Entwicklung von Zellmodellen erfordert15.
Zusammenfassend lässt sich sagen, dass dieses Modell Potenzial für ein 3D-Modell von Neuronen und Astrozyten aufweist, das schnell und bequem für Screening-Zwecke erstellt werden kann. Zukünftige Anwendungen für diesen Modelltyp könnten für die Arzneimittelforschung bei verschiedenen ZNS-Erkrankungen eingesetzt werden, mit der Möglichkeit, sie mit Hilfe von patienten- oder geneditierten iPSC-Linien auf verschiedene Krankheiten auszuweiten. Darüber hinaus ermöglicht die Verwendung von Doxycyclin-induzierbaren NGN2-Expressions-iPSC-abgeleiteten glutamatergen Neuronen den Zellen, die Reife in kürzerer Zeit zu erreichen, was für die Entwicklung von Modellen des alternden Gehirns für die Neurodegenerationsforschung genutzt werden kann. Dieses System könnte auch durch den Einsatz weiterer Zelltypen in der Kokultur, einschließlich Mikroglia und Oligodendrozyten, erweitert werden.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Alex Volkerling, Martin Engel und Rachel Bleach für ihre Unterstützung bei der Entwicklung des Protokolls und das Feedback zum Manuskript.
Materials
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer’s disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).

