Um experimento usando espectroscopia funcional no infravermelho próximo e movimentos de apontar multi-articulações assistidas por robô do membro inferior
Summary
Estima-se que 1 em cada 6 indivíduos no mundo terá um acidente vascular cerebral ao longo da vida, causando incapacidade a longo prazo, cujos mecanismos de reabilitação ainda são pouco compreendidos. Este estudo propõe um protocolo para avaliar a ativação cerebral por espectroscopia funcional no infravermelho próximo (fNIRS) durante uma sessão de terapia robótica de membros inferiores.
Abstract
O acidente vascular cerebral (AVC) afeta aproximadamente 17 milhões de indivíduos em todo o mundo a cada ano e é uma das principais causas de incapacidade a longo prazo. A terapia robótica tem se mostrado promissora em ajudar pacientes com AVC a recuperar as funções motoras perdidas. Um caminho potencial para aumentar a compreensão de como a recuperação motora ocorre é estudar a ativação cerebral durante os movimentos que são alvo da terapia em indivíduos saudáveis. A espectroscopia funcional no infravermelho próximo (fNIRS) tem emergido como uma técnica promissora de neuroimagem para examinar os fundamentos neurais da função motora. O objetivo deste estudo foi investigar os correlatos neurais da fNIRS de movimentos complexos de membros inferiores em indivíduos saudáveis. Os participantes foram solicitados a realizar ciclos de repouso e movimento por 6 min usando um dispositivo robótico para reabilitação motora. A tarefa exigia movimentos coordenados das articulações do joelho e tornozelo para apontar para alvos exibidos na tela do computador. Duas condições experimentais com diferentes níveis de assistência ao movimento fornecidas pelo robô foram exploradas. Os resultados mostraram que o protocolo fNIRS detectou efetivamente regiões cerebrais associadas ao controle motor durante a tarefa. Notadamente, todos os indivíduos exibiram maior ativação na área pré-motora contralateral durante a condição sem assistência em comparação com a condição assistida. Em conclusão, a fNIRS parece ser uma abordagem valiosa para detectar alterações na concentração de oxihemoglobina associadas a movimentos de apontamento multiarticular do membro inferior. Esta pesquisa pode contribuir para a compreensão dos mecanismos de recuperação motora do AVC e pode abrir caminho para melhores tratamentos de reabilitação para pacientes com AVC. No entanto, mais pesquisas são necessárias para elucidar completamente o potencial da fNIRS no estudo da função motora e suas aplicações em ambientes clínicos.
Introduction
Dados epidemiológicos indicam que no mundo ocorrem ~17 milhões de novos casos de AVC a cada ano, com aumento da incidência em países de baixa e médiarenda1. Estima-se que o número de novos casos aumente para 77 milhões até 20302. O comprometimento motor decorrente do acidente vascular encefálico (AVE) frequentemente afeta a mobilidade e a participação do paciente nas atividades de vida diária, contribuindo para uma baixa qualidade de vida. A reabilitação motora tradicional inclui a terapia manual, mas nas últimas décadas, sistemas robóticos para reabilitação foram desenvolvidos. Esses sistemas podem oferecer terapia em alta intensidade, dose, quantificabilidade, confiabilidade, repetibilidade e flexibilidade3 e têm mostrado potencial como tratamentos de reabilitação eficazes para pacientes com AVC agudo e crônico 4,5,6. Além de oferecer terapia, sistemas robóticos para reabilitação podem ser usados como ferramentas de avaliação, pois podem ser equipados com sensores que podem medir dados cinemáticos/cinéticos do movimento do paciente 7,8. Para a reabilitação motora dos membros superiores, tais dados não só têm se mostrado úteis para avaliar o nível de recuperação motora do paciente provocado pela terapia robótica e servido como ferramenta complementar às avaliações clínicas tradicionais 9,10, mas também têm contribuído para avançar na compreensão do processo de recuperação motora do AVE11, 12 bem como controle neural do movimento e aprendizagem motora em indivíduos saudáveis 3,13,14. Como resultado, esses achados forneceram uma base para melhorar os tratamentos de reabilitação15.
Nas últimas duas décadas, muitos dispositivos robóticos para neurorreabilitação de membros inferiores foram propostos, desde exoesqueletos que suportam o peso corporal do paciente durante a caminhada (por exemplo, sobre uma esteira, como Lokomat16) até sistemas robóticos estacionários que permitem ao paciente exercitar o tornozelo, joelho ou pé sem caminhar (como o tornozelo de Rutgers17, o High-Performance Ankle Rehabilitation Robot18 e o Gwangju Institute of Science and Technology (GIST) ankle/foot rehabilitationrobot 19) ou órteses ativas de pé que são exoesqueletos acionados usados pelo paciente para caminhar sobre o solo ou sobre uma esteira (como a Powered Gait Orthosis20 e a MIT Anklebot21). Ver 22,23,4 para uma revisão sobre robôs para reabilitação de membros inferiores.
Os resultados de estudos clínicos de dispositivos robóticos para reabilitação de membros inferiores em pacientes com AVC têm sido encorajadores e mostraram que esses sistemas podem melhorar a amplitude de movimento (ADM), a força muscular ou a marcha das articulações, dependendo do dispositivo específico e do protocolo clínico (ver 24,25 para uma revisão sobre a eficácia de robôs de membros inferiores para reabilitação). Embora tenha sido postulado que a terapia assistida por robô promove alterações neuroplásticas, que acabam resultando em melhora das habilidades motoras26, como ocorre exatamente o processo de recuperação motora do AVC e quais protocolos de treinamento robótico otimizam o processo de recuperação das habilidades motoras dos membros inferiores, permanecem na maioria das vezes obscuros. De fato, há uma disparidade significativa e crescente entre o crescente desenvolvimento de robôs de reabilitação (seja por pesquisadores acadêmicos ou entidades comerciais) e a compreensão limitada dos mecanismos neurofisiológicos subjacentes à recuperação motora4. Medidas de cinemática de movimento ou torques articulares realizadas com sensores embutidos têm contribuído para descrever quantitativamente as mudanças motoras comportamentais que ocorrem à medida que os pacientes recuperam as habilidades motoras dos membros inferiores27,28,29, preenchendo parcialmente essa lacuna. No entanto, os correlatos neurais subjacentes a tais alterações têm sido menos investigados. Isso se deve a vários motivos.
A imagem funcional do cérebro é demorada e, às vezes, difícil de concluir no contexto de ensaios clínicos, que muitas vezes exigem manter a carga do paciente mínima para maximizar a probabilidade de adesão do paciente ao estudo. Isso é particularmente verdadeiro para indivíduos que sofreram um acidente vascular cerebral, dado o fato de que fadiga pós-AVC e fraqueza muscular são frequentemente observadas30. Além disso, modalidades de imagem baseadas em campos magnéticos, como a ressonância magnética funcional (fMRI), exigem que o hardware do paciente e do robô seja seguro para o ímã.
Entre as modalidades de imagem não invasivas, a espectroscopia funcional no infravermelho próximo (fNIRS) é uma técnica de imagem particularmente adequada para avaliar áreas de ativação cerebral em indivíduos submetidos à terapia robótica. Da mesma forma que a fMRI, a fNIRS mede a oxigenação/desoxigenação sanguínea no cérebro. No entanto, ao contrário do fMRI, o fNIRS é totalmente compatível com hardware robótico, e muitas vezes é portátil, sendo até mesmo utilizável à beira do leito. Além disso, a fNIRS apresenta baixo custo e menor sensibilidade a artefatos de movimento 31,32,33.
Apesar de suas claras vantagens e uso difundido em muitos cenários clínicos desde sua primeira introdução no final da década de 7034, apenas alguns estudos utilizaram o fNIRS para quantificar a ativação cerebral associada aos movimentos dos membros inferiores e à recuperação motora do AVC. Estudos com FNIRS com o objetivo de elucidar mecanismos de controle neural do movimento e/ou mecanismos ou avaliação da recuperação motora de AVE têm investigado, em sua maioria, movimentos uniarticulares (por exemplo, dorsiflexão, flexão plantar ou extensão de joelhos35,36,37), marcha38,39,40,41,42,43 ou ciclismo44. Veja45 para uma revisão. Da mesma forma, os estudos da fNIRS sobre terapia assistida por robô para o membro inferior têm se concentrado principalmente na reabilitação da marcha assistida por robô; veja46 para uma revisão. Poucos estudos têm se concentrado no uso de fNIRS como parte de um sistema de Interface Cérebro-Computador (BCI) para derivar sinais de controle para dispositivos robóticos47,48; embora essa área de pesquisa também se baseie no processamento de sinais fNIRS, seu objetivo é diferente e focado principalmente na decodificação das intenções dos pacientes (por exemplo, pacientes com deficiências motoras graves).
O estudo piloto aqui apresentado é parte de um esforço inicial para investigar os efeitos de um sistema robótico na reabilitação de membros inferiores. O robô pode fornecer reabilitação de membros inferiores orientada a alvos que envolve treinamento em movimentos multiarticulares diários, bem como fornecer terapia para articulações únicas (por exemplo, joelho ou tornozelo) do membro inferior (ou seja, implementar um programa de reabilitação de baixo para cima).
O estudo teve como objetivo investigar a viabilidade de um protocolo experimental que exigisse a aquisição de dados do fNIRS durante a realização de movimentos de apontar multiarticulares para membros inferiores. A duração do período de aquisição de dados neste estudo, que foi limitado a 6 min, é menor do que os protocolos típicos de fNIRS. Essa foi uma escolha deliberada com o objetivo de aumentar a praticidade e a aplicabilidade clínica desta pesquisa, particularmente em pacientes com limitação de mobilidade ou força. Identificar correlatos fNIRS de movimentos multiarticulares tão complexos e obter insights sobre como a ativação cerebral foi modulada pela assistência de robôs também foram pontos de interesse. Para tanto, foram realizadas duas sessões de experimentos com os mesmos participantes: uma sem auxílio de robô e outra com auxílio de robô. Finalmente, é importante ressaltar que este estudo se concentrou em indivíduos saudáveis, a fim de estabelecer uma base para pesquisas futuras em termos de registro da viabilidade de protocolos e avaliação da ativação cerebral durante movimentos alvo de terapia robótica.
Aparelho
Um robô portátil projetado para realizar reabilitação de membros inferiores (ver Figura 1) foi usado para conduzir nossos experimentos. O robô tem um espaço de trabalho acessível em 3D e é compacto e leve, pesando cerca de 35 lb., o que facilita o transporte e a instalação.
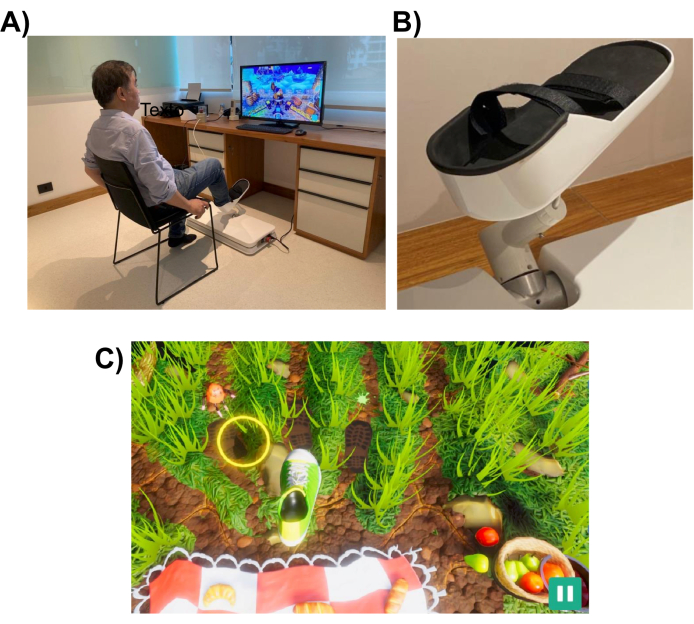
Figura 1: Montagem experimental: (A) O sistema robótico (instalado no chão) projetado para o membro inferior. Um voluntário é mostrado utilizando a interface com o pé direito. (B) Estrutura de apoio para o pé do sujeito que permite a fixação ao sistema robótico. (C) Uma captura de tela do jogo Picnic. O objetivo do jogo é mover o pé (sapato verde e branco) para o alvo (círculo amarelo). Clique aqui para ver uma versão maior desta figura.
O sistema robótico é projetado para auxiliar o paciente a realizar movimentos dos membros inferiores semelhantes aos realizados em tarefas cotidianas, como apontar ou chutar. Ele usa jogos interativos de realidade virtual, que são exibidos em um monitor de computador ou uma tela de televisão colocada na frente do dispositivo robótico (veja a Figura 1). O efetor robô-extremidade é anexado ao membro inferior do paciente (por exemplo, tornozelo), e sua posição é mapeada para a posição de um cursor na tela. Um jogo típico mostra os alvos de movimento do paciente (por exemplo, o objeto para apontar ou onde chutar a bola).
Para completar a tarefa de movimento, o robô pode ajudar o paciente com um nível de assistência que pode variar de assistência completa a nenhuma. O nível de assistência robótica é escolhido no início de cada sessão de reabilitação com base no nível de comprometimento motor do paciente. Os movimentos realizados pelo sujeito são usados pelo jogo para pontuar o desempenho do paciente e fornecer-lhe feedback sobre seu desempenho (por exemplo, ADM, número de movimentos e nível de assistência robótica). Os jogos são projetados para serem interativos e divertidos para manter o interesse e a atenção do paciente. Neste estudo, os participantes jogaram o “jogo do piquenique”, no qual o jogador tinha que impedir que os insetos alcançassem a toalha e roubassem o alimento (veja a Figura 1, painel inferior, para uma captura de tela).
A aquisição de dados foi realizada com um sistema portátil de aquisição fNIRS com dois diferentes optodes de onda contínua (760 nm e 850 nm), 8 fontes de LED de ponta dupla e 8 detectores ativos de ponta dupla. Os sinais foram adquiridos utilizando-se uma taxa de amostragem de 10,17 Hz. Um laptop foi utilizado para a otimização da calibração e gravação do sinal utilizando uma rede Wi-Fi criada pelo sistema fNIRS.
Uma tampa foi usada para manter os optodes nos locais pré-determinados. As fontes e os detectores foram colocados de acordo com o sistema internacional de EEG 10-10 em uma grade de distribuição espacial. Cada canal fNIRS foi definido por um par fonte-detector com distâncias interoptodes de aproximadamente 30 mm. Os optodes foram posicionados sobre as áreas motora suplementar, pré-motora e motora nos locais mostrados na Figura 2. O número total de canais foi de 28, sendo 8 canais de curta distância acoplados a cada fonte utilizando um adaptador de fibra óptica para um único detector. Dada a configuração de multiplexação do hardware, é possível adquirir informações de curta distância de todas as fontes usando apenas um detector.
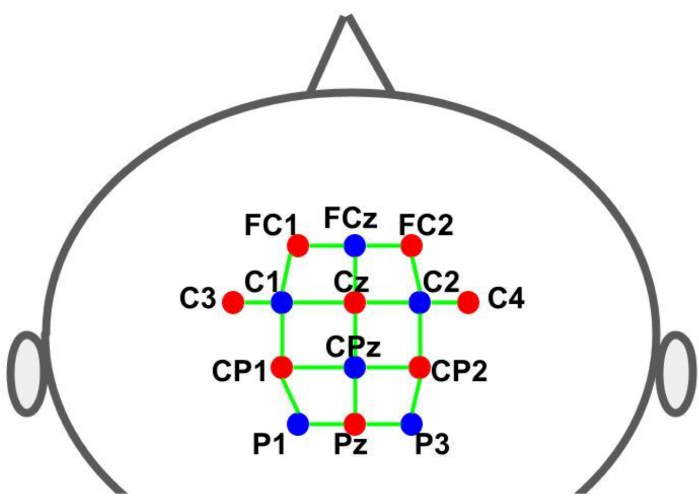
Figura 2: Layout de montagem utilizando o sistema de EEG 10-10. As letras e os números indicam a localização da fonte/detector. Os pontos vermelho e azul representam os optodes da fonte e do detector, respectivamente. As linhas verdes representam os canais fNIRS que consistem em pares de fontes e detectores. Clique aqui para ver uma versão maior desta figura.
Delineamento experimental
O experimento foi conduzido em duas condições experimentais distintas, diferindo no nível de assistência fornecido pelo robô para os movimentos do sujeito. Na primeira condição, o robô foi programado para não fornecer qualquer auxílio aos movimentos do sujeito, enquanto na segunda condição, o robô controlou os movimentos dos pés e pernas do sujeito (movimento assistido por robô).
Cada experimento seguiu um paradigma de planejamento de blocos envolvendo ciclos alternados de uma tarefa motora (jogar o jogo – 30 s) e descansar (30 s), como ilustrado na Figura 3. O início e a conclusão de cada fase (jogo/jogo ou descanso) foram sinalizados visualmente ao sujeito através da tela do computador. Durante a fase de descanso, uma mensagem indicando uma pausa foi exibida. Cada ciclo (jogo/jogo + descanso) teve duração de 60 s e foi repetido seis vezes, resultando em um tempo total de execução de 360 s (6 min).
Os participantes jogaram o “Jogo do piquenique”, em que o objetivo era evitar que insetos alcançassem a toalha e roubassem alimentos. Este jogo envolveu uma sequência de movimentos dos membros inferiores, começando a partir de um alvo doméstico designado (posição inicial) e estendendo-se para um dos três alvos externos antes de retornar ao alvo inicial. Na tela, os alvos externos eram representados visualmente como insetos em movimento animados, que os participantes tinham que alcançar e pisar. Havia três alvos de alcance externo, cada um apresentado aleatoriamente um número igual de vezes, ao lado de um alvo doméstico comum para cada movimento. A distância que o pé precisava percorrer do alvo doméstico até a posição dos alvos externos formava um arco, medindo aproximadamente 26 cm. A tarefa motora exigia a execução de movimentos multiarticulares, exigindo coordenação entre os movimentos de flexão/extensão do joelho, flexão plantar e dorsiflexão.
Os registros dos dados do fNIRS foram sincronizados com os estímulos visuais apresentados pelo jogo ao sujeito através de um pulso transistor-transistor-lógico (TTL) gerado pelo robô. Pulsos foram gerados no início de cada fase (jogo/jogo e repouso). Assim, todo o controle de cronometragem foi realizado pelo jogo, que forneceu pistas visuais (alvos) para o participante iniciar cada movimento, enviou sinais TTL para o sistema fNIRS para marcar os registros de atividade cerebral e, se exigido pelo experimento, enviou sinais para o sistema de controle do robô para iniciar a assistência ao movimento.
Protocol
Representative Results
Discussion
Neste estudo de prova de conceito, investigou-se a viabilidade de fazer inferências sobre o mapeamento da ativação cerebral usando dados do fNIRS de indivíduos saudáveis enquanto eles se exercitavam com diferentes tipos de movimentos usando um robô para reabilitação de membros inferiores. As sessões típicas de gravação de fNIRS em adultos são mais longas do que 6 min54. No entanto, para viabilizar gravações no contexto de um ambiente de reabilitação, a duração total do experimen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
As opiniões, hipóteses, conclusões e recomendações deste estudo são dos autores e não representam necessariamente a opinião da agência financiadora. O JRS agradece à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP, processos 2021/05332-8, 2018/04654-9, 2018/21934-5 e 2023/02538-0) e Jackson Cionek pelo apoio tecnológico. A AMM e a Vivax Ltda agradecem à FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo) e à FINEP (Agência Brasileira de Inovação). Este projeto foi financiado com auxílios da FAPESP (processo 2018/09559-4) e da FINEP (processo 2019/09933-6).
Materials
| 32 inch Smart TV | Samsung | N/A | TV connected to robot via HDMI cable |
| 8-detector silicon photodiode (SiPD) optodes for optical detection with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| 8-source optodes bundle for optical illumination with dual tip | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Aurora acquisition software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| Laptop Precision XPS 13 | Dell Technologies (Round Rock, TX, USA) | ||
| nirsLAB fNIRS Analysis software | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | |
| NIRSports2 fNIRS acquisition system | NIRx Medical Technologies (Glen Head, NY, USA) | https://nirx.net/nirsport | It has two different continuous wave optics (760 and 850 nm), 8 dual-ended LED sources and 8 dual-ended active detectors. |
| R | R-project.org (open source software) | https://www.r-project.org/ | |
| Standard cut cap, black color for up to 128 holders. | Easycap GmbH (Wörthsee, Germany) | https://www.easycap.de/ | |
| Vivax Assistive Rehabilitation Machine (ARM) | Vivax Ltda (São Paulo, Brazil) | https://vivaxbr.com/home/ | It is a portable robot designed to deliver lower limb rehabilitation. It has a 3D reachable workspace and is compact and light, weighing about 35 lb., which makes it easy to transport and to install. |
References
- GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. Neurology. 18 (5), 439-458 (2019).
- GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. The Lancet. Neurology. 20 (10), 795-820 (2021).
- Huang, V. S., Krakauer, J. W. Robotic neurorehabilitation: a computational motor learning perspective. Journal of NeuroEngineering and Rehabilitation. 6, 5 (2009).
- Hobbs, B., Artemiadis, P. A Review of Robot-Assisted Lower-Limb Stroke Therapy: Unexplored Paths and Future Directions in Gait Rehabilitation. Frontiers in neurorobotics. 14, 19 (2020).
- Bertani, R., Melegari, C., De Cola, M. C., Bramanti, A., Bramanti, P., Calabrò, R. S. Effects of robot-assisted upper limb rehabilitation in stroke patients: a systematic review with meta-analysis. Neurological Sciences. 38 (9), 1561-1569 (2017).
- Warutkar, V., Dadgal, R., Mangulkar, U. R. Use of robotics in gait rehabilitation following stroke: A review. Cureus. 14 (11), e31075 (2022).
- Dipietro, L., et al. Changing motor synergies in chronic stroke. Journal of Neurophysiology. 98 (2), 757-768 (2007).
- Dipietro, L., et al. Learning, not adaptation, characterizes stroke motor recovery: evidence from kinematic changes induced by robot-assisted therapy in trained and untrained task in the same workspace. IEEE Trans Neural Syst Rehabil Eng. 20 (1), 48-57 (2012).
- Bosecker, C., Dipietro, L., Volpe, B., Krebs, H. I. Kinematic robot-based evaluation scales and clinical counterparts to measure upper limb motor performance in patients with chronic stroke. Neurorehabilitation and Neural Repair. 24 (1), 62-69 (2010).
- Krebs, H. I., et al. Robotic measurement of arm movements after stroke establishes biomarkers of motor recovery. Stroke. 45 (1), 200-204 (2014).
- Volpe, B. T., et al. Robotic devices as therapeutic and diagnostic tools for stroke recovery. Archives of Neurology. 66 (9), 1086-1090 (2009).
- Hogan, N., et al. Motions or muscles? Some behavioral factors underlying robotic assistance of motor recovery. Journal of Rehabilitation Research and Development. 43 (5), 605-618 (2006).
- Shadmehr, R., Wise, S. P. . The Computational Neurobiology of Reaching and Pointing: A Foundation for Motor Learning. , (2005).
- Dipietro, L., Poizner, H., Krebs, H. I. Spatiotemporal dynamics of online motor correction processing revealed by high-density electroencephalography. J Cogn Neurosci. 26 (9), 1966-1980 (2014).
- Krebs, H., et al. Rehabilitation robotics: Performance-based progressive robot-assisted therapy. Autonomous Robots. 15, 7-20 (2003).
- Colombo, G., Joerg, M., Schreier, R., Dietz, V. Treadmill training of paraplegic patients using a robotic orthosis. Journal of Rehabilitation Research and Development. 37 (6), 693-700 (2000).
- Girone, M., et al. A Stewart platform-based system for ankle telerehabilitation. Autonomous Robots. 10, 203-212 (2001).
- Saglia, J. A., Tsagarakis, N. G., Dai, J. S., Caldwell, D. G. A high-performance redundantly actuated parallel mechanism for ankle rehabilitation. The International Journal of Robotics Research. 28 (9), 1216-1227 (2009).
- Yoon, J., Ryu, J. A novel reconfigurable ankle/foot rehabilitation robot. , 2290-2295 (2005).
- Ruthenberg, B. J., Wasylewski, N. A., Beard, J. E. An experimental device for investigating the force and power requirements of a powered gait orthosis. Journal of Rehabilitation Research and Development. 34 (2), 203-213 (1997).
- Forrester, L. W., et al. Clinical application of a modular ankle robot for stroke rehabilitation. NeuroRehabilitation. 33 (1), 85-97 (2013).
- Díaz, I., Gil, J. J., Sánchez, E. Lower-limb robotic rehabilitation: Literature review and challenges. Journal of Robotics. 2011, 759764 (2011).
- Zhang, X., Yue, Z., Wang, J. Robotics in lower-limb rehabilitation after stroke. Behavioural Neurology. 2017, 3731802 (2017).
- Zhang, M., Davies, T. C., Xie, S. Effectiveness of robot-assisted therapy on ankle rehabilitation – a systematic review. Journal of NeuroEngineering and Rehabilitation. 10, 30 (2013).
- Lo, K., Stephenson, M., Lockwood, C. Effectiveness of robotic assisted rehabilitation for mobility and functional ability in adult stroke patients: a systematic review protocol. JBI Database of Systematic Reviews and Implementation Reports. 15 (1), 39-48 (2017).
- Belda-Lois, J. M., et al. Rehabilitation of gait after stroke: a review towards a top-down approach. Journal of NeuroEngineering and Rehabilitation. 8, 66 (2011).
- Bortole, M., et al. The H2 robotic exoskeleton for gait rehabilitation after stroke: early findings from a clinical study. Journal of NeuroEngineering and Rehabilitation. 12, 54 (2015).
- Banala, S. K., Kim, S. H., Agrawal, S. K., Scholz, J. P. Robot assisted gait training with active leg exoskeleton (ALEX). IEEE Transactions on Neural Systems and Rehabilitation Engineering. 17 (1), 2-8 (2009).
- Bartenbach, V., Wyss, D., Seuret, D., Riener, R. A lower limb exoskeleton research platform to investigate human-robot interaction. 2015 IEEE International Conference on Rehabilitation Robotics (ICORR). 2015, 600-605 (2015).
- Hinkle, J. L., et al. Poststroke fatigue: Emerging evidence and approaches to management: A scientific statement for healthcare professionals from the American heart association. Stroke. 48 (7), e159-e170 (2017).
- Balardin, J. B., Zimeo Morais, G. A., Furucho, R. A., Trambaiolli, L. R., Sato, J. R. Impact of communicative head movements on the quality of functional near-infrared spectroscopy signals: negligible effects for affirmative and negative gestures and consistent artifacts related to raising eyebrows. Journal of Biomedical Optics. 22 (4), 4601 (2017).
- Nazeer, H., Naseer, N., Mehboob, A., Khan, M. J., Khan, R. A., Khan, U. S., Ayaz, Y. Enhancing classification performance of fNIRS-BCI by identifying cortically active channels using the z-score method. Sensors. 20 (23), 6995 (2020).
- Ayaz, H., et al. Optical imaging and spectroscopy for the study of the human brain: status report. Neurophotonics. 9, S24001 (2022).
- Chen, W. L., et al. Functional near-infrared spectroscopy and its clinical application in the field of neuroscience: Advances and future directions. Frontiers in Neuroscience. 14, 724 (2020).
- Yamamoto, K., Miyata, T., Onozuka, A., Koyama, H., Ohtsu, H., Nagawa, H. Plantar flexion as an alternative to treadmill exercise for evaluating patients with intermittent claudication. European Journal of Vascular and Endovascular Surgery. 33 (3), 325-329 (2007).
- Formenti, D., et al. Effects of knee extension with different speeds of movement on muscle and cerebral oxygenation. PeerJ. 6, 5704 (2018).
- Miyai, I., et al. Cortical mapping of gait in humans: a near-infrared spectroscopic topography study. NeuroImage. 14 (5), 1186-1192 (2001).
- Miyai, I., et al. Premotor cortex is involved in restoration of gait in stroke. Annals of Neurology. 52 (2), 188-194 (2002).
- Mihara, M., et al. Sustained prefrontal activation during ataxic gait: a compensatory mechanism for ataxic stroke?. NeuroImage. 37 (4), 1338-1345 (2007).
- Rea, M., et al. Lower limb movement preparation in chronic stroke: A pilot study toward an fNIRS-BCI for gait rehabilitation. Neurorehabilitation and Neural Repair. 28 (6), 564-575 (2014).
- Holtzer, R., Verghese, J., Allali, G., Izzetoglu, M., Wang, C., Mahoney, J. R. Neurological gait abnormalities moderate the functional brain signature of the posture first hypothesis. Brain Topography. 29 (2), 334-343 (2016).
- Kim, H. Y., Yang, S. P., Park, G. L., Kim, E. J., You, J. S. Best facilitated cortical activation during different stepping, treadmill, and robot-assisted walking training paradigms and speeds: A functional near-infrared spectroscopy neuroimaging study. NeuroRehabilitation. 38 (2), 171-178 (2016).
- Khan, H., Nazeer, H., Engell, H., Naseer, N., Korostynska, O., Mirtaheri, P. Prefrontal cortex activation measured during different footwear and ground conditions using fNIRS-A case study. 2021 IEEE International Conference on Artificial Intelligence and Mechatronics Systems (AIMS). , 1-6 (2021).
- Lin, P. Y., Chen, J. J., Lin, S. I. The cortical control of cycling exercise in stroke patients: an fNIRS study). Human Brain Mapping. 34 (10), 2381-2390 (2013).
- Yang, M., Yang, Z., Yuan, T., Feng, W., Wang, P. A systemic review of functional near-infrared spectroscopy for stroke: Current application and future directions. Frontiers in Neurology. 10, 58 (2019).
- Berger, A., Horst, F., Müller, S., Steinberg, F., Doppelmayr, M. Current state and future prospects of EEG and fNIRS in robot-assisted gait rehabilitation: A brief review. Frontiers in Human Neuroscience. 13, 172 (2019).
- Khan, R. A., Naseer, N., Qureshi, N. K., et al. fNIRS-based Neurorobotic Interface for gait rehabilitation. J NeuroEngineering Rehabil. 15 (1), 7 (2018).
- Khan, H., Naseer, N., Yazidi, A., Eide, P. K., Hassan, H. W., Mirtaheri, P. Analysis of Human Gait Using Hybrid EEG-fNIRS-Based BCI System: A Review. Front. Hum. Neurosci. 14, (2020).
- Delpy, D. T., Cope, M. Quantification in tissue near-infrared spectroscopy. Philosophical Transactions of the Royal Society B: Biological Sciences. 352 (1354), 649-659 (1997).
- Huppert, T. J. Commentary on the statistical properties of noise and its implication on general linear models in functional near-infrared spectroscopy. Neurophotonics. 3, 010401 (2016).
- Alexandre, F., Heraud, N., Oliver, N., Varray, A. Cortical implication in lower voluntary muscle force production in non-hypoxemic COPD patients. PLoS One. 9 (6), 100961 (2014).
- Yoon, T., Vanden Noven, M. L., Nielson, K. A., Hunter, S. K. Brain areas associated with force steadiness and intensity during isometric ankle dorsiflexion in men and women. Experimental Brain Research. 232 (10), 3133-3145 (2014).
- Ciccarelli, O., et al. Identifying brain regions for integrative sensorimotor processing with ankle movements. Experimental Brain Research. 166 (1), 31-42 (2005).
- Udina, C., et al. Functional near-infrared spectroscopy to study cerebral hemodynamics in older adults during cognitive and motor tasks: A review. Frontiers in Aging Neuroscience. 11, 367 (2020).
- Thickbroom, G. W., Phillips, B. A., Morris, I., Byrnes, M. L., Mastaglia, F. L. Isometric force-related activity in sensorimotor cortex measured with functional MRI. Experimental Brain Research. 121 (1), 59-64 (1998).
- Derosière, G., Alexandre, F., Bourdillon, N., Mandrick, K., Ward, T. E., Perrey, S. Similar scaling of contralateral and ipsilateral cortical responses during graded unimanual force generation. NeuroImage. 85 (1), 471-477 (2014).
- Shi, P., Li, A., Yu, H. Response of the cerebral cortex to resistance and non-resistance exercise under different trajectories: A functional near-infrared spectroscopy study. Frontiers in Neuroscience. 15, 685920 (2021).
- Dettmers, C., et al. Relation between cerebral activity and force in the motor areas of the human brain. Journal of Neurophysiology. 74 (2), 802-815 (1995).
- Keisker, B., Hepp-Reymond, M. C., Blickenstorfer, A., Kollias, S. S. Differential representation of dynamic and static power grip force in the sensorimotor network. The European Journal of Neuroscience. 31 (8), 1483-1491 (2010).
- Harada, T., Miyai, I., Suzuki, M., Kubota, K. Gait capacity affects cortical activation patterns related to speed control in the elderly. Experimental Brain Research. 193 (3), 445-454 (2009).
- Saleh, S., et al. The role of premotor areas in dual tasking in healthy controls and persons with multiple sclerosis: An fNIRS imaging study. Frontiers in Behavioral Neuroscience. 12, 296 (2018).
- Bonnal, J., et al. Relation between cortical activation and effort during robot-mediated walking in healthy people: A functional near-infrared spectroscopy neuroimaging study (fNIRS). Sensors. 22 (15), 5542 (2022).
- Shibuya, K., Sadamoto, T., Sato, K., Moriyama, M., Iwadate, M. Quantification of delayed oxygenation in ipsilateral primary motor cortex compared with contralateral side during a unimanual dominant-hand motor task using near-infrared spectroscopy. Brain Research. 1210, 142-147 (2008).
- Dai, T. H., Liu, J. Z., Sahgal, V., Brown, R. W., Yue, G. W. Relationship between muscle output and functional MRI-measured brain activation. Experimental brain research. 140 (3), 290-300 (2001).
- Cabibel, V., Hordacre, B., Perrey, S. Implication of the ipsilateral motor network in unilateral voluntary muscle contraction: the cross-activation phenomenon. Journal of Neurophysiology. 123 (5), 2090-2098 (2020).
- Akselrod, M., Martuzzi, R., Serino, A., vander Zwaag, W., Gassert, R., Blanke, O. Anatomical and functional properties of the foot and leg representation in areas 3b, 1 and 2 of primary somatosensory cortex in humans: A 7T fMRI study. NeuroImage. 159, 473-487 (2017).
- Brigadoi, S., Cooper, R. J. How short is short? Optimum source-detector distance for short-separation channels in functional near-infrared spectroscopy. Neurophotonics. 2 (2), 025005 (2015).
- Funahashi, S. Prefrontal contribution to decision-making under free-choice conditions. Frontiers in Neuroscience. 11, 431 (2017).
- Simon, S. R., Meunier, M., Piettre, L., Berardi, A. M., Segebarth, C. M., Boussaoud, D. Spatial attention and memory versus motor preparation: premotor cortex involvement as revealed by fMRI. Journal of Neurophysiology. 88 (4), 2047-2057 (2002).
- Desmurget, M., Sirigu, A. A parietal-premotor network for movement intention and motor awareness. Trends in Cognitive Sciences. 13 (10), 411-419 (2009).
- Nachev, P., Kennard, C., Husain, M. Functional role of the supplementary and pre-supplementary motor areas. Nature reviews. Neuroscience. 9 (11), 856-869 (2008).
- Thoenissen, D., Zilles, K., Toni, I. Differential involvement of parietal and precentral regions in movement preparation and motor intention. The Journal of neuroscience: the official journal of the Society for Neuroscience. 22 (20), 9024-9034 (2002).
- Al-Quraishi, M. S., Elamvazuthi, I., Tang, T. B., Al-Qurishi, M., Adil, S. H., Ebrahim, M. Bimodal data fusion of simultaneous measurements of EEG and fNIRS during lower limb movements. Brain Sciences. 11 (6), 713 (2021).
- Bishnoi, A., Holtzer, R., Hernandez, M. E. Brain Activation Changes While Walking in Adults with and without Neurological Disease: Systematic Review and Meta-Analysis of Functional Near-Infrared Spectroscopy Studies. Brain sciences. 11 (3), 291 (2021).
- Oh, S., Song, M., Kim, J. Validating attentive locomotion training using interactive treadmill: an fNIRS study. Journal of NeuroEngineering and Rehabilitation. 15 (1), 122 (2018).

