Préparation d’énoprures aziridines non activées et synthèse de biémamide B, D et d’épiallo-isomuscarine
Summary
Dans cette étude, nous préparons les deux énantiomères de l’aziridine-2-carboxylate, qui sont utilisés dans la synthèse asymétrique d’alcaloïdes, y compris le biémamide B et D, et la (-)-épiallo-isomuscarine.
Abstract
Les hétérocycles aziridines contenant de l’azote sont synthétiquement très précieux pour la préparation de molécules azacycliques et acycliques. Cependant, il est très difficile et laborieux de fabriquer des aziridines sous des formes optiquement pures à grande échelle pour appliquer une synthèse asymétrique de composés d’aza. Heureusement, nous avons réussi à obtenir à la fois des énantiomères (2R) et (2S)-aziridine-2-carboxylates avec le groupe α-méthylbenzyle donneur d’électrons au niveau de l’azote en anneau sous forme d’aziridines non activées. Ces aziridines de départ ont deux groupes fonctionnels distincts: un anneau à trois membres hautement réactif et un carboxylate polyvalent. Ils sont applicables dans l’ouverture de l’anneau ou la transformation de l’anneau avec l’aziridine et dans la transformation du groupe fonctionnel à d’autres à partir du carboxylate. Ces deux énantiomères ont été utilisés dans la préparation de composés aminés acycliques et/ou aza-hétérocycliques biologiquement importants de manière asymétrique. Plus précisément, ce rapport décrit la première synthèse asymétrique opportune des deux énantiomères de produits naturels marins de type 5, 6-dihydrouracile, le biémamide B et D, en tant qu’inhibiteurs potentiels du TGF-β. Cette synthèse consistait en une réaction d’ouverture de l’anneau régio- et stéréosélective de l’aziridine-2-carboxylate et de la formation ultérieure de 4-aminotérastérahydropyrimidine-2,4-dione. Un autre exemple dans ce protocole portait sur une réaction de Mukaiyama hautement stéréosélective d’aziridine-2-carboxylate et d’éther d’énol de silyle, suivant l’ouverture intramoléculaire de l’anneau aziridine pour fournir un accès facile et facile à l'(-)-épiallo-isomuscarine.
Introduction
De petits anneaux constitués de cyclopropanes, d’oxiranes et d’aziridines se trouvent dans divers composés tels que les produits naturels et les médicaments 1,2. Ils sont principalement utilisés comme matières premières exploitant leur souche annulaire. Parmi les composés à trois anneaux, l’aziridine a été étudiée de manière moins approfondie en raison de son instabilité et de sa réactivité incontrôlable3. Comme le montrent les cartes de potentiel électrostatique (Figure 1), un groupe attaché à l’azote-cycle aziridine, qu’il donne ou attire des électrons, rend la basicité de l’azote différente. Cette différence offre un contraste frappant avec la réactivité et la sélectivité des aziridines correspondantes.
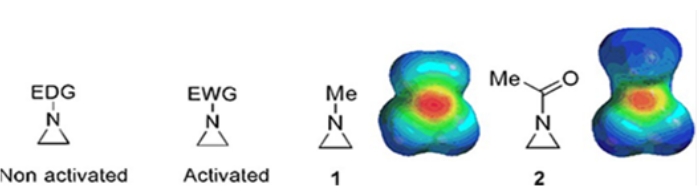
Figure 1 : Structures chimiques des aziridines « activées » et « non activées » et cartes du potentiel électrostatique de leurs exemples représentatifs N-méthylaziridine et N-acétylaziridine4. Cette figure a été modifiée avec la permission de Ranjith et al.4. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Lorsque l’azote annulaire a un groupe de retrait d’électrons, tel que le sulfonate, le phosphonate et le carbamate, nous l’appelons aziridine « activée ». Ceci est facilement réactif avec les nucléophiles pour compenser son instabilité avec une portée limitée de régiochimie. Ces aziridines activées sont préparées par diverses méthodes catalytiques et utilisées comme matière première. Une grande partie de la chimie récente de l’aziridine a traité de ces aziridines activées. Cependant, les aziridines activées souffrent de certaines restrictions résultant de leur instabilité et de la portée de réaction limitée de l’ouverture de l’anneau. D’autre part, les aziridines portant des substituants donneurs d’électrons, comme les groupes alkyle ou alkyle substitué, au niveau de l’azote en anneau appelé « non activé»4, sont relativement stables dans la plupart des circonstances et peuvent être laissées sur le banc pendant une longue période sans décomposition significative. Les réactions nucléophiles d’ouverture de cycle de l’aziridine non activée se produisent via la formation d’ions aziridinium. La plupart des réactions d’ouverture de cycle d’aziridine et de transformations d’anneaux se déroulent de manière hautement régiochimique. Cependant, très peu de rapports de littérature traitent de la préparation d’aziridines optiquement pures non activées avec des substituants aux positions C2 ou C3 5,6.
Cet article montre la préparation réussie de dérivés chiraux d’aziridine-2-carboxylate contenant du groupe α-méthylbenzyle, en particulier des dérivés de (-)-mentholyl(1R)-phényléthylaziridine-2-carboxylates comme mélange diastéréomérique, à partir de la réaction du 2,3-dibromopropionate et de la (1R)-phényléthylamine. À partir de ce mélange diastéréomérique, des énantiopures (1R)-phényléthyl-(2R)- et (2S)-aziridine-2-carboxylates sous forme d’esters (-)-mentholyliques ont été obtenus sous des formes optiquement pures par recristallisation sélective à partir de MeOH et de n-pentane sur des échelles de plusieurs centaines de kilos (Figure 1)7. Ces esters (-)-mentholyliques peuvent être facilement convertis en leurs esters éthyliques ou méthyliques par transestérification en présence de carbonate de magnésium ou de potassium7. Ces composés peuvent également être préparés facilement à l’échelle du laboratoire à partir des réactions des alkyl 2,3-dibromopropionates ou du triflate vinylique du α-cétoester avec la 2-phényléthylamine chirale suivie de la séparation du mélange diastéréomérique par simple chromatographie sur colonne flash8.
Une fois que nous avons énantiopure chiral aziridine-2-carboxylate, nous pouvons synthétiser diverses molécules cibles cycliques et acycliques contenant de l’azote biologiquement importantes sur la base de transformations de groupes fonctionnels de carboxylate et de réactions d’ouverture de cycle aziridine hautement régio- et stéréosélectives 6,9,10. La première synthèse asymétrique expéditive a été appliquée aux deux énantiomères de produits naturels marins de type 5, 6-dihydrouracile, le biémamide B et D, en tant qu’inhibiteurs potentiels du TGF-β11,12. Deuxièmement, la synthèse diastéréosélective des β-(aziridin-2-yl)-β-hydroxycétones a été réalisée par réaction d’aldol mukaiyama de 1-(1-phényléthyl)-aziridine-2-carboxaldéhyde optiquement pure et de divers silanes énols en présence de ZnCl2, à haut rendement (>82%) avec une stéréosélectivité presque parfaite (98:2 dr) via un état de transition contrôlé par chélation. Ceux-ci ont été utilisés pour la synthèse asymétrique des alcaloïdes épiallo-isomuscarine 13,14,15.
Protocol
Representative Results
Discussion
Les aziridines en tant qu’hétérocycles à trois membres contenant de l’azote ont un énorme potentiel pour les martiaux de départ synthétiques ou les intermédiaires pour préparer des molécules organiques riches en azote. Sur la base du groupe portant à l’anneau l’azote, elles sont classées comme aziridines « activées » et « non activées » dont la réactivité chimique et la sélectivité sont différentes. Cependant, des méthodes très limitées sont disponibles pour préparer cette précieuse…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été soutenue par la National Research Foundation of Korea (NRF-2020R1A2C1007102 et 2021R1A5A6002803) avec le Center for New Directions in Organic Synthesis et une subvention HUFS 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
Referenzen
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

