מודל תרבות איברים ניוונית Proinflammatory כדי לדמות מחלת דיסק בין חולייתי בשלב מוקדם.
Summary
פרוטוקול זה מציג מודל ניסיוני חדשני של תרבות איברי שור פרו-פלמטורית ומנוונת כדי לדמות ניוון דיסק בין חולייתי בשלב מוקדם.
Abstract
ניוון דיסק בין חולייתי סימפטומטי (IVD) (IDD) הוא נטל חברתי-כלכלי גדול ומאופיין בדלקת והשפלת רקמות. בשל היעדר טיפולים סיבתיים, יש צורך דחוף במודלים חדשניים של תרבות איברים ניסיונית כדי לחקור את המנגנונים המעורבים בהתקדמות המחלה, למצוא מטרות טיפוליות ולהפחית את הצורך במודלים של בעלי חיים. אנו מציגים כאן פרוטוקול מודל תרבות איברים תלת מימדי חדשני המחקה את המיקרו-ווירון הפרו-פלמטורי והקטבולי, שקיים במהלך IDD.
בתחילה, עירויים של שור נותחו, נוקו ותרביתו במדיום תרבית הרקמות. טעינה פיזיולוגית או פתולוגית דינמית הוחלה בביוריאקטור בהתאמה אישית במשך שעתיים ביום. IVDs הוקצו לקבוצת ביקורת (מדיום גלוקוז גבוה, טעינה פיזיולוגית, הזרקת מלח אגירה פוספט) וקבוצה פתולוגית (בינוני גלוקוז נמוך, טעינה פתולוגית, נמק הגידול גורם אלפא הזרקה) במשך ארבעה ימים. ניתוח ביטוי גנים מתאי פולפוסוס גרעין שנאספו של IVDs ואנליזה אימונוסורבנטית הקשורה לאנזימים של מדיית תרבות האיברים הממוזגת בוצעה.
הנתונים שלנו חשפו ביטוי גבוה יותר של סמנים דלקתיים וגובה דיסק מופחת לאחר טעינה בקבוצה הפתולוגית בהשוואה לקבוצת הביקורת. פרוטוקול זה אמין כדי לדמות דלקת IVD ניוון והוא יכול להיות מורחב עוד יותר כדי להרחיב את היקף היישום שלה.
Introduction
כאבי גב תחתון (LBP) יכולים להשפיע על אנשים בכל הגילאים והוא גורם מוביל לנכות ברחבי העולם1,2,3. העלות הכוללת המשויכת LBP עולה $100 מיליארד דולר בשנה4,5. ניוון דיסק בין חולייתי סימפטומטי (IVD) (IDD), מצב המאופיין בדלקת והשפלת רקמות, הוא הגורם העיקרי של LBP6,7. באופן ספציפי, IDD מאופיין על ידי פירוק מתפתח בהדרגה של המטריצה החוץ תאית של IVD (ECM), המושרה ומופעל על ידי גורמים מרובים שמובילים פתולוגיה מואצת, הפרעות נוירולוגיות, ובסופו של דבר נכות. יתר על כן, IDD קשורה לשחרור ציטוקינים proinflammatory, ביומכניקה בעמוד השדרה שונה, אנגיוגנזה, ו ingrowth עצבי, אשר מגביר את תחושת הכאב, בסך הכל גורם LBP כרונית (דיסקופתיה פעילה)6,8. עד כה, אפשרויות הטיפול כוללות כריתת דיסק והיתוך עוקב של החוליות הסמוכות, השתלת תותבת IVD, או גישות לא כירורגיות, כגון תרופות נוגדות דלקת לא סטרואידים, אופיואידים, ומרפי שרירים לחולים עם IDD9. שתי האפשרויות הטיפוליות הסטנדרטיות הנוכחיות, כירורגיות ולא כירורגיות, יעילות רק בחלקן ולא מצליחות לטפל בבעיה הביולוגית הבסיסית9,10. מחלת דיסק ניוונית בשלב מוקדם מאופיינת בתגובת רקמה דלקתית ראשונית, במיוחד עלייה בביטוי נמק נמק-אלפא גידולי (TNF-alpha)11. שינויים אלה בדיסק מוקדם מתרחשים בעיקר ברמה התאית מבלי לשבש את ארכיטקטורת הדיסק, בעבר יכול להיות חיקוי על ידי מחסור תזונתי בתנאים פרו דלקתיים12. לכן, סימולציה מדויקת של מצב in vivo לחקור מנגנוני ניוון אלה ולמצוא מטרות טיפוליות מתאימות היא קריטית. בנוסף, לסימולציות אלה של תכונות מולקולריות, סביבת הטעינה המכנית של הדיסקים ממלאת תפקיד מפתח בשינויים פתולוגיים ופיזיולוגיים של IVD. כתוצאה מכך, שילוב גישות אלה יביא אותנו צעד אחד קדימה כדי לחקות את microenvironment מורכב של IVD ב vivo. כיום אין מחקרים בהתחשב בהיבט של טעינה דינמית יחד עם ההגדרה הפרו דלקתית והתזונתית למיטב ידיעתנו.
למרות מודלים בעלי חיים גדולים לאפשר את החקירה של פוטנציאל רלוונטי אינטראקציות vivo, הם יקרים ועבודה אינטנסיבית. יתר על כן, כמו השימוש במודלים בעלי חיים במחקר כבר זמן רב עניין של מחלוקת, צמצום מספר בעלי החיים הדרושים כדי לענות על שאלות מחקר חשובות הוא עניין רב. לבסוף, אין כיום מודל חיה אידיאלי לחקות IDD במחקר IVD13,14. לכן, יש צורך להקים תחליף חסכוני ואמין, כגון מודל תרבות איברים כדי לדמות IDD ותהליכים דלקתיים וניוון הקשורים. לאחרונה, היישום של הפרוטוקול הנוכחי על הקמת מודל תרבות איברים proinflammatory ניווני כדי לדמות מחלת דיסק בין חולייתי בשלב מוקדם אפשר לנו לחקור את ההשפעה של תרופות אנטי דלקתיות בתרבות איברים IDD15.
כאן, אנו מתארים כיצד להשיג דיסקים בין חולייתיים שור לגרום למצב של IDD בשלב מוקדם באמצעות microenvironment קטבולי proinflammatory הנגרמת על ידי הזרקה תוך-דיסקית ישירה של נמק הגידול גורם אלפא (TNF-α) וטעינה ניוונית ב bioreactor בתנאים בינוניים מזינים נמוכים. איור 1 ממחיש את המודל הניסיוני ומציג את הביוריאקטור המשמש להדמיית תנאי טעינה ניווניים ופיזיולוגיים.
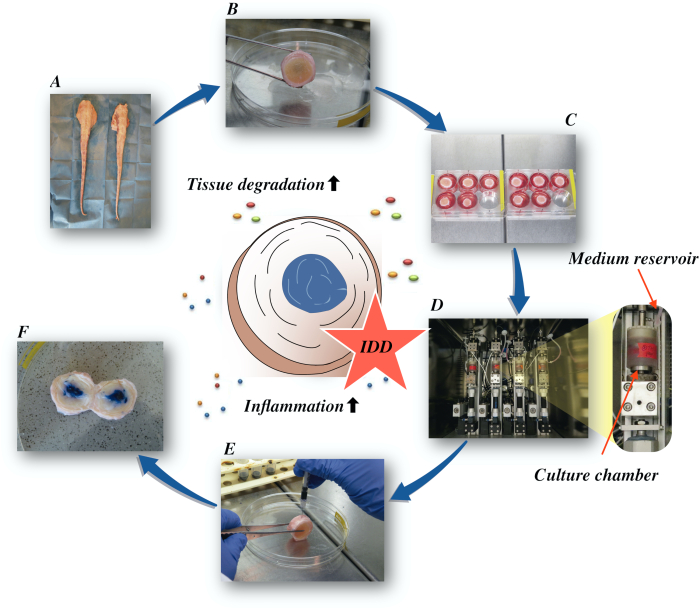
איור 1: איור של ההתקנה הניסיונית. A: זנב שור; B: דיסקים בין חולייתיים של שור מנותח; C: העברת הדיסק לצלחת היטב עם מדיום תרבות; D: טעינת הסימולציה בביוריאקטור; E: טכניקת הזרקה תוך-דיסקית; F: IVD לאחר הזרקה של צבע כחול PBS / trypan כדי לחשוף את ההפצה. IDD: ניוון דיסק בין חולייתי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
סיפקנו כאן פרוטוקול מפורט כדי לדמות IVDD ניווני ודלקתי. פרוטוקול זה יכול להיות מיושם עבור בדיקות מפורטות של מסלולים דלקתיים המובילים להשפעות ההרסניות על הדיסק. יתר על כן, הפרוטוקול יכול לעזור לקבוע מטרות טיפוליות מבטיחות המעורבות בהתקדמות המחלה.
לאחרונה הראינו כי TNF-α רקומבי…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי קרן AO ו- AOSpine הבינלאומי. באבאק סראבי זכה לתמיכת מלגות מקרן עמוד השדרה הגרמנית וקרן דלקת מפרקים ניוונית גרמנית. גרנוט לאנג נתמך על ידי תוכנית ברטה-אוטנשטיין למדענים קליניים מתקדמים, הפקולטה לרפואה, אוניברסיטת פרייבורג, גרמניה.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Referencias
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

