A Proinflammatory, Degenerative Organ Culture Model to Simulate Early-Stage Intervertebral Disc Disease.
Summary
Este protocolo presenta un modelo experimental nuevo de la cultura proinflamatoria, degenerativa del órgano bovino para simular la degeneración intervertebral del disco de la temprano-etapa.
Abstract
La degeneración intervertebral sintomática del disco (IVD) (IDD) es una carga socioeconómica importante y es caracterizada por la inflamación y la degradación del tejido. Debido a la falta de terapias causales, existe una necesidad urgente de modelos experimentales innovadores de cultivo de órganos para estudiar los mecanismos involucrados en la progresión de la enfermedad, encontrar dianas terapéuticas y reducir la necesidad de modelos animales. Aquí presentamos una novela, protocolo tridimensional del modelo de la cultura del órgano mímico el microambiente proinflammatory y catabólico, que está presente durante IDD.
Inicialmente, IVDs caudal bovino fue diseccionado, limpiado, y cultivado en el medio de cultivo del tejido. El cargamento fisiológico o patológico dinámico fue aplicado en un biorreactor a medida por 2 horas por día. Ivds fue asignado a un grupo de control (alto medio de la glucosa, cargamento fisiológico, inyección salina fosfato-tamponada) y a un grupo patológico (medio bajo de la glucosa, cargamento patológico, inyección de la factor-alfa de la necrosis de tumor) por cuatro días. El análisis de la expresión génica de las células pulposus recogidas del núcleo del IVDs y del análisis enzima-ligado del inmunosorbente de los medios condicionados de la cultura del órgano fue realizado.
Nuestros datos revelaron una mayor expresión de marcadores inflamatorios y alturas de disco reducidas después de la carga en el grupo patológico en comparación con el grupo control. Este protocolo es confiable para simular la inflamación y la degeneración de IVD y se puede ampliar más a fondo para ampliar su alcance del uso.
Introduction
El dolor lumbar (LUMB) puede afectar a individuos de todas las edades y es una de las principales causas de discapacidad en todo el mundo1,2,3. El costo total asociado con la lumbalgia supera los $100 mil millones por año4,5. La degeneración intervertebral sintomática del disco (IVD), una condición caracterizada por la inflamación y la degradación del tejido, es una causa importante de LBP6,7. Específicamente, idd es caracterizado por una avería gradualmente de evolución de la matriz extracelular de IVD (ECM), inducida y accionada por los factores múltiples que llevan a una patología acelerada, a los desordenes neurológicos, y eventual a la inhabilidad. Además, la IDD se asocia con la liberación de citoquinas proinflamatorias, biomecánica de columna alterada, angiogénesis y crecimiento nervioso, lo que aumenta la sensación de dolor, causando en conjunto LBP crónica (discopatía activa)6,8. Hasta la fecha, las opciones de tratamiento incluyen discectomía y posterior fusión de las vértebras adyacentes, implantación de una prótesis de IVD o enfoques no quirúrgicos, como fármacos antiinflamatorios no esteroideos, opioides y relajantes musculares para pacientes con IDD9. Las dos opciones terapéuticas estándar actuales, quirúrgicas y no quirúrgicas, son sólo parcialmente eficaces y no abordan el problema biológico subyacente9,10. La enfermedad degenerativa del disco en estadio temprano se caracteriza por una respuesta tisular inflamatoria inicial, especialmente un aumento en la expresión del factor de necrosis tumoral alfa (TNF-alfa)11. Estos cambios tempranos en el disco ocurren principalmente a nivel celular sin interrumpir la arquitectura del disco y previamente podrían ser imitados por la deficiencia nutricional en condiciones proinflamatorias12. Por lo tanto, la simulación precisa de la situación in vivo para investigar estos mecanismos de degeneración y encontrar dianas terapéuticas adecuadas es crucial. Además, para estas simulaciones de propiedades moleculares, el entorno de carga mecánica de los discos juega un papel clave en los cambios patológicos y fisiológicos de la IVD. En consecuencia, la combinación de estos enfoques nos traería un paso adelante para imitar el complejo microambiente de los IVDs in vivo. Actualmente no hay estudios que consideren el aspecto de la carga dinámica junto con el ajuste favorable-inflamatorio y alimenticio al mejor de nuestro conocimiento.
Aunque los modelos animales grandes permiten la investigación de posibles interacciones in vivo relevantes, son costosos y requieren mucho trabajo. Además, dado que el uso de modelos animales en la investigación ha sido durante mucho tiempo un tema de controversia, la reducción del número de animales necesarios para responder a importantes preguntas de investigación es de gran interés. Por último, actualmente no existe un modelo animal ideal para imitar el IDD en la investigacióndel IVD 13,14. Por lo tanto, es necesario establecer un reemplazo rentable y confiable, como un modelo de cultivo de órganos para simular la IDD y los procesos inflamatorios y degenerativos asociados. Recientemente, la aplicación del presente protocolo sobre el establecimiento de un modelo de cultivo de órganos proinflamatorios y degenerativos para simular la enfermedad del disco intervertebral en estadio temprano nos permitió investigar el efecto de los fármacos antiinflamatorios en el cultivo de órganos IDD15.
Aquí, describimos cómo obtener los discos intervertebrales bovinos e inducir el estado de idd de la temprano-etapa vía un microambiente catabólico y proinflammatory causado por la inyección intradiscal directa de la factor-alfa de la necrosis de tumor (TNF-α) y del cargamento degenerativo en un biorreactor bajo condiciones medias nutritivas bajas. La Figura 1 ilustra el modelo experimental y muestra el biorreactor utilizado para simular condiciones de carga degenerativas y fisiológicas.
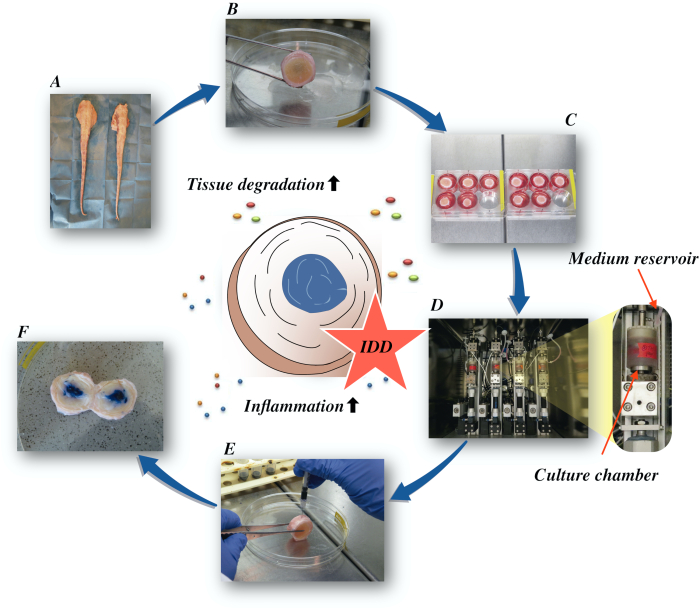
Figura 1:Ilustración de la configuración experimental. A: cola de bovino; B: discos intervertebrales bovinos disecados; C: transferencia del disco a un pozo-plato con medio de cultivo; D: carga de la simulación en un biorreactor; E: técnica de inyección intradiscal; F: IVD después de la inyección de PBS/tinte azul tripano para revelar la distribución. IDD: degeneración del disco intervertebral. Haga clic aquí para ver una versión más amplia de esta figura.
Protocol
Representative Results
Discussion
Aquí proporcionamos un protocolo detallado para simular IVDD degenerativo e inflamatorio. Este protocolo se puede aplicar para las examinaciones detalladas de los caminos inflamatorios que llevan a los efectos destructivos sobre el disco. Además, el protocolo puede ayudar a determinar dianas terapéuticas prometedoras implicadas en la progresión de la enfermedad.
Recientemente demostramos que el TNF-α recombinante humano podría inducir inflamación tanto en células NP bovinas como humana…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por la Fundación AO y AOSpine International. Babak Saravi recibió apoyo de becas de la Fundación Alemana de la Columna Vertebral y la Fundación Alemana de Osteoartritis. Gernot Lang recibió el apoyo del Programa Berta-Ottenstein para Científicos Clínicos Avanzados de la Facultad de Medicina de la Universidad de Friburgo (Alemania).
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
Referencias
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

