Gebruik van het GAL4-UAS-systeem voor functionele genetica in Anopheles gambiae
Summary
Het bipartiete GAL4-UAS systeem is een veelzijdig instrument voor modificatie van genexpressie op een gecontroleerde spatiotemporale manier die functionele genetische analyse in Anopheles gambiae mogelijk maakt. De beschreven procedures voor het gebruik van dit systeem zijn een semi-gestandaardiseerde kloonstrategie, seksing en screening van poppen op fluorescerende eiwitmarkers en embryofixatie.
Abstract
Het bipartiete GAL4-UAS systeem is een veelzijdig en krachtig hulpmiddel voor functionele genetische analyse. De essentie van het systeem is het kruisen van transgene ‘driver’-lijnen die de gisttranscriptiefactor GAL4 op een weefselspecifieke manier tot expressie brengen, met transgene ‘responder’-lijnen die een kandidaat-gen / RNA-interferentieconstruct dragen waarvan de expressie wordt gecontroleerd door Upstream Activation Sequences (UAS) die GAL4 binden. In het daaropvolgende nageslacht wordt het gen of de uitschakelingsconstruct dus op een voorgeschreven spatiotemporale manier tot expressie gebracht, waardoor de resulterende fenotypen kunnen worden getest en de genfunctie kan worden afgeleid. Het binaire systeem maakt flexibiliteit mogelijk in experimentele benaderingen van schermfenotypen gegenereerd door transgene expressie in meerdere weefselspecifieke patronen, zelfs als ernstige fitnesskosten worden geïnduceerd. We hebben dit systeem aangepast voor Anopheles gambiae, de belangrijkste malariavector in Afrika.
In dit artikel geven we enkele van de meest voorkomende procedures die worden gebruikt tijdens GAL4-UAS-analyse. We beschrijven de An. gambiae GAL4-UAS-lijnen die al zijn gegenereerd, evenals het klonen van nieuwe responderconstructies voor upregulatie en RNAi knockdown. We specificeren een stapsgewijze handleiding voor het seksen van muggenpoppen om genetische kruisingen vast te stellen, die ook screening van nakomelingen omvat om overerving van fluorescerende genmarkers te volgen die de driver en responder inserties taggen. We presenteren ook een protocol voor het opruimen van An. gambiae embryo’s om de embryonale ontwikkeling te bestuderen. Ten slotte introduceren we mogelijke aanpassingen van de methode om driverlijnen te genereren door CRISPR / Cas9-insertie van GAL4 stroomafwaarts van doelgenen.
Introduction
Het bipartiete GAL4-UAS-systeem is het werkpaard van functionele karakterisering van genen in het insectenmodelorganisme Drosophila melanogaster1,2,3. Om het GAL4-UAS-systeem te gebruiken, worden transgene driverlijnen, die de gisttranscriptiefactor GAL4 onder controle van een regulerende sequentie tot expressie brengen, gekruist met responderlijnen die een gen van belang of RNA-interferentie (RNAi) -construct dragen dat wordt bestuurd door een Upstream Activation Sequence (UAS) erkend door GAL4. Het nageslacht van dit kruis drukt het transgen van belang uit in een spatiotemporaal patroon gedicteerd door de promotor die gal4-expressie controleert (figuur 1). Fenotypen die worden weergegeven door nakomelingen van driver-responder-kruisingen kunnen worden beoordeeld om de functie van kandidaatgenen op te helderen. Hoewel D. melanogaster is gebruikt om genen van andere organismen te onderzoeken4,5,6,7, is het GAL4-UAS-systeem nu aangepast voor gebruik bij insecten van medisch en agrarisch belang om directe analyse te bieden in de soorten van belang 8,9,10,11,12,13,14.
In de Afrikaanse malariamug Anopheles gambiae werd het GAL4-UAS-systeem voor het eerst getest door cellijn co-transfection9. Meerdere constructies werden getest op efficiëntie in verschillende paarsgewijze combinaties en ontdekten dat 14 gelijktijdig herhaalde UAS aangevuld met een kleine kunstmatige intron (UAS-14i) het breedste bereik van activeringspotentieel vertoonden bij gebruik met een paneel van GAL4-drivers. Om in vivo functionaliteit aan te tonen, werden deze constructies vervolgens gebruikt om twee afzonderlijke transgene An. gambiae-lijnen te creëren door PiggyBac transformation8: een driverlijn met GAL4 aangedreven door een midgut-specifieke promotor, en een responderlijn met zowel de luciferase- als de enhanced yellow fluorescent protein (eYFP) -genen onder regulatie van UAS-sequenties. Darmspecifieke luciferaseactiviteit en fluorescentie in het nageslacht gaven aan dat het systeem efficiënt was in Anopheles. Sindsdien zijn driverlijnen gemaakt die transgenen tot expressie brengen in andere weefsels die belangrijk zijn voor vectoriële capaciteit en insecticideresistentie, waaronder oenocyten15 en hemocyten16, en in een bijna alomtegenwoordig patroon10. Talrijke UAS-lijnen zijn ook gegenereerd om genen te testen waarvan wordt gedacht dat ze betrokken zijn bij metabolisme en sequestratie gemedieerde insecticideresistentie, cuticulaire koolwaterstofsynthese en om fluorescerend verschillende cel- en weefseltypen te taggen (tabel 1). Voor de responderlijnen wordt nu site-gerichte integratie van het transgen uitgevoerd door ΦC31 gekatalyseerde recombinatiecassette-uitwisseling17,18 om de genomische context van de UAS-gereguleerde genen te fixeren. Op deze manier wordt transgenexpressie genormaliseerd met betrekking tot de locatie van genomische insertie, waardoor een nauwkeurigere vergelijking van de fenotypische effecten van verschillende kandidaatgenen mogelijk is.
De responderlijnen die tot nu toe zijn gemaakt, zijn ontworpen om het transgen op verhoogde niveaus tot expressie te brengen of om genexpressie te verminderen door RNA-interferentie (RNAi). Gewoonlijk worden cDNA-klonen gefuseerd met de UAS-sequentie om geschikte expressieplasmiden te genereren, maar volledige genomische sequenties zijn ook haalbaar, ervan uitgaande dat ze niet te groot zijn om te klonen. Om dempingsconstructies te genereren, hebben we drie verschillende methoden gebruikt om geschikte tandem-omgekeerde sequenties te verkrijgen die haarspeld-dsRNA vormen dat RNAi stimuleert. Deze omvatten fusie-PCR, asymmetrische PCR en commerciële synthese van haarspeldconstructies. Gemeenschappelijk aan elke methode is de opname van een intronsequentie tussen de omgekeerde sequenties om kloonstabiliteit te bieden. Responderplasmiden waarin een gen van belang/RNAi-construct kan worden ingebracht, zijn ontwikkeld15. Deze plasmiden dragen ook de vereiste ΦC31 attB-locaties voor RMCE (beschreven in Adolfi bijgaand JoVE-artikel waarin de RCME-techniek in detail wordt beschreven). Protocollen met betrekking tot de belangrijke stappen die nodig zijn bij het selecteren van de volgorde voor inbrenging in een van deze plasmiden voor overexpressie zijn opgenomen in dit manuscript. Daarnaast worden twee protocollen voor het maken van RNAi-haarspeldconstructies beschreven en geïllustreerd.
Bij het creëren van nieuwe lijnen is de identificatie van zeldzame transgene individuen cruciaal om uit te fokken om transgene kolonies te vestigen en te onderhouden. Het belangrijkste voor het GAL4-UAS-systeem is dat het noodzakelijk is om de responder- en driverlijnen te onderscheiden om kruisen vast te stellen en individuele nakomelingen te identificeren die beide transgenen dragen. Dit wordt bereikt door gebruik te maken van verschillende dominante selecteerbare markergenen die zijn gekoppeld aan de driver- en respondercassettes. Meestal zijn dit fluorescerende markergenen die duidelijk te onderscheiden zijn met behulp van optische filters (bijv. eYFP, eCFP, dsRed). Het is belangrijk dat markers worden uitgedrukt in een bekend en betrouwbaar spatiotemporaal patroon, omdat dit de identificatie van afwijkingen en besmetting gemakkelijker maakt. Fluorescerende markergenexpressie wordt routinematig gereguleerd door de synthetische 3xP3-promotor , die oog- en ventrale gangliaspecifieke expressie veroorzaakt in alle stadia van an. gambiae ontwikkeling19. Fluorescerende markers gecontroleerd door 3xP3 zijn opgenomen in alle transformatieplasmiden die in dit artikel worden beschreven. Een protocol met de gebruikelijke methoden die worden gebruikt om fluorescerende An. gambiae poppen GAL4-UAS-lijnen te screenen, is hier opgenomen.
Een van de belangrijkste elementen van het GAL4-UAS-systeem is de noodzaak om de differentieel gemarkeerde driver- en responderlijnen te overschrijden. Om dit te doen, moeten mannetje en vrouwtjes van elke lijn worden gescheiden voorafgaand aan de paring. Volwassenen zijn gemakkelijk te onderscheiden door zicht, maar voor het vaststellen van genetische kruisingen is het verstandig om de geslachten te scheiden vóór de opkomst van de volwassene om ervoor te zorgen dat de paring niet heeft plaatsgevonden. Het algemene grootteverschil tussen mannelijke en vrouwelijke An. gambiae poppen is te variabel om een efficiënte en betrouwbare methode voor geslachtsbepaling te zijn20. In plaats daarvan bieden duidelijke morfologische verschillen in de uitwendige genitaliën een betrouwbare basis voor seks bij An. gambiae. In dit artikel beschrijven we een betrouwbare methode voor het seksen van An. gambiae poppen om geschikte kruisingen op te zetten.
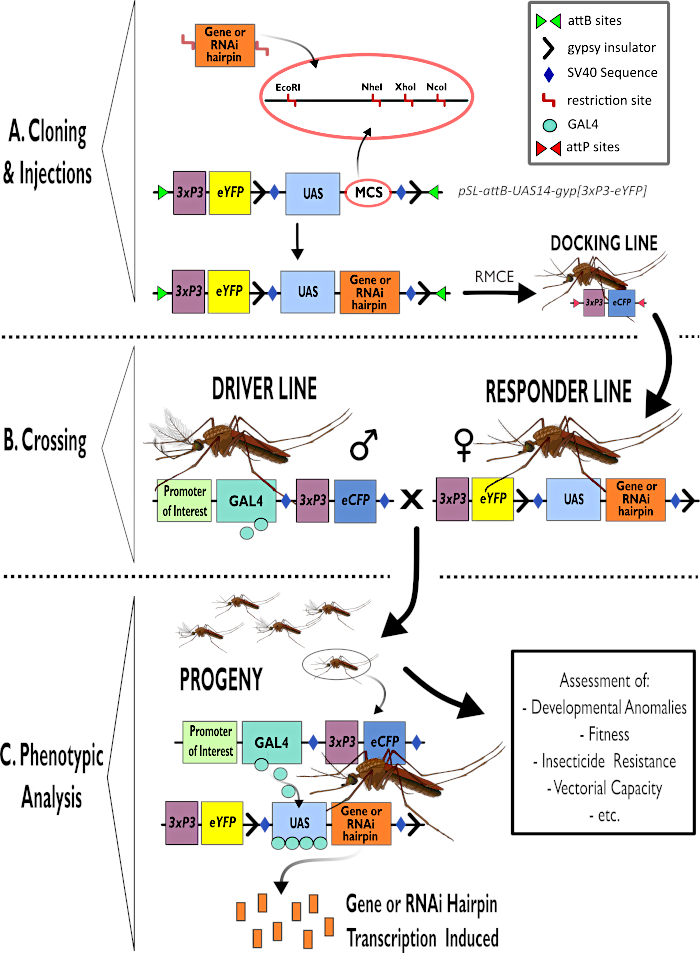
Figuur 1 – Schematische weergave van het proces voor het gebruik van het bipartiete GAL4-UAS-systeem in Anopheles gambiae. (A) De belangrijkste componenten van een voorbeeldvector (pSL-attB-UAS14-gyp[3xp3-eYFP]) worden afgebeeld, met details over de beschikbare beperkingslocaties (EcoRI, NheI, XhoI en NcoI) binnen de meerdere kloonlocaties die geschikt zijn voor gebruik om de haarspeldconstructie of coderende sequentie voor het betreffende gen in te voegen. Ook de structuur van de doklijn is afgebeeld. (B) De kruisingsstap is geïllustreerd met vermelding van het gebruik van mannetjes van de bestuurderslijn (met GAL4-driver door een promotor van belang en eCFP bestuurd door de 3xP3-promotor) en vrouwtjes van de responderlijn (met het gen van belang of haarspeldconstructie gecontroleerd door een UAS-promotor en een eYFP-marker gecontroleerd door de 3xP3-promotor). (C) Een schematische weergave van GAL4-drijvende expressie van het gen dat van belang is voor het nageslacht van de kruising in B en een lijst van enkele van de typische fenotypen die worden beoordeeld. Afkortingen: Multiple Cloning Site (MCS), Recombinase mediated cassette exchange (RMCE), Upstream Activator Sequence (UAS), enhanced yellow fluorescent protein (eYFP), enhanced cyan fluorescent protein (eCFP). Klik hier om een grotere versie van deze figuur te bekijken.
Het is het gebruik van kruisen dat de bipartiete aard van het GAL4-UAS-systeem biedt, dat duidelijke voordelen heeft ten opzichte van meer lineaire benaderingen. Zo kunnen er veel meer combinaties van driver- en responderlijnen worden beoordeeld dan haalbaar zou zijn als voor elke promotor/gencombinatie een nieuwe transgene lijn zou moeten worden gegenereerd en onderhouden. Wat nog belangrijker is, het maakt de analyse mogelijk van genen die dodelijke of steriele fenotypes produceren wanneer hun expressie wordt verstoord en die moeilijk te creëren / onderhouden zijn in een lineair systeem. Dergelijke dodelijke fenotypen kunnen zich in alle ontwikkelingsstadia manifesteren, afhankelijk van de genfunctie en spatiotemporale expressie, maar worden meestal waargenomen tijdens de embryonale ontwikkeling. Het visualiseren van de ontwikkeling van muggenembryo’s vereist het opruimen van het ondoorzichtige chorion dat de eieren bedekt. Volgens methoden beschreven in Trpiš (1970) 21 en Kaiser et al. (2014) 22, beschrijven we de protocollen die we gebruiken om embryo’s te fixeren, met behoud van structurele integriteit, en bleken om het endochorion te verwijderen dat microscopische visualisatie en beeldvorming mogelijk maakt.
Protocol
Representative Results
Discussion
Het begrijpen van de functie van muggengenen is van vitaal belang om nieuwe benaderingen te ontwikkelen om Anopheles te beheersen en de overdracht van malaria te beïnvloeden. Het beschreven GAL4-UAS-systeem is een veelzijdig en krachtig systeem voor functionele analyse van kandidaat-genen en tot op heden hebben we het systeem gebruikt om de genetische basis van insecticideresistentie17 en cuticulaire koolwaterstofproductie15,23 te onderzoeken, evenals om verschillende muggencelpopulaties…
Divulgaciones
The authors have nothing to disclose.
Acknowledgements
We erkennen dankbaar de financiering van LSTM en IVCC (Adriana Adolfi), BBSRC (New Investigator Award (AL), MRC (PhD studentship to BCP:MR/P016197/1), Wellcome (Sir Henry Wellcome Postdoctoral fellowship to LG: 215894/Z/19/Z) die Gal4UAS-analyse in de voorstellen hebben opgenomen.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
Referencias
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genética. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genética. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Biología del desarrollo. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

